Bài viết Tổn thương thận cấp tính ở những bệnh nhân bị bệnh nặng với COVID-19 được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: Acute kidney injury in critically ill patients with COVID-19
Ghi nhớ
Tổn thương thận cấp tính (AKI) khi nhiễm SARS- CoV-2 có liên quan đến tỷ lệ tử vong cao ở ICU. Sinh lý bệnh của AKI hiện dựa vào các cơ chế không đặc hiệu (giảm thể tích tuần hoàn, thuốc gây độc cho thận, PEEP cao, suy tim phải), tổn thương do virus trực tiếp, kích hoạt hệ thống Renin-Angiotensin-Aldosterone (RAAS) mất cân bằng, sự gia tăng của các cytokine gây viêm. nhiễm vi-rút và rối loạn tình trạng đông máu. Cho đến nay, không có phương pháp điều trị cụ thể nào đối với AKI do COVID-19 gây ra.
Giới thiệu
Kể từ tháng 12 năm 2019, một loại coronavirus mới được gọi là SARS-CoV-2 (coronavirus 2 gây hội chứng hô hấp cấp tính nghiêm trọng) đã gây ra một đợt bùng phát bệnh đường hô hấp trên toàn cầu được gọi là COVID-19. Vào ngày 26 tháng 5 năm 2020, 5.404.512 trường hợp xác nhận nhiễm COVID-19 bao gồm 343.514 trường hợp tử vong đã được Tổ chức Y tế Thế giới báo cáo. Tổn thương thận cấp tính (AKI) là tình trạng thường xuyên xảy ra ở những bệnh nhân bị bệnh nặng, đặc biệt là ở những người bị nhiễm trùng nặng, và có liên quan đến tỷ lệ mắc và tử vong đáng kể [1]. Kể từ khi đợt bùng phát SARS-CoV-2 mới bắt đầu, một số nghiên cứu đã tập trung vào các biến chứng phổi, cụ thể là hội chứng nguy kịch hô hấp cấp tính, là tình trạng hàng đầu khi nhập viện chăm sóc đặc biệt (ICU) và có liên quan đến tỷ lệ tử vong cao [2-5]. Ban đầu người ta ít chú ý đến tỷ lệ AKI ở những bệnh nhân này, và sự liên quan đến thận được coi là không đáng kể [6]. Tuy nhiên, ngày càng có nhiều bằng chứng cho thấy AKI phổ biến ở bệnh nhân COVID-19 và SARS-CoV-2 xâm nhập đặc biệt vào thận.
Dịch tễ học
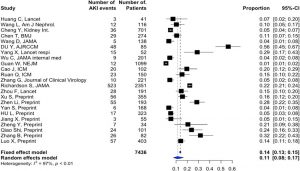
Trong một loạt trường hợp gồm 116 bệnh nhân Trung Quốc không bị bệnh nặng từ Vũ Hán, Wang L. et al. đã phát hiện ra rằng chỉ có 12 (10,8%) tăng nhẹ creatinine huyết thanh hoặc nitơ urê trong 48 giờ đầu tiên nằm viện [6]. Tuy nhiên, điều này đã bị thách thức bởi hầu hết các phát hiện gần đây. Như được trình bày trong Bảng S1, AKI trong thời gian nằm viện được báo cáo với tỷ lệ mắc bệnh trung bình là 11% (8– 17%), với phạm vi cao nhất ở nhóm bệnh nặng là 23% (14–35%) (Bảng S1, Hình. 1 và 2). Đáng chú ý, liệu pháp thay thế thận (RRT, renal replacement therapy) đã được sử dụng cho gần 5% bệnh nhân bị bệnh nặng. Những kết quả này phải được diễn giải một cách thận trọng. Thật vậy, tỷ lệ mắc AKI thực tế, đặc biệt là ở ICU, vẫn chưa chắc chắn và có thể đã bị đánh giá thấp do thiết kế hồi cứu của các nghiên cứu và thiếu các định nghĩa AKI rõ ràng trong hầu hết các báo cáo (Bảng S1). Đáng lưu ý, mặc dù một số nghiên cứu đã sử dụng định nghĩa của Cải thiện Kết quả Toàn cầu về Bệnh thận (KDIGO, Kidney Disease Improving Global Outcomes) [4,6-13], không có nghiên cứu nào báo cáo các giai đoạn của AKI. Tại trung tâm của chúng tôi, trong một nhóm thuần tập gồm 99 bệnh nhân nặng bị nhiễm SARS-CoV-2 nặng, 42 bệnh nhân (42,9%) đã phát triển AKI và trong số đó có 32 (74,4%) AKI nặng (KDIGO giai đoạn III). RRT được yêu cầu ở 13 bệnh nhân (13,4%) (dữ liệu chưa được công bố). Sự khác biệt này trong các nghiên cứu có thể được giải thích bởi các yếu tố khác như chủng tộc, đặc điểm của bệnh nhân (mắc bệnh đi kèm, hút thuốc), mức độ nghiêm trọng của bệnh (bao gồm tất cả các trường hợp lâm sàng so với chỉ các trường hợp được phòng xét nghiệm xác nhận) và sự thay đổi trong thực hành tại địa phương liên quan đến quản lý dịch và huyết động, chiến lược thông khí và sử dụng thuốc. Những phát hiện dịch tễ học này cũng nên được đưa vào quan điểm với các báo cáo trước đây về các quá trình đại dịch khác, chẳng hạn như bệnh cúm H1N1, nơi các tỷ lệ mắc bệnh tương tự đã được mô tả.

Dòng thời gian bắt đầu AKI là một vấn đề khác. Chỉ có bốn nghiên cứu báo cáo AKI khi nhập viện [5,10,11,14], với tỷ lệ mắc bệnh từ 1% [5] đến 29% [11] (Bảng S1). Trong hầu hết các nghiên cứu, AKI phát triển trong suốt thời gian nằm viện, trung bình từ 5 đến 9 ngày sau khi nhập viện [11,15,16]. AKI phát triển thường xuyên hơn ở những bệnh nhân mắc bệnh nặng nhất (đặc biệt là ARDS nặng, cần thở máy xâm nhập), người lớn tuổi hoặc những người có bệnh kèm theo như tăng huyết áp hoặc đái tháo đường [8,17]. Như được trình bày trong Bảng S1, những tình trạng này thường gặp ở những bệnh nhân nhập viện vì nhiễm SARS-CoV-2 nặng.
AKI là một yếu tố tiên lượng xấu được công nhận tốt [18]. Trong trường hợp nhiễm SARS-CoV-2, năm nghiên cứu đã tìm thấy mối liên quan đáng kể giữa suy thận và tử vong [8,9,11,17,19]. Điều thú vị là Cheng et al. [9] đã phát hiện ra rằng chỉ AKI giai đoạn 2 trở lên mới có nguy cơ tử vong cao hơn [HR: 3,53 (1,5–8,27)].
Phân tích nước tiểu khi nhiễm SARS- CoV-2
Song song với rối loạn chức năng thận được xác định bởi sự gia tăng creatinin huyết thanh, một số nghiên cứu đã chỉ ra những bất thường trong cặn nước tiểu.
Protein niệu và tiểu máu
Protein niệu thường được quan sát thấy khi nhiễm SARS-CoV-2 và được báo cáo trong 7 đến 63% các trường hợp [6,9,20,21]. Cheng et al. báo cáo tiểu máu ở 26,7% bệnh nhân [9]. Hai kiểu hình của protein niệu đã được xác định: hầu hết thời gian protein niệu có mức định tính thấp, được đánh giá là 1+ trên que thử nước tiểu, có thể phản ánh tổn thương ống thận. Trong một số trường hợp, protein niệu nhiều hoặc được tạo thành bởi albumin cho thấy có sự suy giảm chức năng cầu thận. Tổn thương virut đối với tế bào có chân (podocytes) mà còn kích hoạt RAAS có thể góp phần gây ra protein niệu: Sự tích tụ của angiotensin II có thể là nguyên nhân gây ra nhập bào nephrin (nephrin endocytosis) và sau đó làm tăng tính thấm của cầu thận với protein niệu [22]. Hai trường hợp tiểu ra nhiều protein liên quan đến AKI nặng và bệnh cầu thận xẹp mô học đã được báo cáo ở 2 bệnh nhân da đen nhập viện vì nhiễm SARS-CoV-2 [23,24]. Dạng bệnh cầu thận này có liên quan đến nhiều tình trạng khác nhau, bao gồm cả nhiễm virut [25]. Điều thú vị là cả protein niệu và đái máu đều có liên quan chặt chẽ đến việc tăng tỷ lệ tử vong tại bệnh viện [9].
Những kết quả này nên được giải thích một cách thận trọng vì một số lý do. Đầu tiên, protein niệu được đo khi nhập viện mà không có các giá trị trước đó. Tuy nhiên, những bệnh nhân được đưa vào các nghiên cứu này thường có các yếu tố nguy cơ gây suy thận như tiểu đường, huyết áp cao và thừa cân. Thứ hai, mối liên quan với tỷ lệ tử vong có thể phản ánh mức độ nghiêm trọng của nhiễm trùng SARS-CoV-2 nhưng cũng có thể chỉ ra tình trạng bệnh nhân tiềm ẩn nặng hơn. Thứ ba, đặc biệt ở bệnh nhân da đen, không thể loại trừ biến thể APOL1 di truyền có thể đã góp phần vào cơ chế bệnh sinh của bệnh cầu thận xẹp. Cuối cùng, protein niệu và tiểu máu nên được giải thích một cách thận trọng ở những bệnh nhân bị bệnh nặng, sốt và thiểu niệu, đặc biệt khi xác định bằng que thử [26].
Tăng kali niệu
Trong một nhóm thuần tập gồm 175 bệnh nhân bị nhiễm COVID-19, hạ kali máu kèm theo tăng kali niệu, như một dấu hiệu của sự hoạt hóa hệ thống renin-angiotensin-aldosterone (RAAS), có liên quan đến các dạng nhiễm trùng SARS-CoV-2 nặng nhất cần nhập viện ICU. Thật vậy, 93% bệnh nhân nhập viện ICU bị hạ kali máu lúc nhập viện [27]. Các tác giả cho rằng tăng kali niệu liên quan đến tăng nồng độ angiotensin II. Tuy nhiên, dữ liệu với các phép đo cụ thể của tất cả các thành phần của RAAS sẽ là cần thiết để xác nhận giả thuyết này. Thật vậy, hạ kali máu có thể là thứ phát sau tiêu chảy do SARS-CoV-2, do sử dụng thuốc lợi tiểu hoặc bệnh lý cầu thận gây ra do thuốc khác.
Sự hiện diện của SARS-CoV-2 trong nước tiểu
Sự hiện diện của SARS-CoV-2 hiếm khi được tìm thấy trong mẫu tăm bông nước tiểu của bệnh nhân COVID-19 làm tăng khả năng có một ổ chứa SARS-CoV-2 ở thận (5,6,29). Tuy nhiên, liệu sự hiện diện của RNA virus trong mẫu tăm bông có ngụ ý rằng nước tiểu có khả năng lây nhiễm hay không cần được xác định bằng xét nghiệm tìm virus sống.
Phát hiện mô bệnh học trong tổn thương thận cấp tính
Diao et al. lần đầu tiên báo cáo kết quả phân tích tử thi các mô thận của 6 bệnh nhân chết vì COVID-19 [28]. Gần đây hơn, Su et al. đã phân tích tổn thương mô bệnh học thận ở 26 bệnh nhân tử vong do COVID-19 [29]. Sử dụng kính hiển vi quang học, hóa mô miễn dịch và kính hiển vi điện tử, họ đã báo cáo một số bất thường, bao gồm:
1. Các phát hiện mô bệnh học liên quan đến các tình trạng cơ bản của bệnh nhân có nguy cơ nhiễm SARS-CoV-2 nặng (tiểu đường, cao huyết áp, các bệnh tim mạch), chẳng hạn như giãn nở trung mô dạng nốt và hyaline hóa tiểu động mạch ở bệnh nhân tiểu đường, xơ cứng động mạch với cầu thận thiếu máu cục bộ ở bệnh nhân tăng huyết áp và/hoặc các bệnh tim mạch.
2. Bằng chứng về nhiễm trùng nhu mô thận trực tiếp: bằng kính hiển vi quang học, Su et al. phát hiện tổn thương ống thận gần, cấp tính, lan tỏa với không bào bào tương có thể liên quan đến nhiễm virus trực tiếp ở biểu mô ống lượn gần. Bằng kính hiển vi điện tử, các phần tử vi rút chủ yếu được xác định trong tế bào chất của biểu mô ống thận gần và trong tế bào có chân, với quá trình xóa chân thứ cấp và sự tách rời của tế bào có chân ra khỏi màng đáy cầu thận. Bằng kính hiển vi huỳnh quang gián tiếp, biểu mô ống biểu hiện nucleoprotein SARS-CoV ở 3 bệnh nhân [29]. Kissling et al. đã báo cáo một trường hợp bệnh cầu thận khu trú xẹp nghiêm trọng với trong tế bào chất podocyte, không bào chứa nhiều hạt hình cầu có hình dạng điển hình của các thể chứa virus [23]. Puelles et al. cũng phát hiện thấy tải lượng vi rút SARS-CoV-2 dương tính trong quá trình khám nghiệm thận của bệnh nhân COVID-19, với khu trú ưu tiên ở cầu thận. Điều thú vị là, nhiều tình trạng cơ bản có liên quan đến bệnh lý thận SARS-CoV-2 [30]. Do đó, những nghiên cứu này cho thấy sự xâm nhập trực tiếp của SARS-CoV-2 vào nhu mô thận.
3. Một phát hiện hình thái học phổ biến khác là sự kết tụ hồng cầu lan tỏa và tắc nghẽn trong lòng mao mạch cầu thận và mao mạch xung quanh ống thận không có tiểu cầu, mảnh hồng cầu, huyết khối fibrin hoặc hoại tử fibrinoid.
4. Thiếu máu cục bộ cầu thận và tổn thương tế bào nội mô cũng có trong một số trường hợp. Su et al. đã tìm thấy bằng chứng về thiếu máu cục bộ cầu thận ở 3 bệnh nhân có huyết khối fibrin trong vòng mao mạch cầu thận [29], có khả năng phản ánh sự hoạt hóa đông máu ở bệnh nhân COVID-19 [16].
5. Các phát hiện mô học khác bao gồm trụ myoglobin hoặc trụ mảnh tế bào. Tiêu cơ vân cũng đã được báo cáo ở bệnh nhân COVID-19 [31].
6. Mặc dù tổn thương phổi khi nhiễm SARS-CoV- 2 nghiêm trọng dường như có liên quan một phần đến sự hoạt hóa bổ thể [32], nhưng không có bằng chứng về sự hoạt hóa bổ thể ở thận [33].
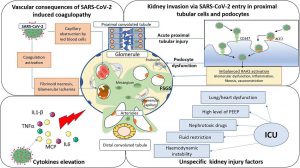
”SARS-CoV-2 có thể thâm nhập vào tế bào ống lượn gần bằng cách liên kết với ACE2 và CD147, cũng như trong tế bào có chân, bằng cách liên kết với ACE2. Sự xâm nhập của vi rút có thể gây rối loạn chức năng tế bào có chân, dẫn đến các bệnh cầu thận như xơ cứng cầu thận từng phần khu trú (FSGS), và tổn thương ống thận gần cấp tính dẫn đến hoại tử ống. SARS-CoV-2 chịu trách nhiệm kích hoạt RAAS không cân bằng, thúc đẩy rối loạn chức năng cầu thận, xơ hóa, co mạch và viêm. Nhiễm SARS-CoV-2 cũng gây kích hoạt đông máu, dẫn đến tổn thương mạch máu thận như thiếu máu cục bộ cầu thận và hoại tử fibrinoid. Sự tắc nghẽn mao mạch cầu thận bởi các tế bào hồng cầu cũng đã được báo cáo trong quá trình nhiễm SARS-CoV-2. Sự gia tăng các cytokine gây ra bởi nhiễm SARS-CoV-2 nặng cũng có thể tham gia vào nguồn gốc của AKI. Cuối cùng, các yếu tố không đặc hiệu liên quan đến việc quản lý đơn vị chăm sóc đặc biệt (ICU) có thể làm trầm trọng thêm tình trạng tổn thương thận.”
Điều quan trọng cần lưu ý là hầu hết dữ liệu mô học bắt nguồn từ phân tích sau khi khám nghiệm tử thi. Do đó, rất khó để kết luận liệu những tổn thương mô học này là hậu quả trực tiếp của virus hay do nhiễm trùng huyết và/hoặc suy đa cơ quan [34]. Thêm sinh thiết thận của bệnh nhân COVID-19 còn sống có thể giúp trả lời câu hỏi này.
Sinh lý bệnh của tổn thương thận cấp tính
Sự hiểu biết về sinh lý bệnh của AKI liên quan đến COVID-19 vẫn chưa được làm sáng tỏ. Kiến thức hiện tại cho thấy các cơ chế không đặc hiệu, nhưng cũng có nhiều cơ chế đặc hiệu hơn của COVID-19 như tổn thương virus trực tiếp thông qua thụ thể của nó (ACE2) được biểu hiện nhiều ở thận, RAAS mất cân bằng, sự gia tăng các cytokine gây viêm do nhiễm virus và huyết khối vi mạch (Hình 3).
Cơ chế không đặc hiệu
Một số yếu tố có thể góp phần làm khởi phát AKI, đặc biệt là ở người bệnh nặng [35]. Đầu tiên, hầu hết bệnh nhân COVID-19 bị AKI đều lớn tuổi và thường xuyên mắc các bệnh đi kèm như tăng huyết áp hoặc đái tháo đường (Bảng S1) [2,5,7]. Những yếu tố này là những yếu tố thúc đẩy của tình trạng tổn thương thận. Gần đây, chúng được xác định là những yếu tố góp phần vào sự phát triển của AKI ở bệnh nhân suy hô hấp cấp tính [36]. Hơn nữa, do những tình trạng này, bệnh nhân thường xuyên được điều trị bằng các loại thuốc can thiệp vào điều hòa lưu lượng máu thận, chẳng hạn như thuốc ức chế men chuyển. Điều này có thể rất quan trọng, bởi vì nhiều bệnh nhân bị sốt kéo dài, thở nhanh và các rối loạn dạ dày-ruột, có thể dẫn đến giảm thể tích tuần hoàn và sau đó là AKI trước thận [5,7]. Tuy nhiên, cho đến nay, chưa có nghiên cứu nào báo cáo số liệu cụ thể về tình trạng thể tích lúc nhập viện và chúng tôi chỉ có thể giả định vai trò của các yếu tố này trong khởi phát AKI [37]. Độc tính trên thận cũng có thể liên quan. Các thuốc cản quang được sử dụng để khảo sát các biến cố huyết khối tắc mạch (đặc biệt là thuyên tắc phổi) có thể đóng một vai trò trong khởi phát AKI. Thuốc gây độc cho thận cũng có thể bị ảnh hưởng bởi sự phát triển của AKI, đặc biệt là thuốc kháng sinh, thuốc kháng vi-rút hoặc thuốc y học cổ truyền. Tuy nhiên, những yếu tố này đã được nghiên cứu kém ở bệnh nhân COVID-19.
Thứ hai, các cơ chế khác có thể góp phần vào sự phát triển AKI ở bệnh nhân hội chứng suy hô hấp cấp tính (ARDS), là nguyên nhân hàng đầu nhập viện ở bệnh nhân nhiễm SARS-CoV-2 nặng [2,5,7]. Suy giảm trao đổi khí và giảm oxy máu nghiêm trọng đã được ghi nhận là các yếu tố liên quan đến AKI ở bệnh nhân ARDS [38]. Trong một loạt trường hợp gồm 1591 bệnh nhân nhập viện ICU trong giai đoạn đầu của đợt bùng phát ở Lombardy, Grasselli et al. báo cáo rằng tình trạng giảm oxy máu nghiêm trọng (với PaO2/FiO2 trung bình là 160 [114–220] mmHg khi nhập viện ICU) là phổ biến. Rối loạn huyết động như tăng áp lực tĩnh mạch trung tâm, tăng áp lực trong lồng ngực hoặc quá tải thể tích cũng có thể dẫn đến khởi phát hoặc trầm trọng thêm AKI [39]. Mặc dù có một mức độ bằng chứng thấp trên lâm sàng [40], một số nghiên cứu sinh lý cho thấy rằng áp lực trong lồng ngực cao và PEEP có thể ảnh hưởng đến lượng nước tiểu và độ lọc cầu thận [41,42].
Gần đây, Gattinoni et al. đã lập luận rằng, trong giai đoạn đầu của bệnh viêm phổi COVID-19, cơ học phổi có thể khác với ARDS truyền thống, với một kiểu hình (được gọi là Type-L trái ngược với Type-H với các khía cạnh cổ điển hơn) được đặc trưng bởi độ giãn nở bình thường, khả năng huy động phổi thấp và không cần PEEP rất cao hoặc thậm chí có các tác động có hại của PEEP [43]. Nói cách khác, mức PEEP cao và không thân thiện với thận có thể không cần thiết trong giai đoạn đầu của COVID-19 ARDS. Cuối cùng, tác dụng gây viêm của thở máy xâm nhập đặc biệt khi áp dụng chiến lược không bảo vệ [44] cũng có thể góp phần gây tổn thương thận [45].
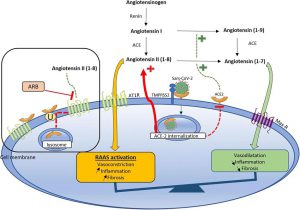
”Angiotensinogen được chuyển thành angiotensin I bởi renin và sau đó thành angiotensin II (còn được gọi là angiotensin (1–8)) bởi ACE. Angiotensin II, thông qua liên kết với AT1R, chịu trách nhiệm về các tác động có hại của quá trình hoạt hóa RAAS (tức là xơ hóa, viêm, co mạch). ACE2 chống lại tác dụng có hại của quá trình hoạt hóa RAAS bằng cách chuyển đổi angiotensin I thành angiotensin (1-9) và angiotensin II thành angiotensin 1–7 liên kết với thụ thể Mas và có tác dụng chống viêm và giãn mạch. SARS-CoV-2 liên kết với ACE2 liên kết màng và xâm nhập vào màng tế bào bằng quá trình nội bào, do đó làm giảm nồng độ ACE2 liên kết màng. Sự xâm nhập tế bào phụ thuộc vào sự biểu hiện của ACE2 và cũng như sự hiện diện của protease TMPRSS2, có khả năng phân cắt đợt vi rút. Việc giảm thiểu ACE2 dẫn đến sự tích tụ của angiotensin II là nguyên nhân gây ra hoạt động quá mức của RAAS, dẫn đến tăng viêm, xơ hóa, co mạch. ACE2 lưu hành có thể hoạt động như một mồi nhử và liên kết với SARS-CoV-2, do đó ngăn chặn sự xâm nhập của ACE2 gắn vào màng bởi SARS-CoV-2. Trong các điều kiện sinh lý, ACE2 được liên kết với AT1R, tạo thành một phức hợp ngăn cản sự thoái hóa của ACE2 liên kết màng thông qua nội hóa lysozome. Angiotensin II liên kết với AT1R và làm giảm sự tương tác giữa ACE2 và AT1R, gây ra sự phổ biến và nội tại của ACE2. ARB có thể làm tăng tính khả dụng của ACE2 liên kết màng bằng cách ngăn cản sự xâm nhập của nó. Tuy nhiên, vì vi rút yêu cầu nội chất ACE2 gắn với màng để xâm nhập vào tế bào, ARB cũng có thể làm giảm tính nhạy cảm với vi rút bằng cách ngăn chặn sự xâm nhập của vi rút-ACE2.”
Sự xâm nhập của các tế bào SARS-CoV- 2 vào thận
Enzyme chuyển đổi angiotensin 2 (ACE2) là một chất tương đồng của ACE có thể chuyển đổi angiotensin II thành angiotensin 1–7, làm giảm bớt sự co mạch liên quan đến hệ thống renin- angiotensin (Hình 4). Có 2 dạng ACE2: ACE2 hòa tan và ACE2 liên kết màng. SARS-CoV-2 liên kết với ACE2 trên màng tế bào của tế bào chủ. Sự xâm nhập vào tế bào của coronavirus phụ thuộc vào sự liên kết của các protein đột biến của virus (S) với các thụ thể của tế bào và vào mồi protein S bởi các protease của tế bào chủ. Do đó, sự xâm nhập của tế bào phụ thuộc vào sự biểu hiện của ACE2 và cũng như sự hiện diện của protease TMPRSS2 (Transmembrane protease, serine 2), có khả năng phân cắt cành virus [46]. Trong thận, ACE2 được biểu hiện ở các đường viền đỉnh của các ống lượn gần cũng như các tế bào có chân. Trong tế bào nội mô của thận, chỉ ACE được biểu hiện mà không có ACE2 có thể phát hiện được [47]. Dữ liệu giải trình tự RNA mô người gần đây đã chứng minh rằng biểu hiện của ACE2 ở thận cao hơn gần 100 lần so với ở mô phổi [20]. TMPRSS2 cũng đã được phát hiện ở thận [48] và cụ thể hơn là ở các ống lượn gần [49]. Gần đây hơn, Wang et al. phát hiện ra rằng SARS-CoV-2 đã xâm nhập vào tế bào vật chủ thông qua một con đường mới của protein đột biến CD147 [50]. CD147 là glycoprotein xuyên màng được biểu hiện phổ biến và được biểu hiện nhiều trên các tế bào biểu mô ống lượn gần và các tế bào viêm và có liên quan đến các bệnh thận khác nhau [51].
Kích hoạt RAAS không cân bằng
Đầu tiên, SARS-CoV-2 gắn vào ACE2 và gây ra sự điều hòa giảm của ACE2 gắn vào màng, thúc đẩy sự tích tụ angiotensin II bằng cách giảm sự thoái hóa của nó thành angiotensin 1-7. Do đó, sự tích tụ angiotensin II qua trung gian COVID-19 có thể thúc đẩy sự hoạt hóa RAAS mất cân bằng, dẫn đến viêm, xơ hóa, co mạch [52] (Hình 4).
Thứ hai, ACE2 thường tương tác với thụ thể AT1, tạo thành một phức hợp ngăn cản quá trình nội hóa và thoái hóa ACE2 liên kết màng thành lysosome. Sự tích lũy angiotensin II làm giảm sự tương tác này và gây ra sự phổ biến và nội tại của ACE2 liên kết màng vào các lysosome [53] (Hình 4).
Vai trò của chất ức chế RAAS
Do sự hoạt hóa RAAS và sự tương tác giữa SARS- CoV-2 và ACE2, một số tác giả đã đề xuất các chất ức chế RAAS như là phương pháp điều trị tiềm năng cho nhiễm COVID-19 [54]. Ngược lại, các nghiên cứu khác cho rằng các chất ức chế ACE và ARB (angiotensin receptor blocker) có thể làm tăng biểu hiện ACE2 và do đó làm tăng tính nhạy cảm của bệnh nhân với nhiễm SARS-CoV-2 [55,56]. Tuy nhiên, ACE2 liên kết màng và lưu hành có thể có tác dụng đối kháng với sự xâm nhập của COVID-19. ACE2 đang lưu hành có thể hoạt động như một mồi nhử bằng cách ngăn chặn sự xâm nhập của SARS-CoV-2 vào các tế bào đích phụ thuộc vào thụ thể ACE2 gắn trên màng của nó. Điều này có nghĩa là bên cạnh cân bằng ACE/ACE2, cân bằng ACE2 hòa tan/ACE2 liên kết màng cũng quan trọng không kém. Sau đó, vai trò của các chất ức chế RAAS cần được xem xét dựa trên khả năng phá vỡ cả hai trạng thái cân bằng này [52]. Hai nghiên cứu hồi cứu gần đây đã gợi ý rằng chất ức chế RAAS có thể bảo vệ ở bệnh nhân COVID-19 [57,58]. Trong nghiên cứu hồi cứu đầu tiên bao gồm 1128 bệnh nhân tăng huyết áp, các tác giả đã quan sát thấy giảm nguy cơ tử vong do mọi nguyên nhân ở bệnh nhân dùng thuốc ức chế men chuyển/ARB [57]. Trong nghiên cứu thứ hai, một nhóm thuần tập hồi cứu nhỏ, sử dụng chất ức chế RAAS có liên quan đến xu hướng giảm tỷ lệ bệnh nhân nguy kịch và tỷ lệ tử vong thấp hơn [58].
Các nghiên cứu lâm sàng gần đây cho thấy sự thiếu liên quan giữa chất ức chế RAAS và nguy cơ mắc COVID-19 hoặc tử vong [59,60,61]. Cho đến nay, các hiệp hội tim mạch đã khuyến cáo không nên thêm hoặc ngừng các chất ức chế RAAS.
Vai trò của cytokine trong AKI liên quan đến COVID
Có nhiều bằng chứng cho thấy những bệnh nhân COVID-19 nặng có nồng độ cytokine gây viêm tăng cao, đặc biệt là khi họ được đưa vào ICU. Hoàng et al. cho thấy interleukin-1β (IL-1β), IL- 1RA, IL-7, IL-8, IL-9, IL-10, yếu tố tăng trưởng nguyên bào sợi (FGF, fbroblast growth factor), yếu tố kích thích đại thực bào bạch cầu hạt (GM- CSF, granulocyte macrophage colony stimulating factor), interferon-γ (IFNγ), yếu tố kích thích bạch cầu hạt (G-CSF, granulocyte colony stimulating factor), protein cảm ứng interferon- γ (IP10), protein hóa ứng động monocyte (MCP1, monocyte chemoattractant protein), protein gây viêm đại thực bào 1 alpha (MIP1A, macrophage infammatory protein 1 alpha), yếu tố tăng trưởng có nguồn gốc từ tiểu cầu (PDGF, platelet- derived growth factor), yếu tố hoại tử khối u (TNFα, tumor necrosis factor), yếu tố tăng trưởng nội mô mạch máu (VEGF, vascular endothelial growth factor) đều tăng lên, trong đó IL-2, IL-7, IL-10, G-CSF, IP10, MCP1, MIP1A, TNFα cao hơn ở những bệnh nhân nặng [7]. Các cytokine này có thể tham gia vào AKI ở bệnh nhân COVID-19, bằng cách tương tác với các tế bào cư trú ở thận và gây rối loạn chức năng nội mô và ống. Ví dụ, TNF-α có thể liên kết trực tiếp với các thụ thể của tế bào hình ống, kích hoạt con đường chết của thụ thể trong quá trình apoptosis [62]. Các nghiên cứu khác cũng phát hiện ra sự gia tăng IL-6 ở những bệnh nhân bị bệnh nặng do COVID-19 với mức IL-6 tăng lên ở nhóm bệnh nhân COVID-19 không sống sót khi so sánh với những bệnh nhân sống sót [16]. Vai trò có hại của IL-6 đã được chứng minh trong các mô hình khác nhau của AKI, bao gồm AKI do thiếu máu cục bộ, AKI do nephrotoxin và AKI do nhiễm trùng huyết [63, 64]. Trong mô hình AKI do nephrotoxin gây ra, chuột TNFα -/- và chuột IL-6 -/- cho thấy khả năng kháng AKI tương đối [64]. IL-6 cũng gây tăng tính thấm thành mạch thận, sự bài tiết cytokine/chemokine tiền viêm bởi tế bào nội mô thận (IL-6, IL-8 và MCP-1), và có thể tham gia vào rối loạn chức năng vi tuần hoàn [65]. Do đó, chúng ta có thể giả định rằng các cytokine này có thể tham gia vào AKI ở bệnh nhân COVID-19. Tuy nhiên, sự gia tăng các cytokine là vừa phải (IL-6 trung bình là 79 pg/ml (39–135 pg/ml) trong nhóm ICU của chúng tôi (dữ liệu chưa được công bố)) khi so sánh với ARDS tăng viêm (IL-6 trung bình là 1568 pg/mL; 517-3205 pg/mL) [66], nhiễm trùng huyết (IL-6 trung bình là 1346 pg/mL; 292-8789 pg/mL) [67] hoặc hội chứng giải phóng cytokine trong đó interleukin-6 trung bình có thể đạt tới 10000 pg/mL [68]. Hơn nữa, liệu sự gia tăng cytokine ở bệnh nhân COVID-19 có chuyển thành tác dụng có lợi của các chiến lược điều hòa miễn dịch hay không vẫn chưa được biết.
Vai trò của huyết khối trong AKI liên quan đến COVID
Tỷ lệ cao các biến cố huyết khối cấp tính ở bệnh nhân COVID-19 đã được một số tác giả báo cáo, chủ yếu là huyết khối tĩnh mạch và thuyên tắc phổi [69,70]. Helms et al. phát hiện ra rằng 16,7% bệnh nhân nặng nhập viện do nhiễm SARS-CoV-2 bị thuyên tắc phổi. Điều thú vị là bệnh nhân ARDS COVID-19 có nhiều biến chứng huyết khối hơn bệnh nhân ARDS không COVID- 19 [70]. Ở thận, sự hiện diện của lắng đọng fibrin trong các quai cầu thận [29] có lợi cho sự rối loạn điều hòa cân bằng nội môi đông máu có thể gây rối loạn chức năng vi tuần hoàn thận và AKI. Trong một nghiên cứu hồi cứu, Tang et al. đã chứng minh rằng việc sử dụng liệu pháp chống đông máu dự phòng có liên quan đến việc giảm tỷ lệ tử vong ở bệnh nhân COVID-19 [71]. Tuy nhiên, không có dữ liệu nào về tác động của liệu pháp chống đông máu đối với kết cục thận. Tỷ lệ thuyên tắc phổi cao trong thời gian nhiễm SARS- CoV-2 và suy tim phải sau đó cũng có thể góp phần gây ra tắc nghẽn tĩnh mạch và phát triển AKI [72].
Điều trị AKI do COVID-19 gây ra
Cho đến nay, không có phương pháp điều trị cụ thể cho AKI do COVID-19 gây ra. Một số tác nhân điều tra đang được khám phá để điều trị COVID- 19 [73]. Tuy nhiên, không có dữ liệu được kiểm soát nào hỗ trợ việc sử dụng bất kỳ phương pháp điều trị cụ thể nào (thuốc kháng vi-rút hoặc thuốc điều hòa miễn dịch) và hiệu quả của chúng đối với COVID-19 vẫn chưa được biết. Liên quan đến RRT, không có dữ liệu nào hỗ trợ việc sử dụng các chiến lược khác với các chiến lược được sử dụng trong bối cảnh nhiễm trùng huyết. Do đó, thời gian của RRT, phương thức (ngắt quãng so với liên tục) và liều lượng có thể dựa trên dữ liệu không phải COVID-19 [74]. Đáng chú ý, Helms et al. tìm thấy một tỷ lệ cao của đông máu màng lọc (hemofilter) trong RRT (đặc biệt là trong quá trình lọc máu tĩnh mạch – tĩnh mạch liên tục, lên đến 96,6% đông máu màng lọc) [70]. Nếu có thể, nên ưu tiên dùng kháng đông vùng citrat (ngoài kháng đông toàn thân). Nếu không, cần đặc biệt chú ý để dùng heparin chống đông hiệu quả.
Cho đến nay, không có bằng chứng về việc loại bỏ cytokine quan trọng về mặt lâm sàng bằng RRT trong AKI do nhiễm trùng huyết và không có sẵn dữ liệu trong bối cảnh COVID-19 [75].
Trong trường hợp tiểu đạm dai dẳng hoặc tiểu máu khi xuất viện ICU, bệnh nhân COVID-19 có thể được theo dõi bởi bác sĩ chuyên khoa thận.
Kết luận
AKI phổ biến ở bệnh nhân COVID-19 bị bệnh nặng. Tổn thương thận có liên quan đến kết cục kém. Một số cơ chế có thể liên quan đến tổn thương thận trong quá trình nhiễm SARS-CoV-2, bao gồm sự xâm nhập trực tiếp của SARS-CoV-2 vào nhu mô thận, RAAS mất cân bằng và vi huyết khối, mà còn có tổn thương thận thứ phát do huyết động không ổn định, các cytokine gây viêm và hậu quả của phương pháp điều trị được sử dụng trong ICU (thuốc độc với thận, thở máy). Phát hiện sớm và điều trị cụ thể những thay đổi ở thận, bao gồm hỗ trợ huyết động đầy đủ và tránh dùng thuốc độc với thận, có thể giúp cải thiện những bệnh nhân bị bệnh nặng do COVID- 19.