Bài viết Tổn thương phổi cấp tính: làm thế nào để ổn định một phổi bị vỡ được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: Acute lung injury: how to stabilize a broken lung
Tóm lược
Sinh lý bệnh của hội chứng suy hô hấp cấp (ARDS) dẫn đến phổi không đồng nhất bị xẹp, đường hô hấp bị phù – tràn ngập và phế nang không ổn định. Những thay đổi bệnh lý trong cơ học phế nang (tức là thay đổi động trong kích thước và hình dạng phế nang với mỗi nhịp thở) đưa phổi đến tổn thương phổi do máy thở (VILI) thứ phát. Quan điểm của chúng tôi là phổi bị tổn thương cấp tính có thể được huy động và ổn định bằng nhịp thở cơ học cho đến khi nó lành lại, giống như đúc một xương bị gãy cho đến khi nó được lành lại. Nếu phổi có thể được “bó bột” với một nhịp thở cơ học, VILI có thể được ngăn chặn và tỷ lệ ARDS giảm đáng kể.
Một bệnh nhân đến phòng cấp cứu sau khi té cây và chụp x-quang xác nhận gãy xương quay và xương trụ. Bác sĩ chỉnh hình nắn xương bị gãy và bó bột. Một x-quang tiếp theo cho thấy các xương bị gãy đã ở vị trí giải phẫu thích hợp. Mặc dù vậy, bó bột là cần thiết để ổn định gãy xương, vì xương vẫn không ổn định cho đến khi xương lành và lấy lại sự ổn định độc lập. Chỉ sau khi việc lành xương diễn ra (vài tuần) thì băng bột mới được cắt bỏ đi; nếu không xương sẽ tái gãy xương, làm trầm trọng thêm chấn thương ban đầu và gây tổn thương mô thêm.
Sự tương tự này minh họa khả năng hội chứng suy hô hấp cấp (ARDS), dẫn đến sự xẹp và mở phế nang lặp đi lặp lại (RACE, repetitive alveolar collapse and expansion) [1], sẽ dẫn đến tổn thương mô tiến triển được gọi là tổn thương phổi do máy thở (VILI), trừ khi thông khí cơ học “bó bột”có thể được áp dụng để ổn định các phế nang này, giống như ngăn ngừa tổn thương mô từ một xương bị gãy không ổn định. Tất nhiên duy trì một phổi mở và ổn định bằng cách sử dụng thông khí cơ học là một vấn đề khó khăn hơn nhiều so với bó bột cánh tay bị gãy. Phế nang vốn không ổn định nhưng có sự tương tác tinh tế với chức năng của surfactant kết hợp với sự hỗ trợ cơ học của kết nối vi giải phẫu phế nang và nitơ không khuếch tán, kết quả phụ thuộc lẫn nhau về cấu trúc, và duy trì một phổi mở và ổn định với dung tích cặn chức năng (FRC) bình thường [2].
Tuy nhiên, dung tích đóng của phổi bị thay đổi trong quá trình ARDS thứ phát để làm mất sự ổn định của phổi. Phù phổi [3] và thông khí (tự phát và cơ học) [4] có thể làm bất hoạt chức năng surfactant của phổi. Sau khi phát triển, phù nề và rối loạn chức năng surfactant sẽ cần thời gian để hồi phục và ổn định phế nang được tái lập. Sự tồn tại của phù, rối loạn chức năng surfactant, và RACE không thể được xác định bằng khí máu [5]. Trong ARDS, phổi phụ thuộc vào áp lực (tức là sẽ xẹp ở áp lực khí quyển) và cả thời gian hồi phục và môi trường thuận lợi để lấy lại sự ổn định phổi cần thiết trước khi áp lực ổn định (bó bột) phổi có thể ngưng.
Điều này được minh chứng trong các thử nghiệm lâm sàng, thử nghiệm hiệu quả của các chiến lược thông khí mở, nơi oxy hóa bình thường được cân bằng với sự ổn định của phế nang, gây ra sự giảm áp lực đường thở hoặc thay đổi chế độ thông khí, xảy ra trong các thử nghiệm thở tần số cao (HFOV), hoặc khi sử dụng tương quan áp lực dương cuối kỳ thở ra (PEEP)/FiO2, và chiến lược thể tích khí lưu thông (Vt) thấp [6,7]. Cũng cần hiểu rằng thời gian thích hợp phải đưa ra để cho xương bị gãy được chữa lành trước khi loại bỏ băng bột; tuy nhiên, khái niệm rõ ràng này thường bị bỏ qua khi quản lý “phổi bị vỡ”. Thường xuyên là sau khi huy động phổi bị tổn thương cấp tính, có một lực làm giảm áp lực đường thở ngay khi tăng oxy hóa máu và phổi “bó bột” trở nên “không ổn định” một lần nữa với tổn thương VILI gây ra cho mô tái diễn.
Mục đích của bài viết này là xem xét khái niệm “bó bột” một lá phổi bị vỡ. Chấn thương phổi cấp tính gây ra sự mất ổn định phổi khiến phổi không ổn định, giống như một xương bị gãy. Chúng tôi đưa ra giả thuyết rằng có thể áp dụng nhịp thở cơ học thích ứng ở những bệnh nhân ARDS để có thể ổn định phổi cho đến khi nó lành và ngăn ngừa VILI thứ phát. Tốt hơn, chúng ta có thể ổn định phổi trước khi nó “vỡ”, với nhịp thở cơ học bảo vệ ngay khi bệnh nhân được đặt nội khí quản và ngăn ngừa sự bất ổn định của phổi sớm và sự phát triển ARDS hoàn toàn?
Phổi nghỉ ngơi thật sự và nhu cầu thiết lập và duy trì sự ổn định
Giả thuyết rằng ARDS gây ra tổn thương phổi không đồng nhất với cả hai stress-risers (tức là phế nang xẹp hoặc phù trực tiếp liền kề với phế nang còn thông khí) và phế nang mất ổn định [8] thứ phát đưa đến bất hoạt surfactant [4]. Tổn thương không đồng nhất này gây ra quá trình biến dạng (strain) phế nang quá mức trong quá trình thông khí khí lưu thông dẫn đến một VILI thứ phát, có thể dẫn đến việc đưa bệnh nhân ARDS vào oxy hóa qua màng tế bào (ECMO). Một khi vào ECMO, bác sĩ lâm sàng có thể quyết định bắt đầu “phổi nghỉ ngơi”, một khái niệm [9,10] gần tương tự như khi bó bột cho phổi cho đến khi nó lành lại.
Tuy nhiên, vấn đề với phương pháp này là bệnh lý phổi có thể xảy ra do sự xẹp phổi đơn thuần [4,11,12] và phổi cuối cùng cũng sẽ phải mở trở lại để bệnh nhân có thể cai máy ECMO. Vì vậy, sự nghỉ ngơi của phổi bị tổn thương cấp tính trong trạng thái bị xẹp sẽ giống như bó bột một cánh tay bị gãy mà không sắp xếp đúng vị trí xương gãy trước. Ngoài ra, sự xẹp mãn tính có thể dẫn đến sự mất ổn định không thể đảo ngược, tạo thành xơ hóa phế nang [13-15]. Phổi được thiết kế để hoạt động tối ưu chỉ khi hoàn toàn thổi phồng và do đó lý tưởng nhất là bó bột lúc phổi mở và để cho nó chữa lành ở thể tích tự nhiên sinh học của nó. Nếu phổi mở có thể được “nghỉ ngơi” bằng cách sử dụng giao thức thông khí thích ứng được điều khiển theo thời gian (TCAV, time-controlled adaptive ventilation), chúng ta sẽ có được cả hai thế giới tốt nhất; VILI sẽ được loại bỏ và tất cả các phân nhánh tiêu cực của ECMO sẽ tránh được.
Sinh lý bệnh của ARDS
Có một “tứ chứng” của bệnh lý liên quan đến ARDS: (1) tăng tính thấm mao mạch phổi; (2) bất hoạt surfactant; (3) ngập lụt phế nang với phù nề; và (4) thay đổi cơ học phế nang với sự thay đổi động trong kích thước và hình dạng phế nang với từng nhịp thở (Hình 1) [16].
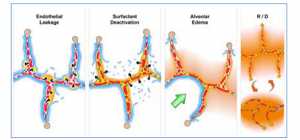
“Sơ đồ mô tả nhiều vách phế nang chứa mao mạch phổi (vòng tròn màu đỏ), các vách phế nang được lót bằng một lớp chất lỏng hypophase (lớp màu xanh bên trong mỗi phế nang), với surfactant phổi tạo thành một đơn lớp hoàn chỉnh trên hypophase. Chấn thương nặng, sốc xuất huyết, hoặc nhiễm trùng huyết có thể gây ra hội chứng đáp ứng viêm toàn thân (SIRS) làm tăng khả năng thẩm thấu của mạch máu phổi – (Endothelial Leakage – Rò rỉ nội mô). Tăng tính thấm vi mạch cho phép phù phổi di chuyển vào phế nang, ban đầu là các cục máu (tăng tính thấm – mũi tên và phù nề – màu xậm) [70]. (Surfactant Deactivation – Bất hoạt surfactant) Các phân tử surfactant vẫn còn trong một lớp liên tục ban đầu khi dạng phù nề tạo ra nhưng các bong bóng mở rộng làm lớp đơn bị gián đoạn dẫn đến việc bất hoạt surfactant. (Alveolar Edema – Phù phế nang) Một sự kết hợp của phù nề sử dụng surfactant từ hypophase, các protein trong dịch phù làm bất hoạt surfactant [71], và thông khí cơ học không đúng cách gây gián đoạn bề mặt, dẫn đến sự bất hoạt của surfactant (Surfactant Deactivation). Mất lớp đơn này làm tăng sức căng bề mặt phế nang khiến cho phế nang trở nên không ổn định và xẹp khi thở ra (Huy động/mất huy động – R/D). Ngoài ra, sức căng bề mặt cao đã được chứng minh là làm tăng ngập dịch phù vào phế nang gây ra một chu kỳ phù nề dịch → bất hoạt surfactant → sức căng bề mặt phế nang cao → phù nề nhiều hơn [72]. Nếu chu kỳ này không bị chặn thì dịch phù phế nang sẽ làm ngập toàn bộ phế nang (màu nâu) ngăn ngừa trao đổi khí, dẫn đến thiếu oxy và ứ CO2. Một dấu hiệu của sinh bệnh học ARDS là tổn thương không đồng nhất với phù nề (màu xậm) liền kề với phế nang đầy khí với chức năng surfactant bình thường (Alveolar Edema). Phù bên cạnh phế nang chứa đầy khí tạo ra stress-riser làm cho vách phế nang uốn cong về phía chất lỏng chứa đầy phế nang, có thể gây ra stress-failure ở vách phế nang [32]. (Green Arrow-Alveolar Edema) Stress-risers là một cơ chế quan trọng của tổn thương phổi do máy thở (VILI) [30-33]. Mất chức năng surfactant khiến cho phế nang không ổn định, và nó huy động/mất huy động (R/D) với mỗi nhịp thở. Các phế nang trong khung trên cùng của R/D được thổi phồng hoàn toàn nhưng xẹp trong thời gian thở ra trong khung R/D dưới cùng. R/D phế nang là một cơ chế quan trọng khác của VILI và được gọi là atelectrauma [38] ”
Tác động kết hợp của bệnh lý này là giảm FRC, với sự xẹp và bất ổn của phổi không đồng nhất, với thể tích đóng lớn hơn FRC, gây ra mở và đóng có chu kỳ vùng phổi thông khí [17]. Mặc dù sinh lý bệnh của VILI phức tạp [18-21], một phần là do sự phức tạp của vi phẫu phế nang, chúng tôi đưa ra thông báo rằng phổi không ổn định ở thể tích phổi thấp là cơ chế cốt lõi của tổn thương mô do VILI gây ra. Ngoài ra, việc tăng thể tích khí lưu thông mà không ổn định FRC, sẽ dẫn đến số lượng lớn hơn các đơn vị phổi trước đây được bảo vệ khỏi sự thông khí cơ học nhờ sự xẹp phổi cho phép (permissive atelectasis), giờ đây lại tham gia vào tổn thương mô do huy động/mất huy động (R/D, recruitment-derecruitment) gây ra VILI [10].
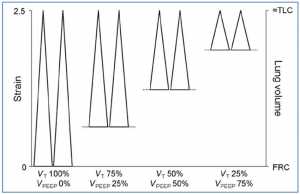
Bốn nhóm động vật đã được nghiên cứu và trong tất cả bốn nhóm phổi được thông khí với một strain tĩnh rất cao (2.5) so với dung tích phổi toàn phần (TLC, total lung capacity). Strain động cao là do thể tích khí lưu thông (VT) là 100% thể tích phổi và không có áp lực dương cuối kỳ thở ra (VPEEP). Do đó có một sự thay đổi lớn về thể tích phổi (tức là strain động cao) với mỗi nhịp thở. Ở nhóm strain động thấp nhất, VT chiếm 25% thể tích phổi và VPEEP chiếm 75% thể tích phổi. Vì vậy, sẽ có một sự thay đổi rất nhỏ về thể tích phổi (tức là strain động) với mỗi nhịp thở. Trong nhóm strain động cao, tất cả các loài động vật phát triển phù phổi và chết trước khi kết thúc nghiên cứu. Ngược lại, không có động vật ở nhóm strain động thấp nào phát triển phù nề và tất cả đều sống cho đến khi kết thúc thí nghiệm [22]. Nghiên cứu này cho thấy rằng strain tĩnh cao không làm hỏng mô phổi bình thường như trước đây giả thuyết [34] mà đúng hơn là phải được kết hợp với một strain động cao gây VILI. Những dữ liệu này được hỗ trợ trong mô hình tổn thương phổi không đồng nhất (Hình 3), trong đó strain tĩnh cao không gây tổn hại phổi, trong khi đó, strain động cao đã làm tổn thương mô bình thường và làm tổn thương trầm trọng hơn ở mô bị tổn thương nặng [23]
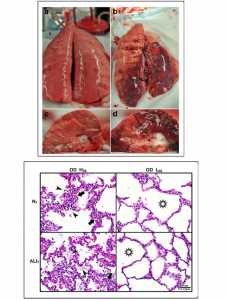
Tổn thương không đồng nhất đã được gây ra cho các khu vực rất cụ thể của mô phổi bằng cách nhỏ giọt của Tween-20 thông qua nội soi phế quản vào phần phụ thuộc của thùy cơ hoành (diaphragmatic lobe) trong thực nghiệm trên lợn ở vị trí nằm ngửa. Các mô phổi còn lại không tiếp xúc với Tween-20 là bình thường. Trên 20 động vật bị tổn thương được chia thành hai nhóm: hoặc là strain động cao (HDS, high dynamic strain) gây ra bởi thời gian thở ra kéo dài hoặc strain động thấp (LDS, low dynamic strain) với thời gian thở rất ngắn. Cả hai nhóm đều bị phơi nhiễm quá mức (áp lực đường thở cao nguyên 40 cmH2O). Hiện tại người ta tin rằng áp lực đường thở cao nguyên cao (≥ 30 cmH2O) gây ra tổn thương phổi do máy thở (VILI) trong phổi ARDS không đồng nhất bằng cách làm quá căng phổi (OD, overdistention)) ở phần mô bình thường còn lại (tức là phổi em bé) [34]. Mục tiêu của nghiên cứu là xác định liệu OD có gây VILI trong phổi em bé hay không, hoặc là OD làm trầm trọng thêm tổn thương mô trong mô phổi bị tổn thương do Tween-20, và strain động đóng vai trò làm tổn thương và/hoặc bảo vệ mô phổi. Hình ảnh toàn bộ phổi: hình trên cùng (a-d) cho thấy toàn bộ phổi và bề mặt phổi bị cắt khi bị hoại tử. Trong nhóm OD + LDS (hình trên a, c) phổi bị ngăn không cho xẹp khi thở ra bằng cách sử dụng thời gian thở rất ngắn. Trong nhóm OD + HDS (hình trên b, d) phổi được phép xẹp trong thời gian thở ra bằng cách kéo dài thời gian thở ra. Nghiên cứu này chứng minh rằng OD không gây thương tích cho mô phổi bình thường, cũng không làm trầm trọng thêm thương tích trong mô bị thương với Tween-20 (hình trên a, c), miễn là strain động là tối thiểu. Phổi được thổi phồng đồng đều (hình trên a) và bề mặt phổi bị cắt xuất hiện cũng được thổi phồng tốt mà không có phù nề gian thùy (hình trên c). OD kết hợp với HDS (hình trên b, d) gây tổn thương trầm trọng hơn ở mô Tween-20 bị thương và trực tiếp làm tổn thương phổi em bé. Các phổi cho thấy xẹp phổi rõ rệt, lan rộng vào các thùy bình thường không được tiếp xúc với Tween 20 (hình trên b). Các bề mặt cắt cho thấy xẹp phổi rộng, phù nề nội mạc (chất giống như thạch giữa các thùy), và nước trong đường thở đáng kể và bọt phù nề trong đường thở (hình trên d). Nghiên cứu này chứng minh rằng OD + HDS làm trầm trọng thêm chấn thương cho mô bị hư hỏng bởi Tween-20 và gây ra thương tích VILI trực tiếp cho mô bình thường không tiếp xúc với Tween-20, trong khi OD + LDS không gây tổn thương phổi em bé và không làm trầm trọng thêm thương tích gây ra do Tween-20 ở mô bị tổn thương. Mô học phổi: Bảng dưới cho thấy nhuộm mô học đại diện trong cả mô bình thường (NT) và mô phổi bị tổn thương do Tween-20 (ALIT) ở cả nhóm OD + HDS và OD + LDS. OD + HDS gây thương tích nghiêm trọng cho NT và chấn thương trầm trọng hơn trong các mô ALIT. Các mũi tên biểu thị sự xâm nhập của các tế bào bạch cầu viêm và đầu mũi tên xác định sự hiện diện của cặn lắng fibrin trong khoang khí (tức là phù phổi). Bệnh lý này không được nhìn thấy trong nhóm OD + LDS và hình ngôi sao cho thấy sự thông khí của phế nang được cải thiện so với nhóm OD + HDS. Nghiên cứu này cho thấy rằng một mình OD không gây tổn thương phổi em bé trừ khi kết hợp với strain động cao [23]
Các nghiên cứu đã chỉ ra rằng áp lực đường thở cao với mức độ được biết là gây VILI tương đối lành tính nếu thể tích phổi không được phép giảm đáng kể dưới FRC [22-24]. Phần lớn các nghiên cứu này sử dụng áp lực dương cuối kỳ thở ra (PEEP) để ngăn ngừa sự xẹp phổi trong thời gian thở ra. Duy trì đầy đủ FRC cũng đã được chứng minh là bảo vệ trong phổi bình thường. Lợn được thông khí cơ học trong 54 giờ với dung tích phổi toàn phần (TLC) với strain rất cao (strain toàn phần = 2,5, gần TLC) không phát triển ARDS miễn là PEEP đủ để ngăn ngừa sự xẹp phổi khi thở ra. Lợn với phổi bình thường thông khí ở cùng một strain cao (2,5) nhưng không có PEEP, cho phép phổi xẹp khi thở ra, phát triển ARDS nặng với tỷ lệ tử vong cao (Hình 2) [22]. Áp lực đẩy thông khí cao (DP, driving pressure) ở người, được đo bằng cách chia độ giãn nở phổi (Cstat) với thể tích khí lưu thông (Vt) (DP = Vt/Cstat), tương quan với sự gia tăng tỷ lệ tử vong ARDS [25]. Giảm Vt có thể làm giảm DP, nhưng điều đó sẽ dẫn đến sự xẹp phổi không đồng nhất hơn nữa. Các giải pháp khác sẽ là tăng độ giãn nở phổi, có thể được thực hiện bằng cách huy động phổi. Trong một mô hình chấn thương phổi lợn không đồng nhất, Jain et al. cho thấy áp lực khí cao điểm 40 cmH2O không làm tổn thương mô phổi bình thường hoặc làm tăng thêm tổn thương cho mô bị tổn thương cấp tính, miễn là thể tích phổi được duy trì trong khi thở ra (Hình 3) [23]. Vì vậy, miễn là phổi bình thường hoặc không đồng nhất bị thương không được phép xẹp khi thở ra, VILI sẽ được ngăn chặn, ngay cả với áp lực đường thở và strain tĩnh rất cao.
Sinh lý bệnh VILI
Các phổi được bơm phồng đúng có khả năng chống lại VILI do tính toàn vẹn cấu trúc của nhu mô phổi được gọi là “phụ thuộc lẫn nhau phế nang” (Hình 4) [26,27].
![Hình 4: Cấu trúc liên kết phức tạp của một túi phế nang [73]. Phế nang không phải là cấu trúc cá nhân tương tự như một chùm nho nhưng chia sẻ các bức tường với phế nang liền kề. Toàn bộ cấu trúc bị ràng buộc cùng với một hệ thống mô liên kết trục, vách ngăn và ngoại vi phức tạp. Miễn là tất cả phế nang đều đồng nhất thổi phồng cấu trúc phức tạp này có rất nhiều sự ổn định thông qua sự phụ thuộc lẫn nhau [26]](https://www.healcentral.org/wp-content/uploads/2020/12/ton_thuong_phoi_cap_tinh_lam_the_nao_de_on_dinh_mot_phoi_bi_vo_4-300x265.jpg)
![Hình 5: Sự phụ thuộc lẫn nhau của "phế nang" với các vách phế nang dùng chung được đại diện bởi các hình lục giác lúc hít vào và thở ra. Ở trung tâm của “mô phế nang” có một nhóm không đồng nhất (H) bị xẹp phế nang gây ra stress-riser. Kể từ khi phế nang chia sẻ các bức tường, các phế nang mở kết nối với phế nang bị xẹp phải chịu một sự tập trung của lực áp dụng cho mô phổi bởi thể tích khí lưu thông. Lưu ý rằng sự căng phế nang quá mức và biến dạng là quan trọng nhất ở các phế nang xung quanh H trong khi thở ra (dấu hoa thị). Stress-risers là một cơ chế quan trọng của tổn thương phổi do máy thở gây ra [8]](https://www.healcentral.org/wp-content/uploads/2020/12/ton_thuong_phoi_cap_tinh_lam_the_nao_de_on_dinh_mot_phoi_bi_vo_9-300x119.jpg)
Chúng tôi tạo ra vấn đề
Tiêu chuẩn chăm sóc hiện tại là áp dụng chiến lược thông khí bảo vệ, chẳng hạn như thông khí thể tích khí lưu thông thấp (LVt), sau khi ARDS có ý nghĩa phát triển [34]. Tiến triển ARDS thường im lặng với khí máu bình thường trong khi ARDS với phế nang không ổn định [35] làm cho các bác sĩ lâm sàng hàng đầu tin rằng phổi là “tốt” và không cần phải thay đổi để thông khí cơ học bảo vệ. Khi áp dụng giao thức LVt, oxy được duy trì giữa PaO2 55-80 mmHg hoặc độ bão hòa oxy là 88–95%, bằng cách sử dụng thang trượt FiO2/PEEP [34]. Tuy nhiên, vào thời điểm này, bệnh lý phổi đã hiện diện, đã có mô và tổn thương bề mặt đáng kể dẫn đến sự sụt giảm đáng kể thể tích phổi, ảnh hưởng đến phổi gây ra VILI [36]. Chuyển sang giao thức LVt góp phần làm giảm thể tích phổi và PEEP, được sử dụng kết hợp với giao thức LVt, có thể không hiệu quả trong việc ổn định phế nang như một phương pháp huy động phổi [37,38]. Với tỷ lệ tử vong ARDS vẫn không được chấp nhận cao và về cơ bản không thay đổi trong 18 năm qua ngay cả khi sử dụng giao thức LVt, các chiến lược thông khí mới đang được tìm kiếm [39-41].
Làm cách nào để ngăn ngừa phổi “vỡ”
Giải pháp cho vấn đề dường như đơn giản; tất cả những gì chúng ta cần làm là bó bột phổi có nguy cơ phát triển ARDS để giữ cho nó mở và ổn định trong trường hợp chấn thương phổi sắp xảy ra. Tuy nhiên, khi ARDS tiến triển, khả năng thẩm thấu của mạch máu sẽ tăng lên và dịch phù nề xâm nhập vào phế nang sẽ bắt đầu bất hoạt surfactant khiến phổi ngày càng không ổn định (Hình 1). Vì vậy, bó bột phải được điều chỉnh như sự thay đổi sinh lý bệnh phổi hoặc giảm bớt, để duy trì thông khí đồng nhất. Do đó, các bác sĩ phải hiểu cách áp dụng “liều” thích hợp của nhịp thở cơ học ưu tiên.
Công trình gần đây cho thấy rằng strain phế nang là độ đan hồi nhớt (visco-elastic) trong tự nhiên [42,43]. Điều quan trọng cần hiểu về cấu trúc visco-elastic như phế nang, là khi áp lực (tức là Vt) có cả thành phần nhanh và chậm để dành cho phế nang mở hoặc xẹp. Do đó, một số phế nang có thể huy động trong mili giây đầu tiên (thành phần nhanh) của hít vào nhưng nếu thời gian hô hấp được kéo dài nhiều phế nang sẽ tiếp tục huy động (thành phần chậm). Ngược lại, với việc loại bỏ lực (tức là thở ra), một số phế nang sẽ bắt đầu xẹp ngay lập tức trong vài mili giây (thành phần nhanh) nhưng nếu thời gian thở rất ngắn, nhiều phế nang sẽ không có thời gian xẹp (thành phần chậm) [8].
Với kiến thức này, cách tối ưu để bó bột một lá phổi bị vỡ sẽ là một thời gian hít vào dài và thời gian thở ra ngắn. Thời gian hít vào dài trong giao thức bó bột phổi này sẽ là áp lực đường thở dương liên tục (CPAP). CPAP với một van xả mở cho phép bệnh nhân tự thở trên mức CPAP với ít nỗ lực, tối đa hóa đồng bộ. Một thời gian thở ra rất ngắn từ CPAP (<0.5 s), sẽ không đủ thời gian để phổi hoàn toàn trống rỗng.
Time-controlled adaptive ventilation (TCAV) protocol
Chúng tôi đã phát triển một chiến lược thông khí ưu tiên để bó bột phổi duy trì hệ thống thông khí đồng nhất bằng cách sử dụng một thời gian dài trong hít vào và một thời gian ngắn khi thở ra [44]. Các thành phần của giao thức TCAV của chúng tôi bao gồm chế độ thông khí, cài đặt trong chế độ này và các thay đổi trong sinh lý học phổi được sử dụng để sửa đổi các cài đặt này khi phổi của bệnh nhân trở nên tốt hơn hoặc tệ hơn (Hình 6a & b). Chế độ thông khí phải là chế độ kiểm soát áp lực và chu kỳ thời gian (pressure-controlled and time-cycled), với khả năng kiểm soát chính xác và độc lập của máy về thời gian hít vào và thở ra như thở thông khí xả áp lực đường thở (APRV, airway pressure release ventilation), BiLevel, Bi-Vent, BiPhasic hoặc DuoPAP. Các thiết lập được sử dụng với giao thức TCAV của chúng tôi bao gồm thời gian hít vào (THigh) kéo dài, chiếm ~ 90% của mỗi chu kỳ hô hấp; áp lực cao (PHigh) thiết lập đủ để huy động phế nang và lấy lại FRC (Hình 6a); thời gian thở ra (TLow) được thiết lập để kết thúc ở 75% tốc độ dòng thở ra tối đa (PEFR), thường là ≤ 0,5 s; và áp lực thấp (PLow) được đặt ở 0 cmH2O (Hình 6b). Mặc dù PLow được đặt ở 0 cmH2O, áp lực không bao giờ đạt 0 cmH2O vì TLow được đặt đủ ngắn để duy trì PEEP (Hình 6a).
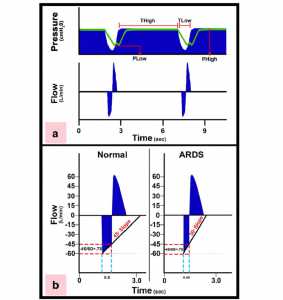
Hình a: Đường cong áp lực và lưu lượng điển hình sử dụng giao thức thông khí thích nghi được điều khiển theo thời gian (TCAV). Có một thời gian hít vào dài (THigh) và thời gian tối thiểu khi thở ra (TLow). Áp lực cao (PHigh) kết hợp với THigh xác định độ lớn và thời gian của áp lực dương liên tục (CPAP). Áp lực cuối thì thở ra (PLow) luôn được đặt là 0 cmH2O, giúp giảm thiểu sức đề kháng với lưu lượng khí thở ra cho phép đánh giá chính xác hơn về độ giãn của hệ hô hấp phổi được xác định bởi đường cong lưu lượng khí thở. Tuy nhiên, PLow không bao giờ đạt 0 cmH2O vì TLow được thiết lập đủ ngắn để duy trì cả thể tích và áp lực phổi khi thở ra. Đường màu xanh lá cây là áp lực khí quản đo được, đó là áp lực cuối thì thở ra thực tế được nhìn thấy bởi phế nang. Chúng tôi đã phát hiện ra rằng nếu thời gian thở ra được thiết lập đúng thì PLow thực tế xấp xỉ 1⁄2 của PHigh. Hình b: Sử dụng độ dốc của đường cong lưu lượng khí thở ra (SEFC, slope of the expiratory flow curve) để thiết lập thời gian thở ra cần thiết để ổn định phổi. SEFC của phổi bình thường là khoảng 45°, giảm đến 30° trong hội chứng suy hô hấp cấp tính (ARDS). Thời gian thở được tính bằng cách kết thúc thời gian thở ra ở 75% lưu lượng khí thở ra đỉnh (- 60 L/phút), trong ví dụ này là – 45 L/phút. Lưu ý rằng sử dụng tỷ lệ này trong phổi bình thường và ARDS, thời gian thở ngắn hơn (0,45 so với 0,5 s) trong phổi ARDS vì SEFC càng dốc [23]
Những thay đổi trong sinh lý học phổi được sử dụng để điều chỉnh các thiết lập dựa trên đánh giá độ dốc của đường cong lưu lượng đường hô hấp, phản ánh độ đàn hồi của hệ hô hấp. Kháng lực của hệ thống hô hấp cũng xác định độ dốc của đường cong lưu lượng thở ra; tuy nhiên, bằng cách đặt PLow bằng 0, chúng tôi sẽ giảm thiểu sức đề kháng để đo lường chính xác hơn về độ đàn hồi của phổi. Khi ARDS tiến triển và tăng độ đàn hồi của hệ hô hấp, độ dốc lưu lượng thở ra giảm (Hình 6b – phổi bình thường 45° và phổi ARDS 30°), và TLow được giảm xuống để ngăn ngừa phế nang xẹp xuống nhanh hơn do mất huy động bởi vì phổi ARDS có hằng số thời gian xẹp xuống nhanh hơn [44,45]. Giao thức TCAV với chế độ thông khí APRV là khái niệm tương tự như giao thức ARDSnet, bao gồm chế độ thông khí (điều khiển hỗ trợ thể tích, volume-assist control), cài đặt trong chế độ này (LVt < 6cc/kg, hạn chế áp lực cao nguyên (Pplat) < 30 cmH2O, …) và thang trượt FiO2/PEEP được sử dụng để điều chỉnh cài đặt.
Giao thức TCAV của chúng tôi được mô tả tốt nhất là CPAP với một thời gian xả ngắn. Giai đoạn CPAP không có kích hoạt và bệnh nhân có thể tạo ra nhịp thở tự phát không được hỗ trợ. Thành phần được điều khiển theo thời gian (time-controlled component) của giao thức TCAV của chúng tôi là thời gian hít vào (THigh) kéo dài, lớn hơn hằng số thời gian chậm nhất, dần dần “đẩy nhẹ” phổi mở ra. Thời gian ngắn khi thở ra, được thiết lập ít hơn hằng số thời gian xẹp phế nang nhanh nhất, giảm thiểu sự đóng kín đường dẫn khí (Hình 6b). CPAP hoặc PHigh được điều chỉnh theo tình trạng bệnh lý phổi, mức độ FRC của bệnh nhân và thay đổi độ giãn nở thành ngực [5]. Các thành phần thích ứng (adaptive component) của giao thức TCAV của chúng tôi sử dụng những thay đổi trong cơ chế phổi để hướng dẫn bác sĩ thiết lập thời gian thở ra hoặc TLow đủ ngắn và chính xác để ngăn ngừa mất huy động phế nang, ngay cả những phế nang có hằng số thời gian xẹp nhanh nhất (Hình 6b) [44,45].
Nói tóm lại, độ dốc càng dốc, phổi càng “nặng” phổi (độ đàn hồi hệ hô hấp lớn hơn) và thời gian thở ra cần phải ngắn để ngăn chặn sự xẹp lại đường thở khi thở ra [46]. Giao thức TCAV rất hiệu quả trong việc huy động mô phổi mà việc tăng CO2 máu thường không phải là một vấn đề bởi vì có diện tích bề mặt phế nang dồi dào để trao đổi CO2. Ngoài ra, kháng lực mạch máu phổi (PVR) là thấp nhất khi thể tích phổi ở FRC và do đó PVR không tăng cao ngay cả với áp lực đường thở trung bình cao hơn được tạo ra với giao thức TCAV. Áp lực đẩy vẫn còn thấp với giao thức TCAV ngay cả với Vt tương đối cao (10-12 cc/kg) do độ giãn nở phổi vẫn bình thường ở phổi bị thổi phồng hoàn toàn. Huy động toàn bộ phổi cũng loại bỏ kích thích cho các nỗ lực hô hấp mạnh (tức là các thụ thể căng phổi, nồng độ pH trong máu, PO2, PCO2) loại bỏ bất kỳ vấn đề nào với rối loạn đồng bộ và áp lực màng phổi âm gây áp lực xuyên phổi cao về mặt bệnh lý.
Nhóm của chúng tôi đã sử dụng giao thức TCAV ưu tiên để ngăn chặn thành công sự phát triển ARDS ở bệnh nhân [47] (Hình 7) và trong các mô hình động vật, có thể áp dụng trên lâm sàng (Hình 8) [5,48-50]. Một RCT gần đây sử dụng một giao thức tương tự như TCAV đã giảm thời gian lưu lại ICU và thông khí cơ học [51] (Hình 9). Các thiết lập lâm sàng cho giao thức TCAV đã được thảo luận chi tiết ở nơi khác [44].
![Hình 7: Phân tích gộp so sánh bệnh nhân chấn thương ở đơn vị chăm sóc đặc biệt phẫu thuật (SICU) tại 15 bệnh viện đại học (bar and whiskers), sử dụng tiêu chuẩn thông khí cơ học chăm sóc với bệnh nhân được đặt trên giao thức điều chỉnh thích ứng theo thời gian (TCAV) ngay lập tức khi đặt nội khí quản (vòng tròn đen). Điểm số nghiêm trọng chấn thương (ISS), hình a, cho thấy rằng bệnh nhân trong giao thức TCAV (vòng tròn màu đen) nằm trong phần tư trên cho thấy hiệu quả tích cực không phải do bệnh nhân bị thương ít hơn. Cả hai tỷ lệ bệnh nhân đã phát triển hội chứng suy hô hấp cấp tính (ARDS%), hình b, và tử vong của bệnh viện, hình c, ở dưới mức tối thiểu (Min) của bar and whisker. Nghiên cứu này cho thấy rằng TCAV ưu tiên có thể làm giảm đáng kể tỷ lệ mắc và tử vong ARDS [47]](https://www.healcentral.org/wp-content/uploads/2020/12/ton_thuong_phoi_cap_tinh_lam_the_nao_de_on_dinh_mot_phoi_bi_vo_6-300x122.jpg)
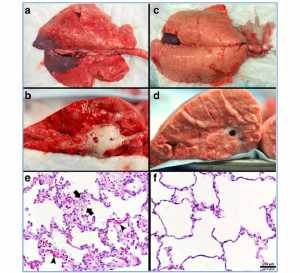
Hình 8: Hình ảnh toàn bộ phổi: hình ảnh tổng thể của toàn bộ phổi và bề mặt cắt phổi hoại tử ở bệnh nhiễm trùng phúc mạc 48 giờ cộng với thiếu máu cục bộ/tái tưới máu, mô hình thực nghiệm trên heo bị hội chứng suy hô hấp cấp tính (ARDS). Phổi được bơm phồng lên 25 cmH2O khi chụp ảnh, để chuẩn hóa thể tích phổi (hình trên a, c). Một nhóm động vật đã được đặt trên giao thức ARDSnet ngay lập tức sau chấn thương (hình trên a, b). Nhóm còn lại được đặt trên giao thức thông khí thích nghi được điều khiển theo thời gian (TCAV) ngay lập tức sau chấn thương (hình trên c, d). Ứng dụng ưu tiên của giao thức ARDSnet không ngăn cản sự phát triển của ARDS. Một khu vực rộng lớn của đông đặc (màu đỏ sẫm), viêm (màu đỏ), và vùng phổi không hoàn toàn thổi phồng ở áp lực khí 25 cmH2O được hiển thị (hình trên a). Các bề mặt phổi cắt cũng chứng minh tình trạng viêm khắp mô phổi và bọt phù nề chảy từ các đường hô hấp lớn (hình trên b). Giao thức TCAV ưu tiên ngăn chặn sự phát triển của ARDS với phổi xuất hiện màu hồng (không có viêm) và hoàn toàn bơm phồng cao (hình trên c). Mô hồng bị thổi phồng đã được nhìn thấy trên khắp bề mặt phổi bị cắt và không thấy bọt phù nề trong đường dẫn khí (hình trên d). Mô học phổi: hình dưới cho thấy nhuộm mô học đại diện trong giao thức ARDSnet (e) và TCAV (f). Mô phổi từ nhóm giao thức ARDSnet cho thấy độ dày vách phế nang (giữa các mũi tên) và tắc nghẽn mạch (đầu mũi tên) (hình dưới e), không được thấy trong nhóm giao thức TCAV (hình dưới f) [5]
![Hình 9: Trong một thử nghiệm ngẫu nhiên có đối chứng (RCT), bệnh nhân có hội chứng suy hô hấp cấp (ARDS) trong nhóm thở thông khí xả áp lực đường thở (APRV) sử dụng một giao thức tương tự như thông khí thích nghi điều khiển thời gian (TCAV) có giảm thời gian thông khí cơ học so với nhóm giao thức ARDSnet (LTV)thể tích khí lưu thông thấp [51]](https://www.healcentral.org/wp-content/uploads/2020/12/ton_thuong_phoi_cap_tinh_lam_the_nao_de_on_dinh_mot_phoi_bi_vo_8-300x275.jpg)
Giao thức TCAV thiết lập ở bệnh nhân ARDS
Quan điểm của chúng tôi là giao thức TCAV nên được áp dụng cho tất cả các bệnh nhân có nguy cơ phát triển ARDS ngay sau khi được đặt nội khí quản. Tuy nhiên, giao thức TCAV cũng hoạt động rất tốt để mở và ổn định phổi của bệnh nhân có ARDS đã thành lập. Mặc dù chưa có một RCT so sánh giao thức TCAV với giao thức ARDSnet, chúng tôi có kinh nghiệm chuyên môn mạnh mẽ. Giao thức TCAV là phương thức thông khí chính tại Trung tâm sốc/chấn thương R. Adam Cowley ở Baltimore, MD, Hoa Kỳ và hàng triệu giờ kinh nghiệm chuyên môn đã được tích lũy ở bệnh nhân ARDS nặng, bao gồm cả bệnh nhân oxy hóa màng ngoài cơ thể (ECMO).
Chiến lược LVt hiện là tiêu chuẩn chăm sóc vì các RCT cho thấy Vt thấp (6 cc/kg) so với Vt cao hơn (12 cc/kg) làm giảm đáng kể tỷ lệ tử vong [34]. RCT này kết hợp với bằng chứng từ các RCT khác, phân tích gộp và đánh giá có hệ thống đã dẫn đến các hướng dẫn về y học dựa trên chứng cứ (EBM) đề xuất Vt và áp lực cao nguyên thấp hơn, với độ tin cậy trung bình trong ước tính hiệu quả [52]. EBM ngày càng được chấp nhận như là tiêu chuẩn vàng để hướng dẫn chăm sóc bệnh nhân, nhưng các bác sĩ đang bắt đầu thách thức việc sử dụng độc quyền EBM để hướng dẫn chăm sóc bệnh nhân [53-59]. Một bài báo được công bố trên Lancet, một tạp chí hoài nghi về tính hợp lệ của các khuyến cáo của EMB, chỉ trích RCT vì chúng tập trung vào hiệu lực nội bộ (chỉ hiệu quả trên bệnh nhân phù hợp với tiêu chuẩn cho nghiên cứu được kiểm soát) và bỏ qua các vấn đề quan trọng về hiệu lực bên ngoài (hiệu quả trên tất cả bệnh nhân) [60]. RCT được coi là thành phần quan trọng của mô hình EBM mới [61]. Tuy nhiên, thất bại EBM thường có thể được quy cho sự nhấn mạnh này về hiệu lực nội bộ của RCT và do đó các khuyến nghị thường thất bại trong thực hành lâm sàng (giá trị bên ngoài) [62,63]. Fernandez et al. nói rằng, “Vấn đề chính với cách tiếp cận EMB là cách tiếp cận hạn chế và đơn giản đối với kiến thức khoa học, ưu tiên giá trị nội bộ như là chất lượng chính của các nghiên cứu được đưa vào các hướng dẫn lâm sàng”. Do đó, EBM đề xuất các chiến lược điều trị có thể hoặc không thể là kinh nghiệm chuyên môn tối ưu và được kiểm chứng bên ngoài của các bác sĩ đã sử dụng các chiến lược điều trị thành công trong các ICU của họ cũng nên được xem xét.
Nghiên cứu ART thử nghiệm RCT vừa mới công bố áp dụng phương pháp tiếp cận phổi mở (OLA) bằng cách sử dụng các chiến lược thông khí thông thường (Vt thấp, PEEP, và thủ thuật huy động phế nang) ở bệnh nhân ARDS đã thành lập. Trong nghiên cứu này nhóm OLA đã gia tăng tỷ lệ tử vong, cho thấy khả năng rằng OLA có thể không phải là một chiến lược thông khí hiệu quả đối với ARDS được thiết lập [64]. Tuy nhiên, nó không được biết nếu chiến lược OLA được sử dụng trong nghiên cứu này thực sự huy động phổi (tức là không có CT phổi cho thấy huy động đầy đủ). Chúng tôi đã chỉ ra rằng giao thức TCAV vượt trội hơn so với thông khí cơ học có kiểm soát (CMV) với PEEP cao khi mở và ổn định phế nang dưới màng phổi [65-68]. Chúng tôi đề xuất, và dữ liệu động vật của chúng tôi [48,50,65-67] và kinh nghiệm lâm sàng chuyên môn hỗ trợ, giao thức TCAV vượt trội hơn CMV với RM cộng với PEEP khi mở phổi ARDS không giãn nở. Sử dụng giao thức TCAV đã được sửa đổi này trên bệnh nhân chết não có phổi bị xẹp, chúng tôi đã tăng số lượng phổi cấy ghép lên ~ 680% (các quan sát chưa được công bố). Hỗ trợ thêm đến từ RCT so sánh một giao thức tương tự, nhưng không giống với TCAV với giao thức ARDSnet ở bệnh nhân ARDS [51]. Nghiên cứu này cho thấy rằng các giao thức TCAV cải thiện oxy hóa và độ giãn nở hệ thống hô hấp (cho thấy huy động phổi cao hơn), giảm áp lực cao nguyên và giảm cả thời gian ICU và thời gian thông khí cơ học (Hình 9). Chúng tôi đưa ra lý do tại sao giao thức TCAV vượt trội hơn khi mở phổi trong ARDS là do bản chất đàn hồi nhớt (viscoelastic nature) của mở và xẹp phế nang [8]. Thời gian kéo dài trong hít vào sẽ huy động mô phổi ở áp lực khí thấp hơn nhiều so với khi cần thiết để mở phổi bằng RM, vì nó không chỉ là áp lực mà còn là thời gian áp lực áp dụng để huy động mô phổi [69]. Không giống như RM là ứng dụng một lần áp lực đường thở cao, giao thức TCAV duy trì áp lực đường thở cao gần như liên tục (ngoại trừ giai đoạn xả rất ngắn) sao cho phế nang được “đẩy nhẹ” theo thời gian.
Kết luận
Bằng cách sử dụng hiểu biết của chúng tôi về sinh lý bệnh ARDS, cơ chế của VILI ở mức độ phế nang, chúng ta có thể ổn định phổi ở những bệnh nhân có nguy cơ cao phát triển ARDS, tương tự như “bó bột” một xương bị gãy để ổn định. Các giao thức TCAV sử dụng một chiến lược đơn giản của CPAP mở van với thời gian xả ngắn, liên tục được hướng dẫn bởi những thay đổi trong cơ học phổi. Bởi vì giao thức TCAV có thể được áp dụng ngay khi đặt nội khí quản, rất sớm trong sinh bệnh ARDS, nó sẽ có hiệu quả “không bao giờ cho phổi cơ hội xẹp” [8] và bằng cách làm như vậy loại bỏ hầu hết sinh lý học của VILI. Giao thức TCAV đã được chứng minh là ngăn chặn ARDS trong một nhóm bệnh nhân chấn thương có nguy cơ ARDS cao khi áp dụng sớm và được sử dụng làm phương thức thông khí cơ học tại bệnh viện R Adam Cowley Shock/Trauma ở Baltimore, MA [47,51]; một giao thức tương tự như TCAV đã được chứng minh là cải thiện độ giãn nở hệ thống hô hấp và oxy hóa và giảm thời gian thở máy và thời gian ở lại ICU [51].





