Bài viết Tiếp Cận Đánh Giá Về Rối Loạn Kiềm- Toan Theo Sinh Lý được Triệu Ngân dịch từ bài viết gốc: Physiological Approach to Assessment of Acid–Base Disturbances
Cân bằng acid – base nội mô là cơ sỏ của duy trí sự sống. Giải thích chính xác và kịp thời rối loạn axit-base có thể cứu sống bệnh nhân, nhưng việc xác định một chẩn đoán chính xác có thể là thách thức1 .
Có ba phương pháp chính để xác định các rối loạn cơ bản của axit –base là phương pháp tiếp cận sinh lý học, phương pháp tiếp cận căn bản và phương pháp tiếp cận hóa-lý (còn được gọi là phương pháp Stewart). 2 Bài viết này mở rộng các bước theo tiếp cận theo hướng sinh lý học
Tiếp cận sinh lý học sử dụng hệ thống đệm acid cacbonic- bicarbonat. Dựa trên nguyên lý cân bằng hydro, hệ thống này đặc trưng là acide là phân tử cho hydro và base là phân tử nhận hydro. Hệ thống đệm bicarbonat rất quan trọng trong kiểm soát hằng định nội mô.
Trong tiếp cận sinh lý học, thay đổi đầu tiên trong áp suất riêng phần của carbon dioxit (Pco2) gây ra đáp ứng “thích ứng” thứ cấp ở nồng độ bicarbonate và ngược lại;những thay đổi thêm về carbon dioxide hoặc bicarbonate phản ánh những thay đổi thêm trong trạng thái acid- base. Bốn rối loạn cơ bản của acid-base được xác nhận bao gồm hai rối loạn chuyển hóa (toan và kiềm) và hai rối loạn hô hấp (toan và kiềm).
Nồng độ ion hydro được điều chỉnh chặt chẽ bởi vì những thay đổi trong ion hydro làm thay đổi hầu như tất cả các chức năng của protein và màng tế bào . Vì nồng độ ion hydro trong huyết tương thường rất thấp (khoảng 40 nmol / lít), độ pH , là logarit âm của nồng độ ion hydro, thường được sử dụng trong y học lâm sàng để chỉ tình trạng acid-base. Các thuật ngữ “toan máu” và “kiềm máu” chỉ các trạng thái trong đó pH máu thấp bất thường (có tính toan) hoặc cao bất thường (kiềm).
Trong đó quá trình nồng độ ion hydro tăng lên được gọi là nhiễm toan, và quá trình trong đó nồng độ ion-hydro bị giảm được gọi là nhiễm kiềm. Việc xác định các giá trị axit-base truyền thống dựa trên Phương trình Henderson – Hasselbalch (trong đó pK biểu thị hằng số phân ly axid):
pH = pK + log10 (bicarbonate [HCO3−] ÷ [0.03 × áp suất riêng phần CO2 máu động mạch (Paco2)]),
trong đó bicarbonate được tính bằng milimol / lít và PaCO2 tính bằng mmHg . Rối loạn axit-base được gọi là “hô hấp” khi nó gây ra bởi một bất thường chính trong chức năng hô hấp (ví dụ, sự thay đổi trong PaCO2) và “chuyển hóa” khi thay đổi chính là do sự thay đổi nồng độ bicarbonate.
1.Bệnh sử và thăm khám lâm sàng
Bước đầu tiên để đánh giá rối loạn toan- kiềm là đánh giá lâm sàng cẩn thận. Thay đổi dấu hiệu và triệu chứng thường cung cấp giá trị liên quan đến rối loạn cơ bản. Bao gồm dấu hiệu sinh tồn ( có thể gặp shock hoặc nhiểm trùng huyết), tình trạng thần kinh (còn hay rối loạn ý thức ), dấu hiệu nhiễm trùng ( sốt ), tình trạng hô hấp ( tần số thở hay có hay không có nhịp thở Kusssmaul, tím, và ngón tay dùi trống ) và triệu chứng tiêu hóa ( nôn ói hay tiêu chảy). Xác định chính xác tình trạng lâm sàng như có thai, đái tháo đường và bệnh tim, gan, phổi, thận có thể là nguyên nhân .Lâm sàng nên xác định bệnh nhân đã dùng thuốc nào trước đó có thể gây tình trạng rối loạn cận bằng acid- base (ví dụ: an thần, lợi tiểu, topiramate hay metformin ) và nên xem xét dấu hiệu nhiễm độc có thể liên quan ( như: hơi thở ceton do nhiễm toan cetone trong đái tháo đường hay nhiểm độc rượu và rối loạn thị giác là triệu chứng của nhiễm độc methanol)
2. Xác định rối loạn Acid-base nguyên phát và đáp ứng thứ pháp
Bước thứ hai là xác định rối loạn acid-base nguyên phát và đáp ứng thứ phát. Phạm vi pH tương thích với sự sống là 7.80 đến 6.80 (nồng độ ion hydro [H +] 16 đến 160 nmol/lít) .Với mục tiêu của bài này, giá trị tham chiếu cho pH là 7,40 ± 0,02, đối với PaCO2, 38 ± 2 mm Hg, và đối với [HCO3−], 24 ± 2 mmol/lít. Bốn rối loạn cơ bản của acid- base được xác định là rối loạn nguyên phát của acid-base trong (Bảng 1 và Hình 1). Các quan sát thực nghiệm cho thấy sự đáp ứng của hằng định nội mô đối với các rối loạn acid-base có thể dự đoán và tính toán được .Để đáp ứng với các rối loạn về chuyển hóa những thay đổi về tốc độ hô hấp tăng nhanh và trạng thái ổn định mới của PaCO2 đạt được trong vòng vài giờ. Trong khi đó, các trường hợp bất thường về hô hấp kéo dài, thì đáp ứng chuyển hóa xảy ra chậm và cần từ 2 đến 5 ngày để nồng độ bicarbonat trong huyết tương đạt đến trạng thái ổn định mới .Thay đổi hô hấp được gọi là “cấp”hoặc “mạn” phụ thuộc vào đáp ứng thứ phá của nồng độ bicarbonate trong tiêu chuẩ ( bảng 1). Rối loạn acid-base hỗn hợp được chẩn đoán khi đáp ứng thứ phát khác với mong đợi.
Có những dấu hiệu liên quan đến những thay đổi bù trừ. Giá trị khí máu luôn luôn có thể được giải thích bởi hai hoặc nhiều rối loạn cùng tồn tại.
| Bảng 1. Rối loạn acid-base nguyên phát và đáp ứng ( “sự bù trừ” ) thứ phát.* |
| Toan chuyển hóa
pH <7.38 and bicarbonate [HCO −] <22 mmol per liter 3 Đáp ứng thứ phát (hô hấp) : Paco2 = 1.5 × [HCO3−] + 8±2 mm Hg† or [HCO3−] + 15 mm Hg‡ Kiềm chuyển hóa pH >7.42 and [HCO −] >26 mmol per liter 3 Đáp ứng thứ phát(hô hấp ): Paco2 = 0.7 × ([HCO 3−] − 24) + 40±2 mm Hg or [HCO3−] + 15 mm Hg‡ or 0.7 × [HCO3−] + 20 mm Hg§ Đáp ứng thứ phát bù trừ đủ và hoản toàn trong 24–36 hr Kèm theo toan hay kiềm hô hấp có thể được chẩn đoán nếu tính toán PaCO2 lớn hơn hoặc thấp hơn giá trị tính toán Toan hô hấp pH <7.38 and Paco2 >42 mm Hg Đáp ứng thứ phát (chuyển hóa ) Cấp: [HCO3−] tăng bằng 1 mmol/liter cho mỗi Paco2 tăng 10 mm Hg trên 40 mm Hg Đáp ứng thứ phát bù trừ đủ và hoản toàn trong 2–5 days Kèm theo toan hay kiềm chuyển hóa có thể được chẩn đoán nếu tính toán [HCO3−] lớn hơn hoặc thấp hơn giá trị tính toán Kiềm hô hấp Đáp ứng thứ phát (chuyển hóa ) Cấp : [HCO3−] giảm 2 mmol/liter cho mỗi Paco2 giảm 10 mm Hg dưới 40 mm Hg Mạn: [HCO3−] giảm bằng 4–5 mmol/liter cho mỗi Paco2 giảm 10 mm Hg dưới 40 mm Hg Đáp ứng thứ phát bù trừ đủ và hoản toàn trong 2–5 days Kèm theo toan hay kiềm chuyển hóa có thể được chẩn đoán nếu tính toán [HCO3−] lớn hơn hoặc thấp hơn giá trị tính toán |
Reference values for arterial blood gases are the following: pH, 7.4±0.02, par tial pressure of arterial carbon dioxide (Paco2), 40±2 mm Hg, and bicarbonate, 24±2 mmol per liter. Reference values for venous blood gases are the following: pH, 7.36 to 7.38, Pvco2, 43 to 48 mm Hg, and bicarbonate, 25 to 26 mmol per liter. To convert the values for PCO2 to kilopascals, divide by 7.5006.
† This formula is also known as the Winters formula.
‡ These calculations are easy to make at the bedside but are not reliable at all bicarbonate concentrations. Data are from Berend.8
§ The secondary respiratory response is difficult to predict in metabolic alkalosis.
Các phương trình dự đoán hiện tại được sử dụng để đánh giá tình trạng acid-base là xấp xỉ dựa trên gần 40 năm nghiên cứu ở người và chó. Các nghiên cứu thực nghiệm về hạ CO2 máu mạn mức độ nặng và tăng CO2 máu ở người không khả thi về mặt đạo đức; do đó, dữ liệu không đủ để xây dựng giới hạn tin cậy cho toan hay kiềm hô hấp mạn tính nặng
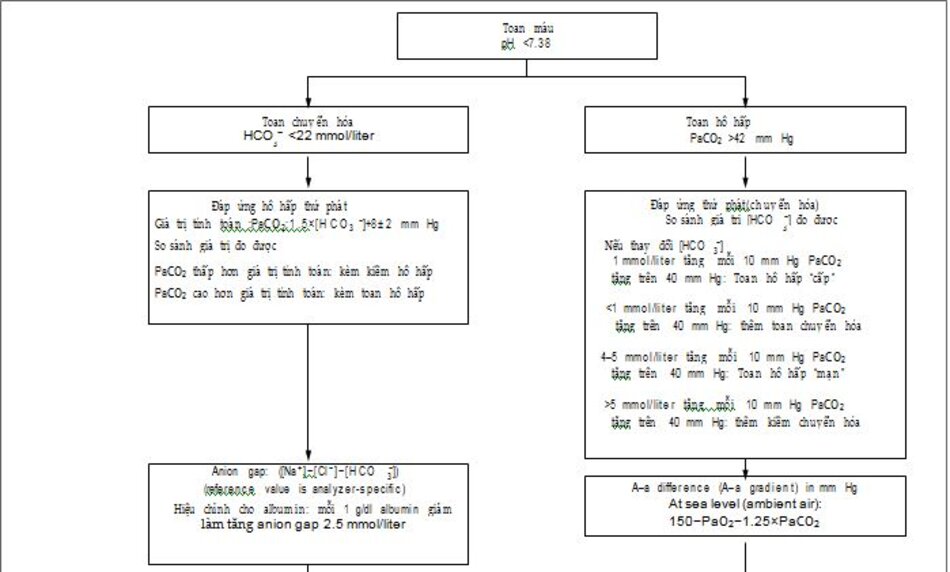
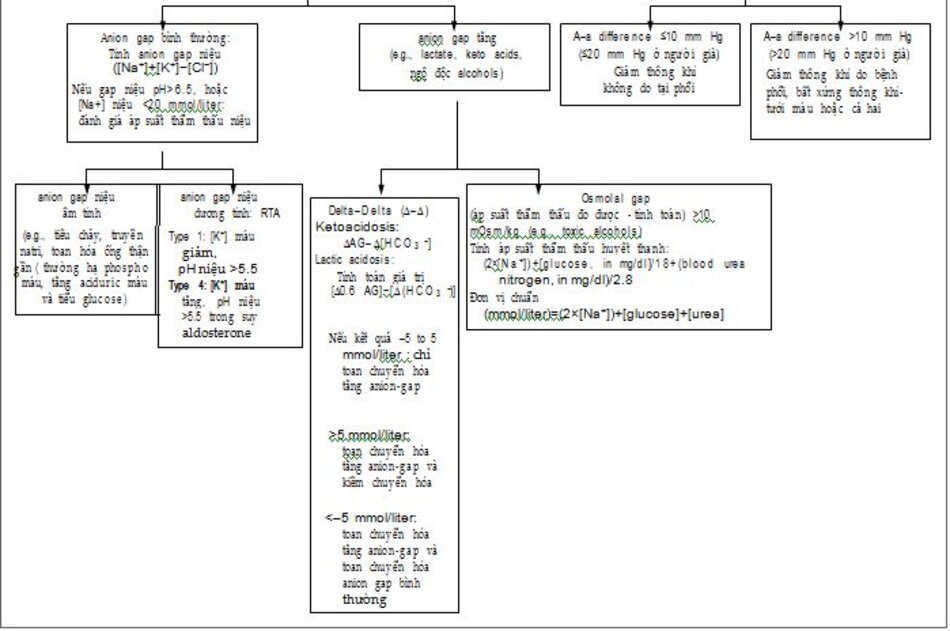
| Hình 1. Đạnh giá toan máu
Giá trị khuyến cáo cho chênh áp oxy phế nang- động mạch (A-a) ít hơn 10mmHg ỏ người trẻ và ít hơn 20 mmHg ở người già . ΔAG :delta anion gap, Paco2 áp suất riêng phần CO2 (mm Hg), PaO2 áp suất riêng phần oxy máu động mạch (mm Hg), and RTA toan hóa ống thận. To con-vert the values for PaCO2, PaO2, and the alveolar– arterial difference to kilopascals, multiply by 0.1333. |
Người ta thường chấp nhận rằng quá trình bù trừ có thể bình thường hóa độ pH chỉ trong kiềm hô hấp mạn tính. Ngược lại với dữ liệu cũ hơn, dữ liệu từ một nghiên cứu gần đây chỉ ra rằng độ pH trong nhiễm toan hô hấp mạn tính có thể là bình thường và trong từng trường hợp, cao hơn so với xác nhận chung (pH> 7,40) .Hơn nữa, thường những thay đổi bù trừ của PaCO2 có thể bị hạn chế trong trường hợp thiếu oxy máu nặng. Các dụng cụ đo được sử dụng để đo khí máu và điện giải có thể khác nhau, ảnh hưởng đến kết quả. Thực tế, các nghiên cứu liên quan đến việc sử dụng phân tích hiện đại cho thấy các giá trị tham chiếu pH (7,40 đến 7,44) và các đáp ứng thứ phát khác tài liệu này được xuất bản trong textbook. Mặc dù những khác biệt này nhỏ nhưng có thể cần phải thẩm định lại phương trình tính toán.
3. Đánh giá thành phần chuyển hóa trong rối loan Acid-Base
Bước ba là đánh giá cân nhắc thánh phần chuyển hóa của rối loạn
3.1 Toan chuyển hóa
Tính toán anion gap rất hữu ích trong đánh giá ban đầu của toan chuyển hóa. Tổng của các ion dương và âm trong huyết tương là bằng nhau trong cơ thể: [Na +] + [K +] + [Ca2 +] + [Mg2 +] + [H +] + cation không đo được = [Cl−] + [HCO3−] + [CO32−] + [OH−] + albumin + phosphat + sunfat + lactat + anion không đo được (ví dụ: anion hữu cơ) .Đo thường quy tất cả các ion trong huyết tương nói chung là không cần thiết. Một cách tiếp cận thực tế hơn tận dụng lợi thế của thực tế là hầu hết các ion huyết tương thường có ở nồng độ tương đối thấp và thay đổi trong giới hạn bệnh lý lượng rất nhỏ. Có 3 ion nồng độ nhiều nhất trong huyết tương và sự thay đổi lớn nhất về nồng độ được sử dụng để tính toán “các anion không đo được” trong nhiễm toan chuyển hóa, “anion-gap” được tính là [Na +] – [Cl−] – [HCO3−].
Tuy nhiên, khoảng cách ion thực sự không tồn tại trong in vivo, bởi vì tổng các điện tích ion dương và âm tính trong plasma phải bằng nhau. Phạm vi tham chiếu rộng từ 3,0 đến 12,0 mmol/lít lên đến 8,5 đến 15,0 mmol/lít của anion gap đã được báo cáo, do sự khác biệt trong các phương pháp phòng thí nghiệm. Do đó, trên lâm sàng nên biết tham chiếu phạm vi cho phòng thí nghiệm riêng.
3.2 Toan chuyển hóa tăng anion gap
Có nhiều nguyên nhân gây nhiễm toan chuyển hóa có tăng anion gap (Bảng 2). Một cách ghi nhớ cho các nguyên nhân phổ biến nhất là GOLD MARRK (glycols [ethylene và propylene], 5- oxoproline [axit pyroglutamic], L-lactate, D- lactate, methanol, aspirin, suy thận, tiêu cơ vân, và toan keto. Anion gap tăng lên khi nồng độ bicarbonate giảm tương ứng với nồng độ natri và clorua do sản xuất quá nhiều axit (trong nhiễm keto acid,toan acid lactic ,và ngộ độc rượu và nhiễm độc rượu), ít tiết acid (trong suy thận cấp tiến triển), tiêu tế bào (trong tiêu cơ vân lớn), hoặc các trường hợp khác (ví dụ, sử dụng thuốc kháng sinh có nguồn gốc từ penicillin).
3.3 Sử dụng và giới hạn của anion gap
Nhiễm toan acid lactic chiếm khoảng một nửa số trường hợp tăng anion gap và thường do sốc hoặc thiếu oxy mô. Tuy nhiên, anion gap là một phản ứng tương đối không nhạy của nhiễm toan lactic – gần một nửa số bệnh nhân có mức lactate huyết thanh giữa 3,0 và 5,0 mmol /lít có anion gap trong khoảng bình thường. Anion gap, có độ nhạy và độ đặc hiệu dưới 80% trong việc xác định nồng độ lactate tăng cao, không thể thay thế phép đo mức lactate huyết thanh. Tuy nhiên, mức lactate không được đo thường xuyên hoặc không luôn có thể có được, và anion gap tăng có thể chú ý cho bác sĩ rằng cần phải đánh giá thêm. Không may , giá trị cơ bản của anion gap nói chung là không có sẵn cho một bệnh nhân cụ thể. Ngoài ra, anion gap phải luôn bị ảnh hưởng nồng độ albumin, bởi vì
| Table 2. The Anion Gap in Relation to Common Medical Conditions with Metabolic Acidosis.* |
| Tăng anion gap
Sản xuất quá nhiều acid DLactic acidosis trong hội chứng ruột ngắn Không bài tiết acid (suy thận tiến triển)† Không tăng anion gap Mất bicarbonate |
* anion gap lớn hơn 10 mmol / lít trên giới hạn trên của giá trị giới hạn là rất gợi ý về toan hữu cơ (organic acidosis). Một sự gia tăng nhỏ trong anion gap là rất ít gợi ít trong việc chẩn đoán toan chuyển hóa
† Suy thận cấp tiến triển khi GRF <20ml/phút
axit yếu có thể chiếm tới 75% anion gap. Nếu không có sự điều chỉnh cho thiếu albumin, anion gap ước tính gia tăng đáng kể nhiều về mặt lâm sàng trong anion (> 5 mmol / lít) trong hơn 50 % các trường hợp. Đối với mỗi lần giảm 1g /dl albumin huyết thanh, anion gap được tính toán sẽ tăng khoảng 2,3 đến 2,5 mmol trên lít. Tuy nhiên, anion gap albumin được hiệu chỉnh chỉ đơn thuần là tương đối, vì nó không tính đến các ion như magiê, canxi và ion photphat.
Anion gap có thể giúp thiết lập chẩn đoán của nhiễm ketoacidosis do đái tháo đường. Ở những bệnh nhân có tình trạng này, anion gap có thể được sử dụng để theo dỏi tình trạng toan ceton và chẩn đoán toan anion gap bình thường nếu một lượng thể tích muối đẳng trương được truyền vào.
Một anion gap cao với mức lactate bình thường ở bệnh nhân nghiện rượu có thể là một dấu hiệu quan trọng để chẩn đoán toan ceton do rượu. Chẩn đoán này có thể bị bỏ sót vì xét nghiệm được sử dụng rộng rãi để đánh giá ceton niệu (xét nghiệm nitroprusside) chỉ phản ứng với acetoacetate, chứ không phải với β- hydroxybutyrate, axit ceto nguyên phát được thấy trong nhiễm toan ceton do rượu. Độ pH cũng có thể gây nhầm lẫn bình thường hoặc tăng lên do nhiễm kiềm chuyển hóa đồng thời do nôn hoặc nhiễm kiềm đường hô hấp do bệnh gan, có thai, nhiệt độ cao hoặc nhiễm trùng huyết Anion gap cũng có thể hỗ trợ trong việc chẩn đoán nhiễm toan lactic ở bệnh nhân có hội chứng ruột ngắn, vì mức lactate chuẩn (D-lactate) vẫn bình thường trong khi anion gap tăng
Anion gap thấp hoặc âm tính được quan sát thấy khi tăng cholesterol máu gây ra bởi nồng độ cao của các ion dương, như được thấy trong ngộ độc lithium , bệnh gamma đơn dòng IgG, hoặc các rối loạn đặc trưng bởi nồng độ canxi hoặc magiê cao. Một anion gap âm tính là do giả tăng cholesterol máu (pseudohyperchloremia) trong nhiễm độc bromua hoặc iodua
3.4 Toan anion gap bình thường
Clorua đóng một vai trò trung tâm trong điều hòa toan kiềm nội bào và ngoại bào. Nhiễm toan- anion gap bình thường xảy ra khi giảm các ion bicarbonate tương ứng với sự gia tăng các ion clorua để giữ lại điện âm, cũng được gọi là toan chuyển hóa tăng clo máu .Đây là loại nhiễm toan xảy ra do mất bicarbonate qua đường tiêu hóa (ví dụ, do tiêu chảy , mất bicarbonate do thận có thể xảy ra trong do nhiểm toan hóa nước tiểu do ống thận (acid tubularsis) , hoặc trong suy thận sớm khi bài tiết acid bị suy giảm. Tăng clo máu trong bệnh viện thường gây ra do sự truyền dịch lượng lớn nước muối bình thường (0,9%) , Nhiễm toan do tăng clo máu nên dẫn đến tăng sự bài tiết amoni thận, và đo được amoni niệu do đó có thể được sử dụng để phân biệt giữa các nguyên nhân thận và ngoài thận của nhiễm toan anion gap bình thường. Tuy nhiên, ammonium niệu hiếm khi được đo, anion gap niệu và gap thẩm thấu nước tiểu thường được sử dụng như là các biện pháp thay thế của bài tiết của ammonium nước tiểu.9,67
Anion gap niệu ([Na +] + [K +] – [Cl−]) thường âm tính trong nhiễm toan anion gap bình thường, nhưng nó sẽ trở nên dương tính khi bài tiết ammonium niệu (NH4 +) (như ammonium chloride [NH4Cl] ) bị suy yếu, như suy thận, nhiễm toan ống thận xa, giảm aldosterol . Một anion gap niệu âm tính xảy ra trong nhiễm toan khoảng trống bình thường do tiêu chảy và toan hóa ống thận gần, trong đó quá trình axid hóa ống thận xa còn nguyên vẹn . Anion gap niệu không đáng tin khi có đa niệu, khi pH nước tiểu vượt quá 6,5 hoặc khi ammonium niệu được bài tiết với một anion khác với clorua (ví dụ: axit keto, acetylsalicylic acid D-lactic acid, and chất tương tự penicillin). Hơn nữa, toan hóa nước tiểu đòi hỏi phải cung cấp đủ natri ở ống thận xa; do đó, tính hữu ích của anion gap niệu là vấn đề khi mức tiết niệu tiết niệu dưới 20 mmol / lít. Trong trường hợp này, khoảng cách thẩm thấu (osmolal gap) nước tiểu thường đáng tin cậy hơn.
Khoảng cách osmolal niệu xác định sự khác biệt giữa độ thẩm thấu nước tiểu được đo và tính toán. Độ thẩm thấu nước tiểu được tính toán như sau:
(2 × [Na+] + 2 × [K+]) + (urine urea nitrogen [mg/dl] ÷ 2.8) + (urine glucose [mg/dl] ÷ 18)
or (in millimoles per liter):
(2×[Na+]+2×[K+])+(urine urea nitrogen)+(urine glucose).
Ở những bệnh nhân không có bệnh đái tháo đường, snồng độ glucose thường bị bỏ qua từ tính toán này. khoảng cách thẩm thấu nước tiểu dưới 40 mmol / lít trong nhiễm toan anion gap bình thường cho thấy sự suy giảm bài tiết của ammonium niệu. Khoảng cách osmolal niệu thường phản ánh mức độ của amoni, ngoại trừ sự hiện diện của một lượng lớn axit không phân hủy, chẳng hạn như axit β-hydroxybutyric trong nhiễm ceton acid. Khoảng cách osmolal niệu, so với khoảng cách anion niệu, có mối tương quan tốt hơn với giá trị ammonium niệu.9,67
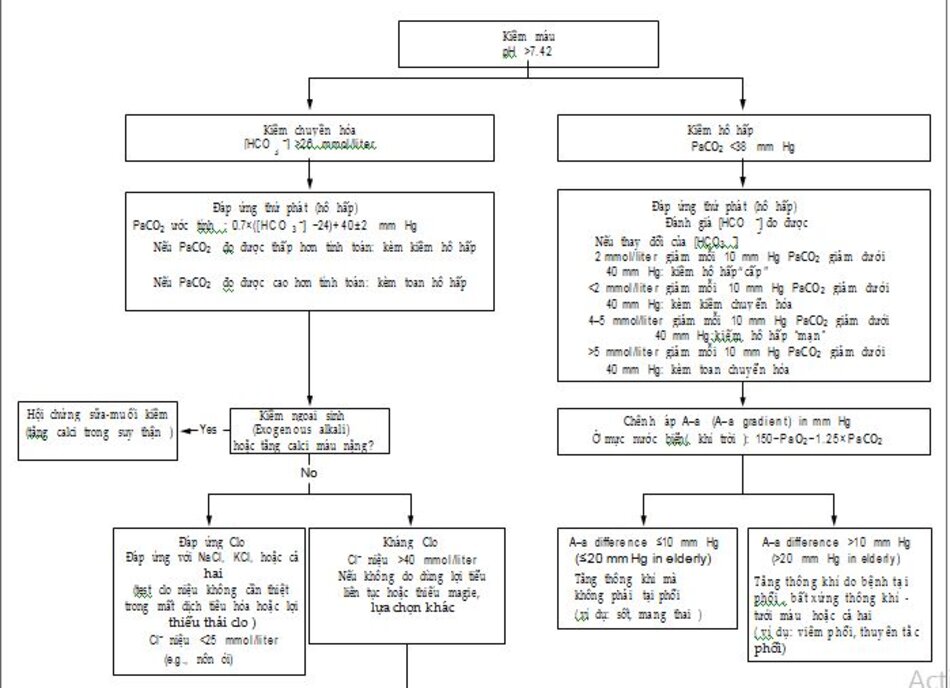
3.5 Kiềm chuyển hóa
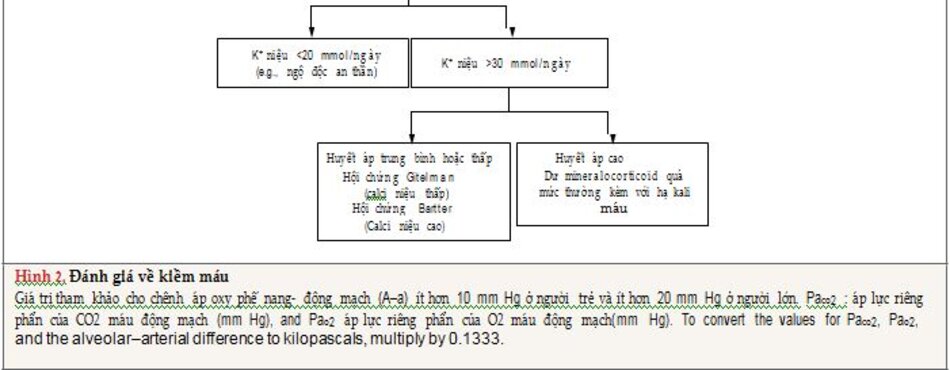
Thận bình thường có hiệu quả cao trong bài tiết một lượng lớn bicarbonate ,theo đó, kiềm chuyển hóa (Hình 2) đòi hỏi cả sự gia tăng kiềm và suy bài tiết bicarbonate của thận. Mất dịch dạ dày và việc sử dụng thuốc lợi tiểu chiếm đa số các trường hợp nhiễm kiềm chuyển hóa. Bằng cách đo clorua trong nước tiểu, người ta có thể phân biệt giữa đáp ứng clorid (chloride-responsive) và kháng clorid (chloride-resistant ) ở kiềm chuyển hóa. Nếu lượng tuần hoàn hiệu quả giảm, thận sẽ tái hấp thu natri, bicarbonate và clorua, phần lớn thông qua hoạt hóa của hệ thống aldosterone renin-angiotensin, do đó làm giảm nồng độ clorua niệu.
Một mẩu clo nước tiểu ít hơn 25mmol/l nghĩ đến nhiễm kiềm chuyển hóa đáp ứng clo. Truyền dịch với natri clorua (thường với kali clorua) phục hồi thể tích động mạch hiệu quả, bổ sung các ion kali, hoặc cả hai với sự điều chỉnh của kiềm chuyển hóa.
Kiềm chuyển hóa với nồng độ clorua niệu hơn 40 mmol / lít chủ yếu là do bài tiết natri clorua không thích hợp qua thận, thường phản ánh quá mức mineralocorticoid hoặc hạ kali máu nặng (nồng độ kalium <2mm/l) Việc truyền natri clorua không điều chỉnh kiềm chuyển hóa này, vì lý do đó, được gọi là “kháng clorua”. Kiềm chuyển hóa do lợi tiểu là ngoại lệ do nồng độ clo nước tiểu tăng ngay ban đầu cho đến khi lợi tiểu có tác dụng, sau đó nồng độ sẽ giảm xuống mức dưới 25 mmol/l .Các nguyên nhân quan trọng khác của kiềm chuyển hóa kháng clorua là hội chứng Bartter, hội chứng Gitelman, tăng calci huyết cực cao (extreme )và thiếu magiê máu nặng. Ngược lại với cường aldosteron, những nguyên nhân này không liên quan đến việc giữ natri (Hình 2).
4. Đánh giá tình trạng rối loạn chuyển hóa kiềm toan hỗn hợp
Bước thứ tư trong việc đánh giá các rối loạn acid-base là xem xét khả năng xảy ra rối loạn toan kiềm hỗn hộp. Trong nhiễm toan chuyển hóa anion gap tăng, độ lớn của sự gia tăng anion gap (delta AG, hoặc ∆AG) có liên quan đến việc giảm các ion bicarbonate (∆ [HCO3−]). Để chẩn đoán một nhiễm toan- anion gap tăng với nhiễm kiềm chuyển hóa đồng thời hoặc toan-anion gap bình thường, cái gọi là delta-delta (∆-∆) có thể được sử dụng. Khoảng cách delta là sự so sánh giữa tăng (delta) trong anion gap trên giá trị chuẩn trên (ví dụ: 12 mmol /l) và thay đổi (delta) ở nồng độ ion bicarbonate từ giá trị giới hạn thấp của các ion bicarbonate (ví dụ: 24 mmol / lít) . Trong nhiễm ketoacidosis, có mối tương quan 1: 1 giữa sự gia tăng anion gap và sự giảm nồng độ của bicarbonat. Trong nhiễm toan lactic, nồng độ bicarbonate giảm gấp 0,6 lần trong tăng anion gap (ví dụ, nếu anion gap tăng 10 mmol / lít, nồng độ bicarbonate sẽ giảm khoảng 6,0 mmol / lít). Sự khác biệt này có lẽ là do độ thanh thải dưới của lactate thấp hơn so với keto.Việc đệm hydro trong tế bào và xương cần có thời gian để đạt được hoàn toàn. Theo đó, tỷ lệ này có thể gần bằng 1: 1 với nhiễm toan lactic “rất cấp tính” (ví dụ, co giật nhanh chóng hoặc ở những người tập thể dục đến khi kiệt sức) . Nếu ∆AG – ∆ [HCO3−] = 0 ± 5mmol / lít ở bệnh nhân nhiễm ketoacidosis hoặc nếu 0,6 ∆AG –∆ [HCO3−] = 0 ± 5 mmol / lít trong bệnh nhân với nhiễm toan lactic. Một sự khác biệt lớn hơn 5 mmol / lít cho thấy một kiềm chuyển hóa kém theo, và nếu sự khác biệt là ít hơn −5 mmol / lít, một toan chuyển hóa anion gap bình thường được chẩn đoán.
Trong một số trường hợp nhất định, các giá trị bình thường đối với nồng độ bicarbonate, PaCO2 và pH không phải không rối loạn acid-base. Sự gia tăng anion gap lớn hơn 5 mmol / lít có thể là dấu hiệu duy nhất cho rối loạn hỗn hợp .Bởi vì anion gap và nồng độ bicarbonate trước rối loạn acid- base thường không được biết, và phạm vi của các giá trị anion gap bình thường và nồng độ bicarbonate là rộng, các ∆AG – ∆ [HCO3−] vẫn là một xấp xỉ.
5. Xem xét Osmolal gap huyết thanh
Bước thứ năm trong việc đánh giá sự rối loạn acid-base là chú ý khoảng cách osmolal huyết thanh ở bất kỳ bệnh nhân nào có tình trạng nhiểm toan anion gap cao không giải thích được ,hôn mê hoặc nghi ngờ tiếp xúc chất độc và ở bệnh nhân nhập viện nguy cơ nhiễm độc propylen glycol (ví dụ, do dùng liều cao lorazepam ở những bệnh nhân dùng an thần trong ICU) .Phòng xét nghiệm xác nhận ngộ độc rượu ( toxic alcohol) thường không có sẵn, và các bác sĩ phải suy luận như vậy một chẩn đoán bằng cách xem xét các rối loạn có thể cần phải điều trị ngay lập tức. Khoảng cách osmolal là sự khác biệt giữa độ thẩm thấu huyết thanh đo được và độ thẩm thấu huyết thanh được tính toán. độ thẩm thấu huyết thanh được tính như sau:
2 × ([Na+] [mmol/l]) + (glucose [mg/dl]) ÷ 18 + (BUN [mg/dl]) ÷ 2.8.
Nếu có liên quan đến ethanol, kết quả của phép tính này sẽ được thêm vào lượng ethanol (tính bằng mg/dl) chia cho 3,7. Khoảng cách osmolal dưới 10 mOsm/kg được coi là bình thường, nhưng phạm vi bình thường trong dân số nói chung là lớn (−10 đến 10 mOsm/l)
* Chênh áp O2 phế nang- động mạch tăng theo tuổi . Cho mỗi thập kỷ một người đã sống, sự chênh áp về phế nang – động mạch dự kiến sẽ tăng thêm 2 mm Hg; có thể hiệu chỉnh theo công thức(alveolar–arterial O2 difference = [Age + 4]).
† Minor defects may result in a normal alveolar–arterial O2 difference.
Trong ngộ độc ethylene glycol và methanol, sự chênh lệch osmolal sẽ cao ngay sau khi uống, nhưng một lượng đáng kể acid sẽ không được tạo ra trong vài giờ. Các triệu chứng bị làm mờ đi đáng kể do uống ethanol đồng thời do cạnh tranh với rượu qua men dehydrogenase74-76
Việc sử dụng các khoảng cách osmolal có một số khuyết điểm. Giới hạn bình thường rộng trong dân số chung làm cho test không nhạy với nồng độ nhỏ có khả năng độc hại của ethylene glycol và methanol. Ngoài ra, khoảng cách osmolal thiếu đặc hiệu, cho rằng nó cũng có thể tăng nhẹ trong tình trạng lâm sàng khác như Toan acid lactic , ketoacidosis do rượu, and ketoacidosis do đái tháo đường.74
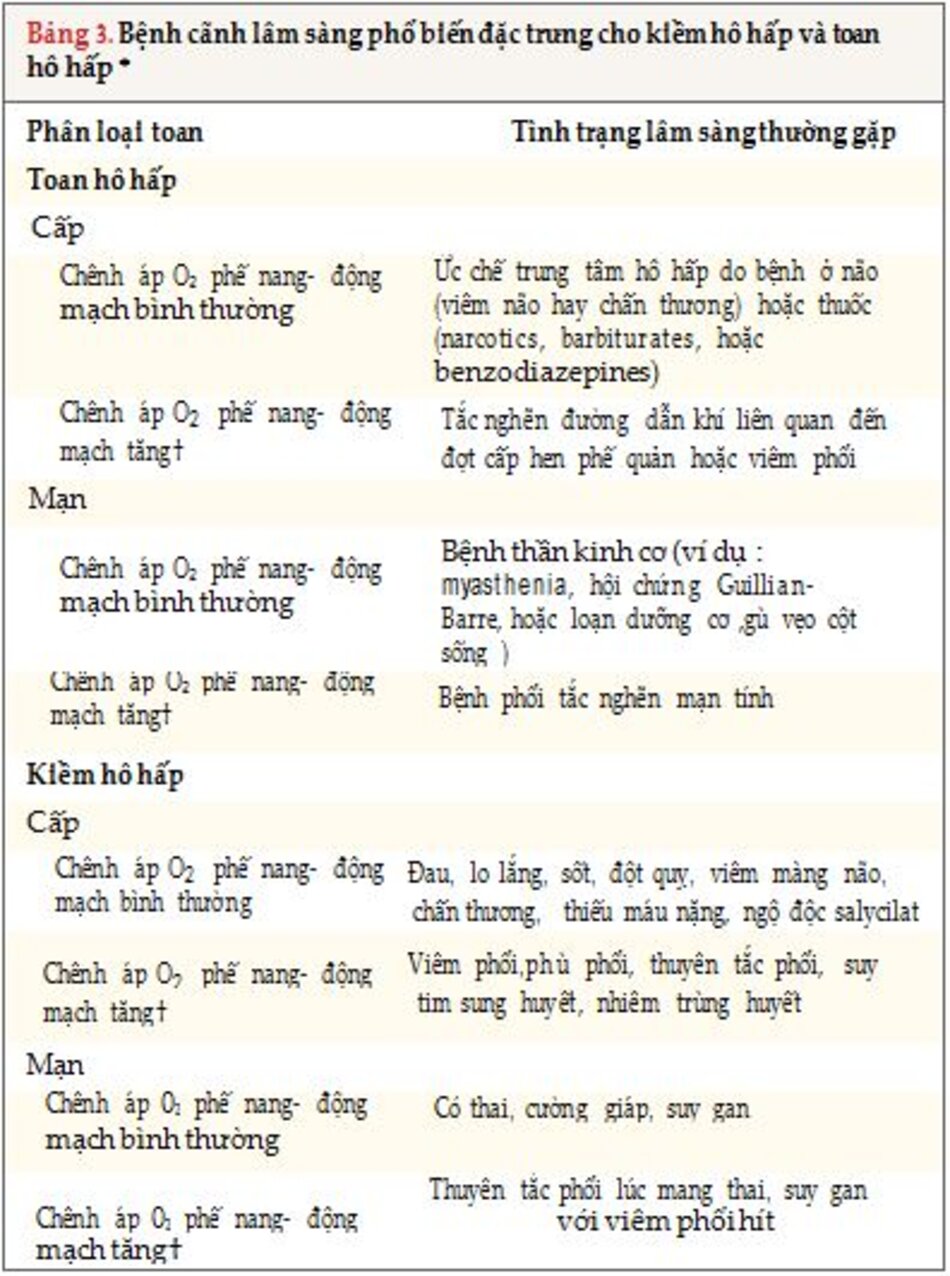
6. Đánh giá các thành phần rối loạn kiềm toan hô hấp
Đánh giá các thành phần rối loạn kiềm toan hô hấp bằng cách phân biệt các rối loạn cơ bản hô hấp cấp tính và mãn tính với việc sử dụng thông tin lâm sàng và tính toán (Bảng 1) và mức độ oxy hóa. Hạ oxy máu, nguyên nhân chính gây ra toan lactic, có thể gây ra kiềm hô hấp. Đánh giá áp suất riêng phần của oxy động mạch (PaO2) liên quan đến thông khí, với sự chênh áp oxy phế nang- động mạch (sau đây gọi là sự chênh về phế nang – động mạch) được tính đến, có thể phân biệt phổi với các bệnh ngoài phổi. Sự sự chênh áp oxy phế nang-động mạch của màng phế nang – mao mạch sẽ cao nếu bệnh nhân có bệnh phổi liên quan (Bảng 3) . PaO2 trong phế nang không bằng với tuần hoàn phổi là nguyên nhân gây ra giảm thông khí sinh lý xảy ra ở các phần khác nhau của phổi; do đó, sự khác biệt về phế nang – động mạch sẽ vào khoảng 5 đến 10 mm Hg ở những người trẻ khỏe mạnh và 15 đến 20 mm Hg ở những người già khỏe mạnh. Sự chênh áp oxy phế nang-động mạch tính như sau:
Fio2 × (barometric pressure – water-vapor pressure) – Pao2 – (Paco2 ÷ gas-exchange ratio).
Phần nhỏ của oxy hít vào (FIO2) là 0,21 trong không khí trời, áp suất khí quyển là 760 mm Hg ở mực nước biển, và áp lực hơi nước là 47 mm Hg ở 37 ° C. Tỷ lệ trao đổi khí, khoảng 0,8 ở mức trạng thái ổn định, thay đổi tùy theo việc sử dụng carbohydrate, protein và chất béo tương đối. Ở mực nước biển và nhiệt độ cơ thể 37 ° C, sự chênh áp về phế nang – động mạch có thể được ước tính như sau
Fio2 × (760 − 47) − Pao2 − (Paco2 ÷ 0.8) or 150 – Pao2 − 1.25 Paco2.
7. Giải thích rối loạn kiềm toan theo lâm sàng
Bước cuối cùng trong việc đánh giá các rối loạn acid-base là xác định nguyên nhân. Việc đánh giá kết quả từ phòng xét nghiệm phải phù hợp với tình trạng lâm sàng của bệnh nhân (xem box). Cách tiếp cận từng bước được mô tả ở đây có thể hữu ích trong việc đánh giá các rối loạn kiềm toan, nhưng luôn luôn nên kiểm tra các check thông tin khác để hỗ trợ chẩn đoán, chẳng hạn như khoảng cách lactate trong nhiễm độc ethylene glycol hoặc độ bão hòa oxy trong carbon monoxide, methemo-globinemia, hoặc nhiễm độc xianua.80
8. Tóm lại
Hiện tại, không có phương pháp lý tưởng nào để đánh giá sự rối loạn axit-bazơ. Hai phương pháp thực hành rộng rãi khác cũng có những hạn chế. Vật lý hóa học (ion hoặc Stewart22,57,81).
| 3 trường hợp lâm sàng |
| Bệnh nhân 1, người nữ 22 tuỗi chấn thương sau tai nạn, đã truyền 6 l dịch đẳng trương, sau đó nống độ Natri là 135 mmol/l, Kali là 3.8 mmol/l , Clorid 115mmol/l, và bicarbonat là 18mmol/l . Máu động mạch có pH : 7.28, và Paco2 : 39 mm Hg. Nồng độ natri niệu là 65 mmol /l, kali niệu 15 mmol /l, và clorid 110 mmol /l.
Bệnh nhân này có toan chuyển hóa với anio gap thấp (2 mmol /l), nhưng cô ấy có toan hô hấp do PaCO2 ươc đoán thấp hơn (1.5 × bicarbonate + 8±2 mm Hg = 35±2 mm Hg). Nếu những phát hiện này là kết quả của giãn thành ngực như gãy xương sườn , chênh áp O2 phế nang- động mạch có thể bình thường, giả sử không có bệnh phổi trước đó. . Phần lớn các bệnh nhân bị toan chuyển hóa anion gap bình thường có tiêu chảy và toan ống thận. Hàm lượng cao clo trong nước muối làm “bình thường hóa” anion gap vì sự giảm đồng thời mức độ bicarbonate. Anion gap thấp có lẽ là kết quả của mức albumin thấp vì chảy máu và pha loãng. Anion gap tiết niệu ([Na +] + [K +] – [Cl−]) là âm (−30 mmol / lít) do việc sử dụng nước muối. Nó có thể là dương tính ở bệnh nhân bị nhiễm toan ống thận loại 1 hoặc 4. Bệnh nhân 2, một phụ nữ 50 tuổi với khởi phát gần đây của tăng huyết áp,nồng độ natri là 150 mmol /l, kali 2,2 mmol /l, clorua 103 mmol /l, và bicarbonate 32 mmol /l. PH máu động mạch là 7,50, và PaCO2 là 43 mm Hg Bệnh nhân này tìm thấy có tăng tiết aldosteron do u tuyến tuyến thượng thận. Trong một bệnh nhân bị kiềm chuyển hóa và hạ kali máu, các bác sĩ lâm sàng nên luôn luôn loại trừ nôn ói và sử dụng thuốc lợi tiểu trước khi xem xét một vấn đề renin-aldosterone. Nôn ói dẫn đến mức clorua dưới 10 mmol / lít trong nước tiểu, trong khi khối u tiết ra aldosterone sẽ dẫn đến mức độ clorua niệu lớn hơn 40 mmol / lít.63 Ước đoán Paco2 sẽ là 40 + 0.7 × Δbicarbonate ions = 40 + Bệnh nhân 3, một người đàn ông 22 tuổi khỏe mạnh trước đó, đã khởi phát tiêu chảy lượng lớn nước vì nhiễm trùng đường tiêu hóa. Các xét nghiệm cho thấy nồng độ natri huyết tương là 140 mmol / lít, kali 3,0 mmol / lít, clorua 86 mmol / lít và bicarbonate 38 mmol / lít. PH máu động mạch là 7,60, và PaCO2 là 40 mm Hg. Bệnh nhân bị kiềm chuyển hóa. Mức độ pH và bicarbonate tăng lên, nhưng vì PaCO2 không tăng, bệnh nhân cũng nhiễm kiềm đường hô hấp, có lẽ do stress hoặc sốt. anion gap không hiệu chỉnh albumin là 16 mmol /lít; một giá trị cao hơn nhiều có thể là dấu hiệu của toan chuyển hóa phối hợp. Ngoài ra, kiềm chuyển hóa, đặc biệt là do nôn hoặc sử dụng thuốc lợi tiểu, có thể được kết hợp với sự gia tăng anion gap huyết thanh khoảng 4 đến 6 mmol /l vì sự gia tăng của nồng độ albumin và giải phóng proton . Kiềm chuyển hóa là kết quả của mất dịch đường tiêu hóa. |
phương pháp tiếp cận rất phức tạp và thường đòi hỏi một số tính toán không thể thực hiện giường bệnh. Nhiều bác sĩ nghĩ rằng nó không cung cấp chẩn đoán hoặc tiên lượng chẩn đoán và rằng số lượng lớn thông số được sử dụng trong các phép tính sẽ làm tăng cường độ biến thiên và sai số. Định lượng sự thay đổi trong tình trạng chuyển hóa acid-base trong cơ thể và thuận tiện được cung cấp bởi các máy khí máu.
Tuy nhiên, rối loạn “hỗn hợp” axit-base sẽ không được phát hiện bởi phương pháp đó nếu không sử dụng kiềm dư (BE). Vì vậy, theo quan điểm của chúng tôi, tiếp cận sinh lý, được xem xét ở đây, vẫn là cách tiếp cận đơn giản nhất, nghiêm ngặt nhất và dễ tiếp cận nhất để đánh giá các rối loạn acid-base.42
No potential conflict of interest relevant to this article was reported.
Disclosure forms provided by the authors are available with the full text of this article at NEJM.org.
9. references
1. Narins RG, Emmett M. Simple and mixed acid-base disorders: a practical approach. Medicine (Baltimore) 1980;59: 161-87.
2. Morris CG, Low J. Metabolic acidosis in the critically ill: part 1. Classification and pathophysiology. Anaesthesia 2008; 63:294-301.
3. Rennke HG, Denker BM. Renal patho- physiology, the essentials. 3rd ed. Phila- delphia: Lippincott Williams & Wilkins, 2010.
4. Guyton AC, Hall JE. Textbook of med- ical physiology. 11th ed. Philadelphia: Saunders Elsevier, 2006.
5. Palmer BF. Approach to fluid and electrolyte disorders and acid-base prob- lems. Prim Care 2008;35:195-213.
6. Henderson LJ. The theory of neutrali- ty regulation in the animal organism. Am J Physiol 1908;21:427-48.
7. Hasselbalch KA. The calculation of blood pH via the partition of carbon diox- ide in plasma and oxygen binding of the blood as a function of plasma pH. Bio- chem Z 1916;78:112-44.
8. Berend K. Bedside rule secondary re- sponse in metabolic acid-base disorders is unreliable. J Crit Care 2013;28:1103.
9. Reddy P, Mooradian AD. Clinical util- ity of anion gap in deciphering acid-base disorders. Int J Clin Pract 2009;63:1516-25.
10. Ghosh AK. Diagnosing acid-base dis- orders. J Assoc Physicians India 2006;54: 720-4.
11. Rowe KJ, Arrowsmith JE. Interpreta- tion of measurements of arterial blood gases. Surgery 2007;25:375-9.
12. Finkel KW, Dubose TF. Metabolic acidosis. In: Dubose T Jr, Hamm L, eds. Acid base and electrolyte disorders: a com- panion to Brenner & Rector’s The Kidney. Philadelphia: Saunders, 2002:55-66.
13. Martinu T, Menzies D, Dial S. Re- evaluation of acid-base prediction rules in patients with chronic respiratory acidosis. Can Respir J 2003;10:311-5.
14. Kellum JA. Determinants of plasma acid-base balance. Crit Care Clin 2005;21: 329-46.
15. Jones BJ, Twomey PJ. The anion gap revisited. Int J Clin Pract 2009;63:1409-12.
16. Dubin A, Menises MM, Masevicius FD, et al. Comparison of three different meth-ods of evaluation of metabolic acid-base disorders. Crit Care Med 2007;35:1264- 70.
17. Jones NL. Respiratory acidosis sans acidemia. Can Respir J 2003;10:301-3.
18. Krapf R, Beeler I, Hertner D, Hulter HN. Chronic respiratory alkalosis — the effect of sustained hyperventilation on renal regulation of acid-base equilibrium. N Engl J Med 1991;324:1394-401.
19. Ayers P, Warrington L. Diagnosis and treatment of simple acid-base disorders. Nutr Clin Pract 2008;23:122-7.
20. Kellum JA, Murugan R. Anion gap and strong ion gap. In: Ronco C, Bellomo R, Kellum JA, eds. Critical care nephrolo- gy. Philadelphia: Elsevier, 2009:611-4.
21. Berend K. Acid-base pathophysiology after 130 years: confusing, irrational and controversial. J Nephrol 2013;26:254-65.
22. Fidkowski C, Helstrom J. Diagnosing metabolic acidosis in the critically ill: bridging the anion gap, Stewart, and base excess methods. Can J Anaesth 2009;56: 247-56.
23. Lolekha PH, Vanavanan S, Lolekha S. Update on value of the anion gap in clini- cal diagnosis and laboratory evaluation. Clin Chim Acta 2001;307:33-6.
24. Ucgun I, Oztuna F, Dagli CE, Yildirim H, Bal C. Relationship of metabolic alka- losis, azotemia and morbidity in patients with chronic obstructive pulmonary dis- ease and hypercapnia. Respiration 2008; 76:270-4.
25. Otani N, Ohde S, Mochizuki T, Ishi- matsu S. Reliability of anion gap calculat- ed from data obtained using a blood gas analyzer: is the probability of error predict- able? Am J Emerg Med 2010;28:577-81.
26. Nguyen BV, Vincent JL, Hamm JB, et al. The reproducibility of Stewart parameters for acid-base diagnosis using two central laboratory analyzers. Anesth Analg 2009; 109:1517-23.
27. Sarrazin F, Tessler MJ, Kardash K, McNamara E, Holcroft C. Blood gas mea- surements using the Bayer Rapid Point 405: are we basing our decisions on ac- curate data? J Clin Monit Comput 2007;21: 253-6.
28. Crapo RO, Jensen RL, Hegewald M, Tashkin DP. Arterial blood gas reference values for sea level and an altitude of 1,400 meters. Am J Respir Crit Care Med 1999;160:1525-31.
29. Funk GC, Doberer D, Kneidinger N, Lindner G, Holzinger U, Schneeweiss B. Acid-base disturbances in critically ill patients with cirrhosis. Liver Int 2007;27: 901-9.
30. Zavorsky GS, Lands LC, Schneider W, Carli F. Comparison of fingertip to arte- rial blood samples at rest and during exer- cise. Clin J Sport Med 2005;15:263-70.
31. Emmet M. Diagnosis of simple and mixed disorders. In: Dubose T Jr, Hamm L, eds. Acid base and electrolyte disorders: a companion to Brenner & Rector’s The Kidney. Philadelphia: Saunders, 2002:41-53.
32. Duewall JL, Fenves AZ, Richey DS, Tran LD, Emmett M. 5-Oxoproline (pyro- glutamic) acidosis associated with chron- ic acetaminophen use. Proc (Bayl Univ Med Cent) 2010;23:19-20.
33. Kraut JA, Madias NE. Serum anion gap: its uses and limitations in clinical medicine. Clin J Am Soc Nephrol 2007;2: 162-74.
34. Maciel AT, Park M. Differences in acid- base behavior between intensive care unit survivors and nonsurvivors using both a physicochemical and a standard base ex- cess approach: a prospective, observa- tional study. J Crit Care 2009;24:477-83.
35. Feldman M, Soni N, Dickson B. Influ- ence of hypoalbuminemia or hyperalbu- minemia on the serum anion gap. J Lab Clin Med 2005;146:317-20.
36. Moe OW, Fuster D. Clinical acid-base pathophysiology: disorders of plasma an- ion gap. Best Pract Res Clin Endocrinol Metab 2003;17:559-74.
37. Kellum JA. Making strong ion differ- ence the “Euro” for bedside acid-base analysis. In: Vincent JL, ed. Yearbook of intensive care and emergency medicine. Berlin: Springer-Verlag, 2005:675-85.
38. Hatherill M, Waggie Z, Purves L, Reynolds L, Argent A. Correction of the anion gap for albumin in order to detect occult tissue anions in shock. Arch Dis Child 2002;87:526-9.
39. Chawla LS, Shih S, Davison D, Junker C, Seneff MG. Anion gap, anion gap cor- rected for albumin, base deficit and un- measured anions in critically ill patients: implications on the assessment of meta-1444n engl j med 371;15 nejm.org october 9, 2014 Triệu Ngân CTUMP Physiological Assessment of Acid–Base Disturbances bolic acidosis and the diagnosis of hyper- lactatemia. BMC Emerg Med 2008;8:18.
40. Berkman M, Ufberg J, Nathanson LA, Shapiro NI. Anion gap as a screening tool for elevated lactate in patients with an increased risk of developing sepsis in the Emergency Department. J Emerg Med 2009;36:391-4.
41. Mirza N, Marson AG, Pirmohamed M. Effect of topiramate on acid-base balance: extent, mechanism and effects. Br J Clin Pharmacol 2009;68:655-61.
42. Adrogué HJ, Gennari FJ, Galla JH, Madias NE. Assessing acid-base disorders. Kidney Int 2009;76:1239-47.
43. Farwell WR, Taylor EN. Serum anion gap, bicarbonate and biomarkers of in- flammation in healthy individuals in a national survey. CMAJ 2010;182:137-41.
44. Gunnerson KJ, Saul M, He S, Kellum JA. Lactate versus non-lactate metabolic acidosis: a retrospective outcome evalua- tion of critically ill patients. Crit Care 2006;10:R22.
45. Lolekha PH, Vanavanan S, Teerakarn- jana N, Chaichanajarernkul U. Reference ranges of electrolyte and anion gap on the Beckman E4A, Beckman Synchron CX5, Nova CRT, and Nova Stat Profile Ultra. Clin Chim Acta 2001;307:87-93.
46. Mehta AN, Emmett JB, Emmett M. GOLD MARK: an anion gap mnemonic for the 21st century. Lancet 2008;372:892.
47. Handy J. Lactate — the bad boy of me- tabolism, or simply misunderstood? Curr Anaesth Crit Care 2006;17:71-6.
48. Leverve XM. Lactate in the intensive care unit: pyromaniac, sentinel or fire- man? Crit Care 2005;9:622-3.
49. Chang YM, Chiew YW, Yang CS. The case mid R: a woman with severe meta- bolic acidosis. Kidney Int 2010;77:261-2.
50. Noritomi DT, Soriano FG, Kellum JA, et al. Metabolic acidosis in patients with severe sepsis and septic shock: a longitu- dinal quantitative study. Crit Care Med 2009;37:2733-9.
51. Hassan H, Joh JH, Bacon BR, Bastani
B. Evaluation of serum anion gap in pa- tients with liver cirrhosis of diverse etiol- ogies. Mt Sinai J Med 2004;71:281-4.
52. Funk GC, Doberer D, Osterreicher C, Peck-Radosavljevic M, Schmid M, Schnee- weiss B. Equilibrium of acidifying and alkalinizing metabolic acid-base disorders in cirrhosis. Liver Int 2005;25:505-12.
53. Ahya SN, José Soler M, Levitsky J, Batlle D. Acid-base and potassium disor- ders in liver disease. Semin Nephrol 2006; 26:466-70.
54. Mansoor S, Siddiqui I, Adil S, NabiKakepoto G, Fatmi Z, Ghani F. Anion gap among patients of multiple myeloma and normal individuals. Clin Biochem 2007; 40:226-9.
55. Durward A, Skellett S, Mayer A, Taylor D, Tibby SM, Murdoch IA. The value of the chloride: sodium ratio in differentiat- ing the aetiology of metabolic acidosis. Intensive Care Med 2001;27:828-35.
56. Katzir Z, Dinour D, Reznik-Wolf H, Nissenkorn A, Holtzman E. Familial pure proximal renal tubular acidosis — a clini- cal and genetic study. Nephrol Dial Trans- plant 2008;23:1211-5.
57. Corey HE, Vallo A, Rodríguez-Soriano J. An analysis of renal tubular acidosis by the Stewart method. Pediatr Nephrol 2006; 21:206-11.
58. Bull SV, Douglas IS, Foster M, Albert RK. Mandatory protocol for treating adult patients with diabetic ketoacidosis de- creases intensive care unit and hospital lengths of stay: results of a nonrandom- ized trial. Crit Care Med 2007;35:41-6.
59. Corey HE. The anion gap (AG): stud- ies in the nephrotic syndrome and dia- betic ketoacidosis (DKA). J Lab Clin Med 2006;147:121-5.
60. Mrozik LT, Yung M. Hyperchloraemic metabolic acidosis slows recovery in chil- dren with diabetic ketoacidosis: a retro- spective audit. Aust Crit Care 2009;22: 172-7.
61. Taylor D, Durward A, Tibby SM, et al. The influence of hyperchloraemia on acid base interpretation in diabetic ketoacido- sis. Intensive Care Med 2006;32:295-301.
62. Story DA, Morimatsu H, Bellomo R. Hyperchloremic acidosis in the critically ill: one of the strong-ion acidoses? Anesth Analg 2006;103:144-8.
63. Berend K, van Hulsteijn LH, Gans RO. Chloride: the queen of electrolytes? Eur J Intern Med 2012;23:203-11.
64. Handy JM, Soni N. Physiological ef- fects of hyperchloraemia and acidosis. Br J Anaesth 2008;101:141-50.
65. Gennari FJ, Weise WJ. Acid-base dis- turbances in gastrointestinal disease. Clin J Am Soc Nephrol 2008;3:1861-8.
66. Gattinoni L, Carlesso E, Maiocchi G, Polli F, Cadringher P. Dilutional acidosis: where do the protons come from? Inten- sive Care Med 2009;35:2033-43.
67. Rodríguez Soriano J. Renal tubular acidosis: the clinical entity. J Am Soc Nephrol 2002;13:2160-70.
68. Laski ME, Sabatini S. Metabolic alka- losis, bedside and bench. Semin Nephrol 2006;26:404-21.
69. Heffner AC, Murugan R, Madden N,Kellum JA. Diagnosis and therapy of met- abolic alkalosis. In: Ronco C, Bellomo R, Kellum JA, eds. Critical care nephrology, Philadelphia: Elsevier, 2009:621-4.
70. Adrogué HJ. Mixed acid-base distur- bances. J Nephrol 2006;19:Suppl 9:S97- S103.
71. Rastegar A. Use of the DeltaAG/Del- taHCO3- ratio in the diagnosis of mixed acid-base disorders. J Am Soc Nephrol 2007;18:2429-31.
72. Kraut JA, Kurtz I. Toxic alcohol inges- tions: clinical features, diagnosis, and management. Clin J Am Soc Nephrol 2008; 3:208-25.
73. Whittington JE, La’ulu SL, Hunsaker JJ, Roberts WL. The osmolal gap: what has changed? Clin Chem 2010;56:1353-5. 74. Lynd LD, Richardson KJ, Purssell RA, et al. An evaluation of the osmole gap as a screening test for toxic alcohol poisoning. BMC Emerg Med 2008;8:5.
75. Jammalamadaka D, Raissi S. Ethylene glycol, methanol and isopropyl alcohol in- toxication. Am J Med Sci 2010;339:276-81.
76. Horinek EL, Kiser TH, Fish DN, Mac- Laren R. Propylene glycol accumulation in critically ill patients receiving continuous intravenous lorazepam infusions. Ann Pharmacother 2009;43:1964-71.
77. Moammar MQ, Azam HM, Blamoun AI, et al. Alveolar-arterial oxygen gradi- ent, pneumonia severity index and out- comes in patients hospitalized with com- munity acquired pneumonia. Clin Exp Pharmacol Physiol 2008;35:1032-7.
78. Jones JS, VanDeelen N, White L, Dougherty J. Alveolar–arterial oxygen gradients in elderly patients with suspect- ed pulmonary embolism. Ann Emerg Med 1993;22:1177-81.
79. Meng QH, Adeli K, Zello GA, Porter WH, Krahn J. Elevated lactate in ethylene glycol poisoning: true or false? Clin Chim Acta 2010;411:601-4.
80. Mokhlesi B, Leiken JB, Murray P, Cor- bridge TC. Adult toxicology in critical care: part I: general approach to the in- toxicated patient. Chest 2003;123:577-92.
81. Kurtz I, Kraut J, Ornekian V, Nguyen MK. Acid-base analysis: a critique of the Stewart and bicarbonate-centered ap- proaches. Am J Physiol Renal Physiol 2008;294:F1009-F1031.
82. Tuhay G, Pein MC, Masevicius FD, Kutscherauer DO, Dubin A. Severe hyper- lactatemia with normal base excess: a quantitative analysis using conventional and Stewart approaches. Crit Care 2008; 12:R66.