Tổng quan về các nhóm thuốc lợi tiểu đang ứng dụng trong lâm sàng
Hiện nay có rất nhiều bệnh như suy thận cấp, phù phổi, tràn dịch các màng cần dùng đến các thuốc thuộc nhóm thuốc lợi tiểu. Tuy nhiên trên thị trường lại có rất ít thông tin liên quan đến nhóm thuốc lợi tiểu, bài này Healcentral.org xin được giới thiệu tới các bạn các thông tin như: Thuốc lợi tiểu gồm mấy nhóm? Cơ chế tác dụng của từng nhóm, những vấn đề cần lưu ý khi sử dụng thuốc lợi tiểu. Dưới đây là thông tin chi tiết.
Lịch sử nghiên cứu và phát triển
Thuốc lợi tiểu là một nhóm thuốc rất lớn và được ứng dụng rất nhiều trên lâm sàng cho nhiều chỉ định khác nhau, trong đó những chỉ định phổ biến nhất của thuốc đều liên quan đến tác dụng lợi tiểu, làm giảm thể tích tuần hoàn, giảm huyết áp. Bài viết này sẽ trình bày các nhóm lợi tiểu thường được sử dụng trên lâm sàng:
Lợi tiểu giảm kali huyết:
- Lợi tiểu ức chế men CA (carbonic anhydrase): acetazolamid, methazolamid…
- Lợi tiểu quai: furosemide, bumetanid…
- Lợi tiểu thiazid: hydrochlorothiazid, indapamid…
Lợi tiểu giữ kali huyết:
- Lợi tiểu kháng aldosterone: spironolacton…
- Dẫn chất pteridin và amiprazimid: triamteren và amilorid.
Lợi tiểu khác: Lợi tiểu thẩm thấu mannitol, sorbitol…
Trong những năm thuộc thế kỉ XIX, người ta thấy rằng phù (phù chi, cổ chướng, tràn dịch màng phổi) không phải là một bệnh mà là một triệu chứng trong suy tim, suy gan, suy thận. Trong khoảng 2000 năm, các phương pháp điều trị đều dựa trên làm mất chất lỏng trong cơ thể như dùng thuốc tẩy, gây chảy máu, đổ mồ hôi và một số cách khác.
Heberden (1710-1801) có miêu tả cổ chướng, nhưng không thể tìm ra thuốc điều trị hiệu quả nào. Robert Bentley Todd (Luân Đôn, 1809-1860) đề cập đến kĩ thuật chích chân ở nhiều điểm khác nhau. Các ống của Southey (Reginald Southey, 1835-1899) đã phát triển kĩ thuật này, các ống bạc chọc vào chân bị phù tại nhiều điểm cho phép dịch chảy ra ngoài và giảm phù. Các lỗ còn lại sau khi chọc thường bị nhiễm trùng. Việc sử dụng các ống này còn tiếp tục cho đến những năm 1960.
Một bác sĩ người Đức – Thụy Sĩ (1493-1521) đã miêu tả các hợp chất chứa thủy ngân vô cơ có đặc tính lợi tiểu năm 1520. Ông đã sử dụng calomel, hay Hg2Cl2. Nó đặc tính nhuận tràng nhiều hơn là lợi tiểu, và có độc tính cao. Tuy nhiên trong những năm từ 1700-1800, nó vẫn là phương pháp điều trị tiêu chuẩn, kết hợp với các chất chiết xuất từ thực vật có tính nhuận tràng, và digitalis (sau khám phá của Withering năm 1775). Calomel là loại thuốc thường được sử dụng cho William Cullen (Edinburgh) và học trò của ông là Benjamin Rush (Philadelphia).
Các hợp chất thủy ngân hữu cơ đã được sử dụng để điều trị bệnh giang mai và các bệnh nhiễm trùng khác vào cuối những năm 1800. Alfred Vogl, khi còn là sinh viên y khoa ở Vienna năm 1919, đã quan sát một bệnh nhân bị suy tim khi điều trị bằng Novasurol có tác dụng lợi tiểu. Đây chỉ là thuốc có tác dụng lợi tiểu yếu theo tiêu chuẩn hiện nay, nhưng các công ty dược phẩm ngay lập tức tìm cách phát triển các dẫn chất ít độc hơn. Một vài trong số đó, ví dụ như Mersalyl (1924), đã được sử dụng trong nhiều thập kỷ.
Mặc dù đã có 40 năm quan sát hỗ trợ nhưng vai trò trung tâm của việc giảm muối chỉ được chấp nhận hoàn toàn sau khi Henry Schroeder cho thấy sự giảm phù nề vào những năm 1941-1942 bằng cách hạn chế lượng muối xuống dưới 1g/ngày ở bệnh nhân suy tim. Điều này đã được củng cố bằng các chứng minh cho thấy rằng huyết áp cao có thể hạ xuống bằng cách hạn chế muối tối đa. Nhựa trao đổi cation (Na+) đường uống chỉ có tác dụng tạm thời. Các công ty dược phẩm thì nỗ lực phát triển các loại thuốc gây mất muối qua thận.
Năm 1937, người ta đã thấy rằng thuốc kháng sinh mới sulfanilimide gây ra nhiễm toan chuyển hóa thông qua ức chế carbonic anhydrase ở thận và nó gây ra lợi tiểu ở những bệnh nhân kháng các hợp chất thủy ngân. Acetazolamide sau đó được giới thiệu vào năm 1954 có tác dụng mạnh hơn.
Thuốc lợi tiểu thiazid ra đời năm 1958. Các thử nghiệm huyết áp ngẫu nhiên đã báo cáo lợi ích điều trị thực tế của các thuốc này.
Việc tìm kiếm các hợp chất mạnh hơn vào những năm 1950 đã dẫn đến việc khám phá ra acid ethacrynic và sau đó là furosemid (1959). Furosemid được sử dụng trên lâm sàng từ năm 1964.
Tất cả các thuốc lợi tiểu mới đều gây mất kali huyết, do đó đã có một cuộc tìm kiếm các tác nhân mới để khắc phục điều đó. Spironolacton (1961), triamteren (1964) và theo sau đó là amilorid (1968) lần lượt ra đời.
Dược lực học
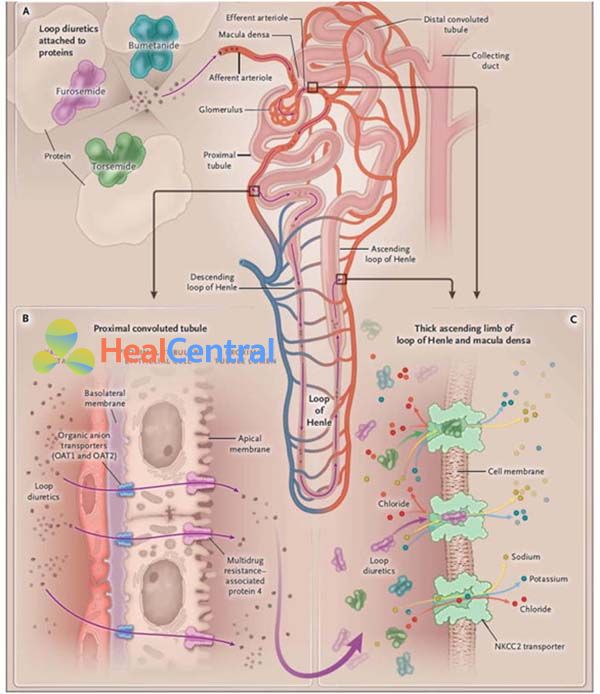
Một đơn vị chức năng của thận được gọi là nephron. Mỗi nephron bao gồm 3 phần đó là bọc Bowman, ống lượn gần, quai Henle và ống lượn xa. Hầu hết các thuốc lợi tiểu thường dùng trên lâm sàng đều tác động lên quá trình tái hấp thu muối (natri) và nước ở các vị trí khác nhau trên ống thận.
Lợi tiểu ức chế men CA:
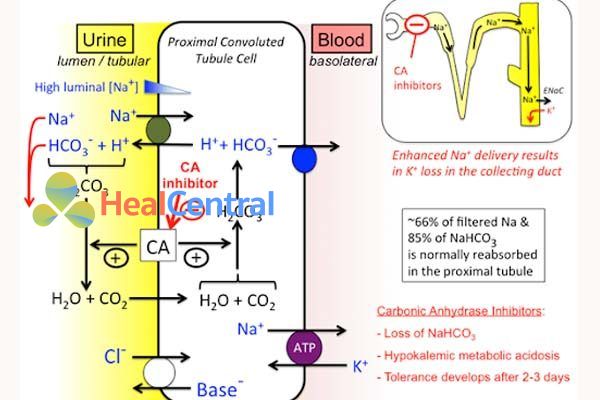
Vị trí tác động của lợi tiểu ức chế men CA là ống lượn gần. Cụ thể nó tác động lên quá trình tái hấp thu Na+ và HCO3- ở ống lượn gần bằng cách ức chế men CA. Đây là một enzym có tác dụng xúc tác phản ứng thuận nghịch chuyển H2CO3 thành CO2 + H2O và ngược lại. Cơ chế cụ thể được thể hiện trên hình.
Trong sinh lý bình thường, tế bào biểu mô ống lượn gần trao đổi lấy 1 ion Na+ trong lòng ống và thải ra lòng ống 1 ion H+. H+ sẽ kết hợp với HCO3- trong lòng ống tạo thành H2CO3 sau đó thành CO2 + H2O nhờ men CA xúc tác. CO2 sau đó khuếch tán thụ động qua màng tế bào biểu mô ống lượn gần và trong tế bào, lại nhờ CA xúc tác, CO2 kết hợp với H2O thành H2CO3 rồi phân ly thành H+ và HCO3-. HCO3- được vận chuyển vào mạch máu còn H+ lại được trao đổi với Na+ bên ngoài tạo thành một chu trình khép kín. Như vậy cơ thể sẽ tái hấp thu được Na+, HCO3- và đào thải được H+.
Khi men CA bị ức chế do thuốc, chu trình này bị cắt đứt và cơ thể không tái hấp thu được Na+, dẫn đến mất Na+ và kéo theo là mất nước, gây tác dụng lợi tiểu. Tuy nhiên do HCO3- cũng không được tái hấp thu và H+ không được đào thải nên nó gây ra nguy cơ nhiễm toan chuyển hóa. Đồng thời H+ không thải được nên nó sinh cơ chế thải K+ bù trừ (do sự bài xuất H+ và K+ có cạnh tranh nhau) gây nguy cơ hạ K+ huyết do mất K+. Và do không thải được H+ nên NH3 không thể chuyển thành NH4+, gây tăng NH3 huyết. Thuốc có tác dụng lợi tiểu yếu.
Trên mắt và thần kinh trung ương cũng có men CA, ức chế men này tại đây giúp sản xuất dịch não tủy và giảm tiết thủy dịch.
Lợi tiểu quai
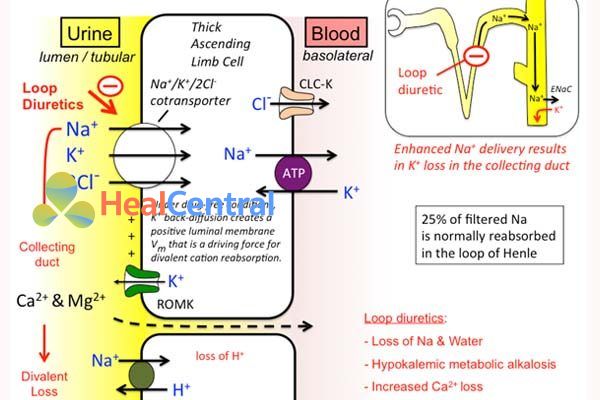
Vị trí tác động của lợi tiểu quai là nhánh lên quai Henle. Nó tác động lên quá trình tái hấp thu Na+, K+ và Cl-. Cụ thể thuốc ức chế cơ chế đồng vận chuyển Na+/ K+/2Cl-, dẫn đến các ion này không được tái hấp thu và kéo theo nước gây lợi tiểu.
Thuốc cũng gây giãn mạch thận, tăng lưu lượng máu đến thận và mức lọc cầu thận, tái phân phối máu cho các vùng sâu trong vỏ thận, tác dụng kháng ADH tại ống lượn xa.
Thuốc làm giãn tĩnh mạch, giảm ứ máu phổi, giảm áp suất thất trái.
Trong sinh lý bình thường, khi hệ đồng vận chuyển làm việc bình thường thì ion K+ đi vào tế bào để tạo ra chênh lệch nồng độ ion K+ hai bên màng tế bào. Nồng độ K+ trong tế bào cao sẽ hoạt hóa kênh K+ phía dưới mở để K+ thoát ra và tạo điều kiện cho tái hấp thu Ca2+ và Mg2+. Khi hệ đồng vận chuyển bị ức chế, chênh lệch nồng độ K+ không đủ lớn (do không có K+ đi vào tế bào) nên kênh K+ phía dưới không mở, Ca2+ và Mg2+ không được tái hấp thu dẫn đến tăng đào thải (ngược với lợi tiểu thiazid), làm hạ Ca2+ và Mg2+ huyết.
Cl- không được tái hấp thu nên tái hấp thu HCO3- thay thế và tăng thải H+ để tái hấp thu bù Na+ nên gây nhiễm kiềm chuyển hóa.
Lợi tiểu quai là lợi tiểu có tác dụng mạnh nhất trên lâm sàng.
Lợi tiểu thiazide
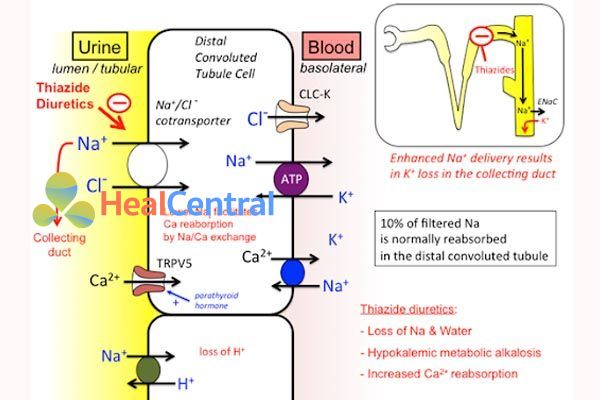
Vị trí tác động của lợi tiểu thiazid là đoạn đầu ống lượn xa. Thuốc tác động lên cơ chế đồng vận chuyển Na+/Cl- làm cả 2 ion này không được tái hấp thu, nên thuốc này còn được gọi là thuốc thải trừ muối.
Liều cao thuốc ức chế men CA nhưng yếu hơn acetazolamid.
Thuốc tăng thải trừ K+ do ức chế men CA (cơ chế giống lợi tiểu ức chế men CA: do H+ giảm thải trừ nên K+ tăng thải trừ do hai ion này cạnh tranh nhau bài xuất) và do ức chế tái hấp thu Na+ nên sinh cơ chế tăng thải K+ để tái hấp thu bù trừ Na+.
Thuốc không tác động đến thải trừ HCO3- nên không gây nhiễm toan chuyển hóa nhưng lại làm tế bào tăng thải H+ để tái hấp thu Na+ bù trừ nên có thể gây nhiễm kiềm chuyển hóa.
Thuốc lợi tiểu thiazid có tác dụng lợi tiểu trung bình. Thuốc ít gây rối loạn thành phần dịch ngoại bào hơn các lợi tiểu khác.
Thuốc làm tăng tái hấp thu Ca2+ nên làm giảm Ca2+ niệu, tăng thải trừ Mg2+ nên làm giảm Mg2+ huyết.
Thuốc ức chế tác dụng tại chỗ của các chất co mạch ADH và noradrenalin nên gây giãn mạch, là cơ chế thứ hai gây hạ huyết áp (sau cơ chế làm giảm thể tích tuần hoàn).
Lợi tiểu kháng aldosterone
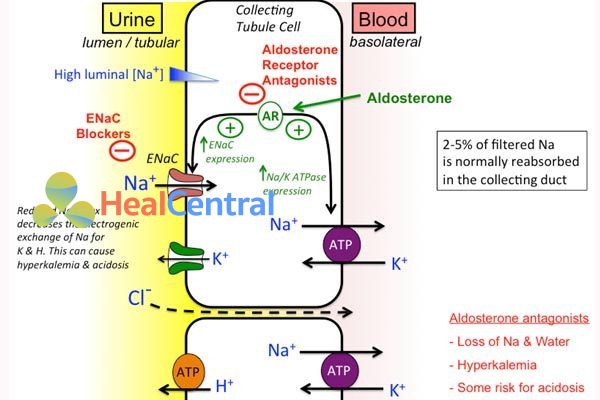
Vị trí tác động của lợi tiểu kháng aldosteron là đoạn sau ống lượn xa. Trong sinh lý bình thường, aldosteron sẽ liên kết với aldosteron receptor (AR) để hoạt hóa kênh Na+ (hoạt hóa gián tiếp thông qua tăng biểu hiện gen) làm tăng tái hấp thu Na+ và đồng thời kênh K+ và H+ mở ra làm tăng đào thải K+ và H+.
Lợi tiểu kháng aldosteron có cấu trúc tương tự aldosteron nên cạnh tranh gắn với AR, làm mất tác dụng của aldosteron. Do đó thuốc làm giảm tái hấp thu Na+, kéo theo là tăng thải nước và đồng thời giữ lại K+ và H+. Điều nãy dẫn đến nguy cơ tăng K+ huyết và nhiễm toan chuyển hóa.
Đây là nhóm thuốc có tác dụng lợi tiểu yếu.
Triamteren và amilorid
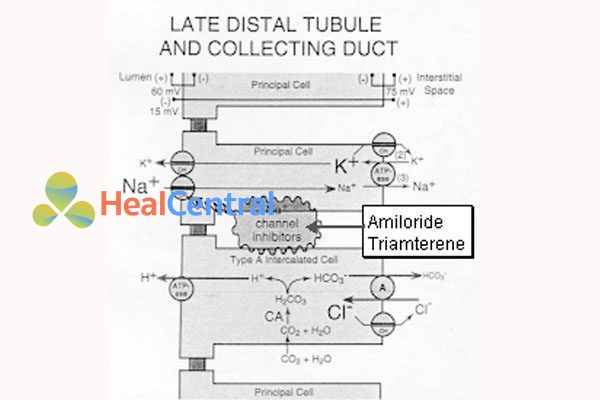
Vị trí tác động là đoạn cuối ống lượn xa và đoạn đầu ống góp. Triamteren và amilorid ức chế trực tiếp kênh Na+ làm ion này không vào được tế bào, dẫn đến K+ và H+ cũng không được đào thải (tác động khá tương đồng với lợi tiểu kháng aldosteron chỉ khác cơ chế phân tử). Thuốc gây tăng kali huyết và nhiễm toan chuyển hóa.
Đây là nhóm thuốc có tác dụng lợi tiểu yếu.
Lợi tiểu thẩm thấu
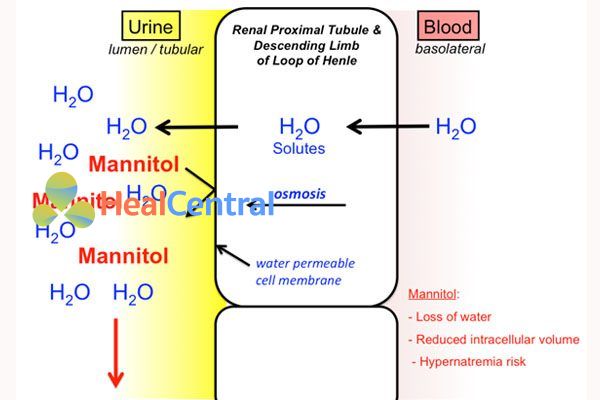
Các thuốc này được lọc tự do qua cầu thận, khó hấp thu qua ống thận (do kích thước phân tử lớn), dẫn đến tăng áp lực thẩm thấu trong lòng ống thận, kéo nước vào trong lòng ống thận gây lợi tiểu.
Thuốc cũng làm giảm áp lực nội sọ trong tăng áp lực nội sọ.
Một số thử nghiệm lâm sàng
Một nghiên cứu chéo, nhãn mở, ngẫu nhiên nghiên cứu tác dụng hạ huyết áp của furosemid và hydrochlorothiazid trên bệnh nhân da đen bị tăng huyết áp từ nhẹ đến trung bình. Hydrochlorothiazid làm giảm đáng kể huyết áp động mạch trung bình (24.7 vs 16.0 mmHg, P < 0.01) và huyết áp tâm trương (17.3 vs 10.1 mmHg, P < 0.01) trên 16 bệnh nhân. Bổ sung methyldopa ở 9 bệnh nhân làm giảm đáng kể huyết áp động mạch trung bình (38.8 vs 31.9 mmHg, P < 0.05) và huyết áp tâm trương (28.9 vs 23.4 mmHg, P < 0.05) với hydrochlorothiazid vs furosemid. Tình trạng renin được phân loại trước và sau khi điều trị. Bệnh nhân có hoạt tính renin thấp và bình thường đều đáp ứng như nhau với cả hai thuốc lợi tiểu. Hydrochlorothiazid gây ra sự giảm kali huyết tương nhiều hơn (0,26 mEq/L). Nồng độ hormon cận giáp (PTH) huyết thanh không tăng cao mạn tính với furosemid.
Trong nghiên cứu này, hydrochlorothiazid có hiệu quả hơn furosemide trong điều trị tăng huyết áp nhẹ đến trung bình ở bệnh nhân da đen. Phân loại mức renin không dự đoán được đáp ứng lợi tiểu.
Trong năm 2010, một phân tích tổng hợp trên 137 thử nghiệm đối chứng ngẫu nhiên (RCTs) (N = 5843) đã kiểm tra hiệu quả của chlorthalidon và hydrochlorothiazid (HCTZ) đơn trị liệu đối với tăng huyết áp. Tổng cộng có 29 thử nghiệm về chlorthalidon (N = 2995; khoảng liều từ 12.5 đến 200 mg, trung bình 25 mg) và 108 thử nghiệm về HCTZ (N = 2848; khoảng liều từ 3 đến 450 mg, trung bình 33 mg) được phân tích dựa trên liều dùng và thời gian nghiên cứu (tất cả dưới một năm). Khi tất cả thời gian nghiên cứu được gộp lại, 12.5-25 mg chlorthalidon làm giảm huyết áp tâm thu lớn hơn so với HCTZ (−24 mmHg vs −14 mmHg, P < 0.05). Trong các nghiên cứu từ 12 đến 52 tuần, sử dụng chlorthalidon dẫn đến giảm nồng độ kali huyết thanh (-0.40 mEq/L [−0.40 mmol/L] vs -0.24 mEq/L [−0.24 mmol/L], P = 0.008). HCTZ và chlorthalidone không được so sánh trực tiếp trong các RCTs này.
Một phân tích tổng hợp trên 9 RCTs (N = 78,350) đã kiểm tra mức độ giảm các biến cố tim mạch ở bệnh nhân dùng chlorthalidon (6 thử nghiệm, N = 59,976; khoảng liều từ 12.5 đến 100 mg) và HCTZ (3 thử nghiệm, N = 18,374; khoảng liều từ 12.5 đến 50 mg). Biến cố tim mạch được xác định là nhồi máu cơ tim hoặc chẩn đoán mới về bệnh mạch vành, đột quỵ hoặc suy tim sung huyết. Khi so sánh những bệnh nhân có sự giảm như nhau về huyết áp tâm thu, nguy cơ biến cố tim mạch ở những bệnh nhân dùng chlorthalidon thấp hơn so với những người dùng HCTZ (tỷ lệ rủi ro [RR] = 0.82; khoảng tin cậy 95%, 0.70 đến 0.97). Tuy nhiên, không có so sánh trực tiếp giữa chlorthalidon và HCTZ trong các thử nghiệm này.
Dược động học
Lợi tiểu ức chế men CA
Hấp thu: Acetazolamid hấp thu tốt qua đường uống. Thời gian khởi phát tác dụng 1-1.5 giờ. Thời gian tác dụng 8-12 giờ. Thời gian đạt nồng độ đỉnh trong huyết tương (Tmax) 1-4 giờ (Các chỉ số này áp dụng cho viên nén dùng đường uống). Methazolamid hấp thu chậm hơn acetazolamid. Methazolamid khởi phát tác dụng sau 2-4 giờ, tác dụng cực đại sau 6-8 giờ và tác dụng kéo dài trong 10-18 giờ.
Phân bố: Acetazolamid liên kết protein huyết tương khá cao (70-90%). Thể tích phân bố của nó (Vd) là 0.2 L/kg. Methazolamid liên kết protein huyết tương 55%, Vd từ 17 đến 23 L.
Chuyển hóa: Acetazolamid không có chuyển hóa. Methazolamid không rõ.
Thải trừ: Acetazolamid có thời gian bán thải (t1/2) 2-4 giờ (viên nén dùng dường uống) và bài xuất chủ yếu qua nước tiểu (90%). Methazolamid có thời gian bán thải 14 giờ và bài xuất qua nước tiểu chỉ 15%.
Lợi tiểu quai
Hấp thu: Hấp thu tốt qua đường tiêu hóa. Sinh khả dụng (F) thay đổi. Furosemid có sinh khả dụng đường uống 47-64%, bumetanid khoảng 59-89%. Tác dụng xuất hiện nhanh: 3-5 phút (furodemid IV), 30 phút (furosemid IM), 30-60 phút (furosemid PO), 2-3 phút (bumetanid IV), 30-60 phút (bumetanid PO/IM). Thời gian đạt nồng độ đỉnh trong huyết tương (Tmax) của furosemid và bumetanid là 1-2 giờ (sau uống). Thời gian tác dụng furosemid 6-8 giờ (PO) và bumetanid 4-6 giờ.
Phân bố: Các thuốc liên kết nhiều với protein huyết tương (> 90%). Furosemid có thể tích phân bố (Vd) là 0.2 L/kg. Bumetanid có thể tích phân bố (Vd) là 9-25 L ở người trưởng thành và 0.26-0.39 L/kg ở trẻ sơ sinh.
Chuyển hóa: Furosemid chuyển hóa ở gan khoảng 10%, chất chuyển hóa là acid 2-amino-4-chloro-5-sulfamoylanthranilic. Bumetanid chuyển hóa một phần ở gan. Chất chuyển hóa là bumetanid liên hợp, desbutyl bumetanid, alcol nguyên phát, acid aliphatic.
Thải trừ: Thời gian bán thải (t1/2) furosemid là 0.5-2 giờ ở bệnh nhân bình thường và 9 giờ ở bệnh thận giai đoạn cuối. Thanh thải thận của furosemid 2 mL/phút/kg. Furosemid được bài xuất chủ yếu qua nước tiểu (PO: 50%; IV: 80%). Thời gian bán thải (t1/2) bumetanid là 1-1.5 giờ ở người lớn, 2.4 giờ ở trẻ sơ sinh > 1 tháng, 6 giờ ở trẻ mới sinh. Bumetanid bài xuất chủ yếu qua thận (81%) và một phần nhỏ qua phân (2%).
Giải thích: PO: đường uống; IM: tiêm bắp; IV: tiêm tĩnh mạch.
Lợi tiểu thiazide
Hấp thu: Các thuốc đều hấp thu tốt qua đường uống. Sinh khả dụng (F) thường của hydrocholorothiazid, indapamid và chlorthalidon lần lượt là 65-75%, 93% và 65%. Thời gian khởi phát tác dụng sau uống lần lượt là 2 giờ, 1-3 giờ và 2-6 giờ. Thời gian đạt nồng độ đỉnh trong huyết tương (t1/2) lần lượt là 1-2.5 giờ, 2 giờ và 1.5-6 giờ. Hydrochlorothiazid, chlorothiazid… có tác dụng kéo dài 6-12 giờ, indapamid có tác dụng kéo dài 8-12 giờ, chlorthalidon có tác dụng kéo dài tới 48-72 giờ.
Phân bố: Thuốc qua được hàng rào nhau thai và sữa mẹ. Tỉ lệ liên kết protein huyết tương của hydrocholorothiazid, indapamid và chlorthalidon lần lượt là 40-68%, 71-79% và 75%. Thể tích phân bố (Vd) của hydrocholorothiazid và indapamid lần lượt là 3.6-7.8 L/kg và 24-25 L.
Chuyển hóa: Hydrocholorothiazid được chuyển hóa tối thiểu. Indapamid và chlorthalidon được chuyển hóa bởi gan.
Thải trừ: Các thuốc đều thải trừ qua thận (indapamid: 70% với 7% ở dạng không đổi; chlorthalidon: 50-65%) và cạnh tranh với bài xuất acid uric, làm giảm bài xuất acid uric. Chỉ một phần nhỏ hơn là thải trừ qua phân. Thời gian bán thải (t1/2) của hydrocholorothiazid và chlorthalidon lần lượt là 5.6-14.8 giờ và 40-60 giờ ở bệnh nhân chức năng thận bình thường hoặc 81 giở ở bệnh nhân thiểu niệu. Thanh thải toàn cơ thể của chlorthalidon là 53-145 mL/phút.
Lợi tiểu kháng aldosterone
Hấp thu: Thuốc hấp thu tốt qua đường tiêu hóa. Sinh khả dụng cao và tăng lên khi dùng cùng thức ăn. Thời gian đạt nồng độ đỉnh trong huyết tương (Tmax) từ 2 đến 4 giờ. Tác dụng xuất hiện chậm (2-4 giờ) nhưng kéo dài rất lâu (48-72 giờ).
Phân bố: Thuốc liên kết với protein huyết tương 90%. Thuốc qua được hàng rào nhau thai và sữa mẹ.
Chuyển hóa: Chuyển hóa qua gan lần đầu cao. Chất chuyển hóa carenon có tác dụng tương tự chất mẹ. Thuốc có chu trình ruột – gan.
Thải trừ: Thải trừ qua nước tiểu và mật. Thời gian bán thải (t1/2) khoảng 12-24 giờ.
Triamteren và amilorid
Hấp thu: Thuốc hấp thu vừa phải qua đường uống. Sinh khả dụng của triamteren và amilorid lần lượt là 30-70% và 30-90%. Thời gian khởi phát tác dụng lần lượt là 2-4 giờ và 2-3 giờ. Thời gian đạt nồng độ đỉnh trong huyết tương (Tmax) lần lượt là 1.5-3 giờ và 3-4 giờ sau uống. Thời gian tác dụng lần lượt là 7-9 giờ và 24 giờ.
Phân bố: Triamteren liên kết với protein huyết tương 55-67%, amilorid ít hơn, khoảng 23%. Thể tích phân bố (Vd) của amilorid là 350-380 L.
Chuyển hóa: Triamteren được chuyển hóa ở gan. Chất chuyển hóa hoạt động là hydroxytriamteren sulfat. Amilorid không được chuyển hóa ở gan và không có chất chuyển hóa hoạt động.
Thải trừ: Thời gian bán thải (t1/2) của amilorid khoảng 6-9 giờ, triamteren ít hơn, khoảng 1.5-2.5 giờ. Triamteren được bài xuất qua nước tiểu 21%. Amilorid được bài xuất qua nước tiểu 50%, phân 40-50%.
Lợi tiểu thẩm thấu
Hấp thu: Mannitol dùng tiêm tĩnh mạch không có hấp thu. Thời gian khởi phát tác dụng lợi tiểu xuất hiện sau 1-3 giờ, giảm áp lực nội nhãn 30-60 phút, giảm áp lực nội sọ 15 phút. Thời gian tác dụng của giảm áp lực nội nhãn 4-6 giờ, giảm áp lực nội sọ 3-8 giờ.
Phân bố: Không rõ.
Chuyển hóa: Chuyển hóa ở gan rất ít. Chất chuyển hóa: glycogen.
Thải trừ: Thời gian bán thải (t1/2) của mannitol là 100 phút. Bài xuất qua nước tiểu 80%.
Chỉ định và liều dùng
Lợi tiểu ức chế men CA
- Tăng nhãn áp.
- Động kinh.
- Phù não.
- Nhiễm kiềm chuyển hóa.
- Tăng huyết áp, phù trong suy tim, suy gan, suy thận… (ít dùng).
Lợi tiểu quai
- Cấp cứu: phù phổi cấp, phù nặng, cơn tăng huyết áp cấp.
- Phù do suy tim, suy gan, suy thận (đặc biệt có ure máu cao).
- Suy tim trái cấp, suy tim mạn tính kháng với lợi tiểu khác, tăng huyết áp kèm suy tim.
- Tăng Ca2+ máu.
- Phòng và điều trị sản giật ở phụ nữ mang thai.
Lợi tiểu thiazide
- Phù nhẹ và trung bình do suy tim, suy gan, suy thận và nhiễm độc thai nghén.
- Tăng huyết áp mạn: Thường phối hợp với thuốc ức chế men chuyển (ACEIs) hoặc thuốc chẹn thụ thể angiotensin (ARBs).
- Suy tim nhẹ và trung bình.
- Tăng Ca2+ niệu không rõ nguyên nhân.
- Đái tháo nhạt do thận (do thuốc làm giảm mức lọc cầu thận).
Lợi tiểu kháng aldosterone
- Phù do suy tim mạn, xơ gan, bệnh thận; tăng huyết áp: phối hợp với lợi tiểu giảm K+ máu.
- Tăng aldosteron nguyên phát (hội chứng Conn) hoặc thứ phát (xơ gan, suy tim).
Triamteren và amilorid
- Suy tim: Phối hợp với lợi tiểu giảm K+ máu.
Lợi tiểu thẩm thấu
- Lợi tiểu trong trường hợp cần thải độc qua thận.
- Suy thận cấp, hoại tử ống thận.
- Đái ít sau mổ, chấn thương.
- Thẩm phân phúc mạc (bắt buộc).
- Phù não, tăng áp lực nội sọ.
- Tăng nhãn áp.
Tác dụng phụ

Lợi tiểu ức chế men CA
- Rối loạn nước và điện giải: Giảm Na+, tăng K+ máu.
- Rối loạn thăng bằng kiềm toan: Nhiễm toan chuyển hóa.
- Khác: Sỏi thận (do kiềm hóa nước tiểu làm tăng tủa muối Ca2+), rối loạn thần kinh trung ương (đặc biệt ở bệnh nhân xơ gan), dị ứng (sốt, phát ban, tổn thương thận giống sulfamid), làm nặng thêm bệnh não gan.
Lợi tiểu quai
- Rối loạn nước và điện giải: Giảm K+, Cl-, Ca2+ gây mệt mỏi, chuột rút, hạ huyết áp tư thế đứng…
- Rối loạn thăng bằng kiềm toan: Nhiễm kiềm chuyển hóa do giảm H+ và tăng HCO3- huyết.
- Rối loạn chuyển hóa: Tăng acid uric máu, glucose máu, cholesterol máu.
- Xuất huyết tiêu hóa (nặng).
- Giảm bạch cầu, tiểu cầu.
- Rối loạn chức năng gan, thận (bản thân thuốc độc với thận).
- Độc dây thần kinh số VIII: chóng mặt, ù tai, điếc.
- Dị ứng: mẩn đỏ, đau cơ và khớp.
- Gây thiếu máu thai.
Lợi tiểu thiazide
- Rối loạn nước và điện giải: Giảm Na+, K+, Mg2+ và tăng Ca2+ máu. Mệt mỏi, nhức đầu, buồn nôn, chuột rút.
- Rối loạn thăng bằng kiềm toan: Nhiễm kiềm chuyển hóa.
- Rối loạn chuyển hóa: Tăng acid uric máu, làm nặng thêm bệnh gout.
- Ức chế giải phóng insulin, tăng bài xuất catecholamin nên gây tăng đường huyết, tăng cholesterol máu, làm nặng thêm bệnh đái tháo đường tụy.
- Dị ứng.
- Gây thiếu máu thai (ít hơn furosemid).
Lợi tiểu kháng aldosterone
- Rối loạn nước và điện giải: Tăng kali máu.
- Rối loạn thăng bằng kiềm toan: Nhiễm toan chuyển hóa.
- Rối loạn tiêu hóa.
- Mệt mỏi, buồn ngủ.
- Dị ứng: mẩn đỏ.
- Tác dụng kháng androgen: nam giới vú to, nữ giới rối loạn kinh nguyệt, rậm lông.
Triamteren và amilorid
- Rối loạn nước và điện giải: Tăng kali máu.
- Rối loạn thăng bằng kiềm toan: Nhiễm toan chuyển hóa.
- Chóng mặt, ngủ lịm, chuột rút.
- Chán ăn, buồn nôn, nôn, đau bụng, tiêu chảy.
- Rối loạn chức năng gan.
- Sỏi thận.
Lợi tiểu thẩm thấu
- Rối loạn nước và điện giải: Giảm natri huyết.
- Phù phổi cấp trong suy tim.
- Nhức đầu, buồn nôn, nôn.
Lưu ý và thận trọng
Lợi tiểu ức chế men CA
- Thận trọng với phụ nữ mang thai và đang cho con bú.
- Thận trọng với bệnh nhân mẫn cảm với sulfamid, có sỏi tiết niệu.
- Thận trọng với bệnh nhân có pH máu giảm, K+ máu giảm.
- Thận trọng với bệnh nhân sỏi thận, có tiền sử sỏi thận.
Lợi tiểu quai
- Thận trọng với phụ nữ mang thai và đang cho con bú (Cân nhắc giữa lợi ích và nguy cơ).
- Thận trọng với bệnh nhân có pH máu cao, Ca2+ và Mg2+ máu giảm.
- Thận trọng với bệnh nhân đái tháo đường, rối loạn chuyển hóa lipid, bệnh mạch vành, xơ vữa động mạch, nhồi máu cơ tim.
Lợi tiểu thiazide
- Thận trọng với phụ nữ mang thai và đang cho con bú.
- Thận trọng với bệnh nhân có pH máu cao, Ca2+ máu cao (hay gặp ở bệnh nhân cắt bỏ tuyến giáp).
- Thận trọng với bệnh nhân đái tháo đường, rối loạn chuyển hóa lipid, bệnh mạch vành, xơ vữa động mạch, nhồi máu cơ tim.
Lợi tiểu kháng aldosterone
- Thận trọng cho phụ nữ mang thai và đang cho con bú.
- Thận trọng với các tác dụng kháng androgen của nó. Có thể xem xét đổi thuốc.
Triamteren và amilorid
- Thận trọng với bệnh nhân đái tháo đường.
- Thận trọng với bệnh nhân có pH máu thấp.
Lợi tiểu thẩm thấu
- Thận trọng với bệnh nhân Na+ máu giảm.
Tương tác thuốc
Lợi tiểu ức chế men CA
- Phối hợp với lợi tiểu quai hoặc lợi tiểu thiazid: Nguy cơ hạ kali và natri huyết mạnh.
- Phối hợp với lợi tiểu kháng aldosteron, triamteren hoặc amilorid: Nguy cơ nhiễm toan chuyển hóa nặng.
- Phối hợp với các thuốc dễ gây toan máu (metformin): Nguy cơ nhiễm toan chuyển hóa nặng.
- Phối hợp với các thuốc kiềm hóa nước tiểu (NaHCO3): Tăng nguy cơ tạo sỏi thận.
Lợi tiểu quai
- Phối hợp với lợi tiểu ức chế men CA hoặc lợi tiểu thiazid: Nguy cơ hạ kali và natri huyết mạnh.
- Phối hợp với lợi tiểu thiazid: Nguy cơ nhiễm kiềm chuyển hóa nặng.
- Phối hợp với các thuốc có tỉ lệ liên kết protein huyết tương cao và khoảng điều trị hẹp (thuốc chống đông đường uống wafarin, phenytoin…): Tăng tác dụng phụ không mong muốn của các thuốc này như xuất huyết, rung giật nhãn cầu…
- Phối hợp với các thuốc độc với thận (vancomycin, kháng sinh aminosid): Tăng độc tính trên thận và dây thần kinh số VIII.
- Phối hợp với các thuốc gây kéo dài khoảng QT như quinidin, amiodaron, kháng sinh nhóm quinolon: Tăng nguy cơ rối loạn nhịp tim.
- Phối hợp với các thuốc ức chế men chuyển (ACEIs): Gây hạ huyết áp đột ngột.
- Phối hợp với phenytoin: Giảm tác dụng lợi tiểu.
- Phối hợp với các digitalis: Tăng độc tính các digitalis.
- Phối hợp với các thuốc kháng acid dạ dày (antacid): Giảm hấp thu bumetanid đường uống.
- Phối hợp với các thuốc độc trên hệ tạo máu (linezolid, thuốc hóa trị liệu ung thư): Tăng độc tính trên hệ tạo máu.
- Phối hợp với các thuốc hoặc chế phẩm chứa calci: Tăng nguy cơ tạo sỏi thận.
Lợi tiểu thiazide
- Phối hợp với lợi tiểu ức chế men CA hoặc lợi tiểu quai: Nguy cơ hạ kali và natri huyết mạnh.
- Phối hợp với lợi tiểu quai: Nguy cơ nhiễm kiềm chuyển hóa nặng.
- Phối hợp với các digitalis: Tăng độc tính các digitalis.
- Phối hợp với các thuốc hoặc chế phẩm bổ sung calci: Nguy cơ gây tăng Ca2+ huyết.
- Phối hợp với thuốc ức chế men chuyển (ACEIs) và thuốc chẹn thụ thể angiotensin (ARBs) tạo ra 2 tác dụng:
Hạn chế tác dụng gây tăng kali máu của các thuốc ACEIs và ARBs.
Hạn chế tác dụng gây hoạt hóa hệ RAA của lợi tiểu thiazid.
Lợi tiểu kháng aldosterone
- Phối hợp với lợi tiểu ức chế men CA, triamteren hoặc amilorid: Nguy cơ nhiễm toan chuyển hóa nặng.
- Phối hợp với các thuốc dễ gây toan máu (metformin): Nguy cơ nhiễm toan chuyển hóa nặng.
- Phối hợp với thuốc ức chế men chuyển (ACEIs) và thuốc chẹn thụ thể angiotensin (ARBs): Gây tăng kali máu mạnh.
- Phối hợp với thuốc lợi tiểu giữ kali khác: Gây tăng kali máu nghiêm trọng.
Triamteren và amilorid
- Phối hợp với lợi tiểu ức chế men CA hoặc lợi tiểu kháng aldosterone: Nguy cơ nhiễm toan chuyển hóa nặng.
- Phối hợp với các thuốc dễ gây toan máu (metformin): Nguy cơ nhiễm toan chuyển hóa nặng.
- Phối hợp với thuốc ức chế men chuyển (ACEIs) và thuốc chẹn thụ thể angiotensin (ARBs): Gây tăng kali máu mạnh.
- Phối hợp với thuốc lợi tiểu giữ kali khác: Gây tăng kali máu nghiêm trọng.
Lợi tiểu thẩm thấu
Mannito có thể tương tác với tobramycin.
Chống chỉ định
Quá mẫn cảm với bất cứ thành phần nào của thuốc.
Lợi tiểu ức chế men CA
- Xơ gan, suy gan (do làm tăng NH3 máu, nguy cơ gây não gan).
- Bệnh tim phổi mạn, bệnh phổi mạn có suy hô hấp và tăng CO2 máu.
Lợi tiểu quai
- Gout.
- Xơ gan, hôn mê, tiền hôn mê kết hợp với xơ gan, bệnh não gan.
- Suy thận vô niệu, suy thận do tác nhân độc với thận và gan.
- Kali máu thấp.
- Tụt huyết áp do giảm thể tích tuần hoàn, mất nước.
- Acid ethacrynic: Không dùng cho phụ nữ mang thai và cho con bú.
- Bumetanid: Không dùng cho phụ nữ mang thai 3 tháng đầu.
Lợi tiểu thiazide
- Xơ gan có giảm K+ máu (đề phòng não gan).
- Gout.
- Suy gan, suy thận.
- Dị ứng với sulfamid.
Lợi tiểu kháng aldosterone
- Tăng kali máu.
- Nhiễm toan chuyển hóa.
- Suy thận mạn.
- Suy gan.
- Loét dạ dày – tá tràng.
Triamteren và amilorid
- Suy thận.
- Tăng kali máu.
- Xơ gan, suy gan nặng.
- Phụ nữ mang thai và đang cho con bú.
Lợi tiểu thẩm thấu
- Suy tim.
- Mất nước tế bào.
- Không uống do gây tiêu chảy do tăng áp lực thẩm thấu.
Tài liệu tham khảo:
https://www.ncbi.nlm.nih.gov/books/NBK532918/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5811193/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5615771/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1472969/
https://www.ncbi.nlm.nih.gov/pubmed/26194642
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4700017/
https://www.ncbi.nlm.nih.gov/books/NBK542303/