Tác giả: Bác sĩ Đặng Thanh Tuấn
Tóm tắt
30 năm qua, thông khí tần số cao (HFV) đã được tìm thấy con đường từ ICU sơ sinh đến trẻ em và người lớn. Với thể tích khí lưu thông nhỏ của nó, các dao động áp lực chặt chẽ trong lồng ngực và tách rời việc xử trí thông khí và oxygen hóa, HFV phù hợp với hiểu biết của chúng ta ngày nay trong thông khí bảo vệ phổi. Tổng quan này cung cấp cho bạn hiểu biết về các phương thức khác nhau của HFV, các cơ chế trao đổi khí trong HFV sử dụng thể tích khí lưu thông dưới khoảng chết và một số thông tin về chăm sóc điều dưỡng và cai máy một đứa trẻ đang thở HFV. Tập trung vào việc sử dụng lâm sàng của thở máy tần số cao với một tổng quan thực tế về các chiến lược được sử dụng: chiến lược thể tích lớn được thiết kế để nhanh chóng huy động và duy trì thể tích phổi tối ưu trong bệnh phế nang lan tỏa và xuất huyết phổi, chiến lược thể tích thấp trong airleak, và chiến lược đường thở mở trong bệnh đường hô hấp nhỏ, nơi áp lực căng liên tục được sử dụng để huy động và nong đường thở.
Mục tiêu giảng dạy
o Thảo luận việc sử dụng máy thở dao động tần số cao (HFOV) trong PICU
o Minh họa các phương thức khác nhau của thông khí tần số cao
o Hiểu được các nguyên tắc cơ bản của cơ chế trao đổi khí trong HFOV
o Thảo luận các chiến lược HFOV thường được sử dụng như một liệu pháp (cứu hộ) trong suy hô hấp nhi khoa.
o Cung cấp cho độc giả một thuật toán về phương pháp phổi mở trong HFOV ở bệnh phế nang khuếch tán.
o Để nhấn mạnh tầm quan trọng của việc thông khí bảo vệ phổi ở trẻ bị suy hô hấp cấp và cách HFOV phù hợp với những hiểu biết này.
Mở đầu
Thông khí cơ học đã đi được một chặng đường dài kể từ khi lần đầu tiên được nhắc đến năm 175 sau Công nguyên từ Galen, người đã sử dụng cái bơm xếp để bơm phồng phổi của một con vật đã qua đời.[1] Trong khi trao đổi oxy và carbon dioxide giữa máu và phế nag hoạt động bằng cách khuếch tán và không đòi hỏi thêm công bên ngoài, không khí phải được đưa vào và đưa ra để cho nó sẵn sàng trao đổi khí. Với sự ra đời của phổi sắt trong đại dịch cúm, thời đại thông khí thực tế đã bắt đầu. [2] Máy thở đã phát triển từ các máy đơn giản sang các thiết bị điều khiển bằng bộ vi xử lý cho phép đồng bộ hóa nhu cầu thở máy của bệnh nhân.
Mặc dù là thiết bị bảo toàn mạng sống, thông khí cơ học cũng có những biến chứng.3 Có lẽ không đáng ngạc nhiên, việc sử dụng cái bơm xếp trong những ngày đầu có thể dễ dàng làm vỡ phổi. Barotrauma đề cập đến sự phá hủy phế nang và đường thở nhỏ khi áp lực thì hít vào cao được áp dụng.[4] Gần đây, mô hình đã thay đổi: volutrauma thừa nhận rằng sự căng phế nang quá mức có thể xảy ra do thể tích quá nhiều và không phải là do áp lực gây ra.[5] Ngoài ra, nhiều bằng chứng cho thấy rằng thông khí ở mức độ thể tích phổi thấp có thể gây ra thương tích. Trong bệnh lý phế nang lan tỏa (DAD, diffuse alveolar disease), các phế nang vùng phổi phụ thuộc thường đạt đến thể tích đóng khi kết thúc thì thở ra, kết quả là phổi xẹp và sau đó phế nang lại mở ra khi hít vào. Sự lặp lại tuần hoàn của sự xẹp và mở lại tạo ra các lực cắt có khả năng gây ra thiệt hại, do đó có thuật ngữ atelectrauma.[6] Các tổn thương được mô tả ở đây được cho là cơ học. Tuy nhiên, có bằng chứng rằng các yếu tố cơ học có thể dẫn đến tổn thương là tế bào và qua trung gian các chất gây viêm. Biotrauma này góp phần tạo ra sự suy cơ quan có liên quan đến sự gia tăng tình trạng viêm quá mức và các cytokines sản xuất tại chỗ.[7]
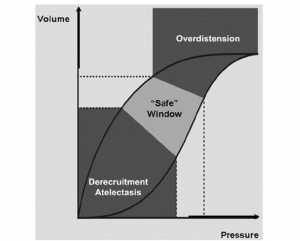
Thông khí cơ học có thể không còn được coi là phương thức điều trị đơn giản là hỗ trợ bệnh nhân cho đến khi bệnh nguyên phát hồi phục. Qua các quan sát đã đề cập ở trên, có vẻ hợp lý là làm sao để tránh cả hai quá trình: căng quá mức và mở/xẹp có chu kỳ các đơn vị tận (phế nang và các phế quản tận). Froese giả định trên đường cong áp suất – thể tích của hệ thống hô hấp một cửa sổ an toàn, một khu vực nằm giữa một khu vực thấp hơn của “xẹp phổi” và khu vực trên của “quá căng” (Hình 1).[8] Lý tưởng là, tidal volumes (VT) phải phù hợp trong khu vực này bởi thiết lập mức PEEP trên điểm uốn dưới (LIP) và giảm áp lực bình nguyên để tránh tình trạng căng quá mức.[9,10] Trong một số tình trạng bệnh lý, cửa sổ an toàn có thể là quá nhỏ để có thể giữ được thể tích khí lưu thông thông thường. Thông khí tần số cao (HFV) với VT nhỏ, các dao động áp suất chặt chẽ trong lồng ngực và tách riêng xử trí thông khí với oxygen hóa máu, dường như là một ứng cử viên lý tưởng cho việc thông khí trong vùng an toàn.[8,11]
High frequency ventilation
Có nhiều cách khác nhau của HFV và mỗi loại có ưu điểm và nhược điểm riêng của nó, nhưng tất cả chúng đều được đặc trưng bởi tần số thở ≥ 1 Hz (60 nhịp thở/phút) và VT thấp hơn thể tích khoảng chết.[12] Chúng có thể được phân thành bốn loại:
o high-frequency positive pressure ventilation (HFPPV)
o high-frequency jet ventilation (HFJV)
o high frequency flow interrupter (HFFI)
o high-frequency oscillatory ventilation (HFOV).
HFV đã được giới thiệu vào đầu những năm 1970, theo kinh nghiệm của Oberg và Sjöstrand. Họ sử dụng các tần số cao hơn và VT nhỏ hơn để loại bỏ ảnh hưởng của các biến đổi hô hấp trên phản xạ xoang động mạch cảnh. Sự gia tăng thể tích khoảng chết được khắc phục bằng việc bơm khí trực tiếp vào khí quản. Họ kết thúc với VT khoảng 3-4 mL/kg, tốc độ dòng chảy cao và tần suất 60-100 lần thở/phút. Thở ra là thụ động, tùy thuộc vào sự co lại đàn hồi của phổi và thành ngực. Họ gọi phương pháp của họ là HFPPV.[13] Với các thiết bị được thiết kế đặc biệt mới trở nên phổ biến, HFPPV hiện nay hiếm khi được sử dụng.
HFJV đã được Sanders giới thiệu vào năm 1967 để tạo thuận lợi cho việc trao đổi khí trong quá trình nội soi phế quản.[14] Kết hợp các quan sát này và các quan sát của Sjöstrands, Klain và Smith đã giới thiệu vào năm 1977 thông khí phụt xuyên khí quản tần số cao.[15] Luồng khí dưới áp suất cao hay “vòi phun” được đưa ra thông qua một catheter nhỏ trong ống. Một VT từ 2-5 ml/kg đã được cung cấp ở tần số cao (100-200 lần/phút). Việc sử dụng một hệ thống dòng chảy liên tục liên tục được cho phép tạo ra luồng khí bổ sung thông qua nguyên lý Venturi. Sự tương tác phức tạp giữa tốc độ phản lực, thời gian hít vào, kiểu vòi phun và đặc điểm hệ thống xác định thể tích khí vào thêm. Bởi vì điều này không phải là điều khiển bởi người sử dụng, rất khó để thao tác để VT cung cấp được chính xác. Hơi thở thông thường đôi khi được sử dụng để hỗ trợ làm phồng phổi trở lại. Trong HFJV, tỷ lệ lưu lượng cao làm cho độ ẩm không thể tối ưu, tăng nguy cơ viêm khí phế quản hoại tử. Giống như HFPPV, thở ra là thụ động. Ngày nay, HFJV được sử dụng chủ yếu trong các trường hợp đòi hỏi sự vận động đường thở trên tối thiểu, chẳng hạn như phẫu thuật thanh quản.
HFFI cũng tương tự như HFJV nhưng cơ chế kiểm soát khí khác nhau. Một thanh hoặc quả cầu quay với một lỗ nhỏ được đặt trong đường dẫn của một loại khí áp suất cao. Khi thanh hoặc quả bóng quay, một xung khí nhỏ được phép vào đường thở. Thở ra cũng là thụ động.
Năm 1980 Bohn và cộng sự và Butler et al. chứng minh rằng trao đổi khí đầy đủ là có thể bằng cách tạo ra các dao động trong đường thở với tần số 15 Hz.[16,17] Các dao động có thể được tạo ra bởi loa hoặc máy bơm piston điện tử. Trước đó, Lunkenheimer và cộng sự đã tìm thấy sự thông khí đầy đủ ở những con chó khi sử dụng tần số từ 20-40 Hz.[18] Phương pháp này được gọi là HFOV vì các dao động tạo ra sự thay đổi áp lực đòi hỏi. Áp suất dao động xung quanh áp suất căng hằng định (CDP, constant distending pressure) phát ra qua một dòng chảy liên tục đi qua một van hạn chế biến trên nhánh khí thở ra. Điều này giúp cho thể tích phổi ổn định và có thể kiểm soát được. CDP trong HFOV hoạt động tương tự như CPAP trong CMV vì nó cung cấp áp lực cho việc huy động phế nang và do đó điều hòa oxy hóa. Thông khí trong HFOV chủ yếu phụ thuộc vào tần số và VT . Khi tần số giảm thì VT tăng lên do chu kỳ hô hấp dài hơn cho phép sự dao động lớn hơn của màng dao động. Do đó, ở một mức năng lượng nhất định CO2 sẽ được loại bỏ ở tần số thấp hơn. Khí được đẩy vào phổi trong khi hít vào, và tích cực kéo ra khi thở ra. Như vậy, cả sự thở ra lẫn hít vào đều là các quá trình chủ động.
Cơ chế trao đổi khí trong HFV
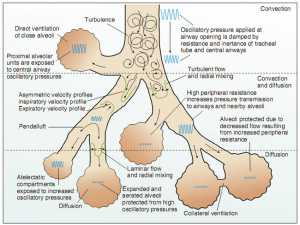
Một trong những khái niệm cơ bản được giảng dạy trong sinh lý học là để trao đổi khí đầy đủ VT nên vượt quá thể tích của đường dẫn khí, được gọi là khoảng chết. Tuy nhiên, thông khí đầy đủ có thể đạt được trong HFOV tạo ra VT nhỏ hơn khoảng chết. Các cơ chế vận chuyển khí khác với cơ chế lưu lượng khí thông thường.[19] Có bảy cơ chế có thể:
o Thông khí trực tiếp vào các phế nang gần
o Lưu dòng hỗn loạn (turbulent flow) với hỗn hợp đối lưu (convective mixing) kết hợp
o Lưu dòng Pendelluft giữa các khu vực lân cận của phổi với các hằng số thời gian khác nhau để làm trống phế nang
o Rối loạn do tim (Cardiogenic mixing) do sự biến dạng của các đơn vị phổi bên cạnh tim bị ảnh hưởng bởi co thắt của tim
o Vận tốc bất đối xứng với không khí ở vùng trung tâm di chuyển nhanh nhất, hút khí gần với thành khí quản. Điều này dẫn đến sự phát tán khí “tươi” tới phế nang và khí “phế nang” ra khỏi các phế nang dọc theo thành ngoài.
o Dòng chảy mỏng với vận chuyển bằng cách khuếch tán (Taylor dispersion)
o Thông khí thông qua các kết nối không phải từ đường thở giữa các phế nang lân cận.
Các cơ chế vận chuyển khí chính yếu hoạt động dưới các điều kiện sinh lý ở mỗi khu vực được trình bày trong Hình 2.20 Mặc dù tất cả các cơ chế chung này tính đến thông khí trong suốt HFOV, sự đóng góp định lượng chính xác của mỗi loại không được biết đến.
Áp dụng lâm sàng
HFOV được sử dụng chủ yếu ở trẻ sơ sinh.[21-25] Trong một số trẻ sơ sinh, HFOV được sử dụng làm máy thở đầu tiên do tính nhạy cảm cao của phổi dễ bị tổn thương. Năm 1994, Arnold xuất bản kết quả sử dụng HFOV trong khoa nhi.[26] Những năm tiếp theo, nhiều dữ liệu về việc áp dụng HFOV ngoài NICU, xuất phát từ các báo cáo case series.[27-34] Những điều này gợi ý rằng HFOV có thể được sử dụng an toàn và nó sử dụng có liên quan đến việc cải thiện oxy hóa và thông khí mà không làm rò rỉ khí. Mặc dù kỳ vọng cao, HFOV vẫn được sử dụng chủ yếu như một liệu pháp cứu hộ ở trẻ em với DAD, và ở mức độ thấp hơn, ở trẻ bị rò rỉ không khí hoặc các bệnh đường thở nhỏ (SAD, small airway disease). Bệnh nhân DAD chủ yếu có các rối loạn oxy hóa và chụp X-quang ngực với thâm nhiễm cản quang 2 bên (ARDS, dập phổi, viêm phổi). Bệnh nhân SAD thường có các vấn đề về thông khí với sự gia tăng sức cản đường thở và căng phế nang trên X-quang phổi.
HFOV như là một liệu pháp cứu hộ thường được bắt đầu khi đáp ứng các tiêu chí sau: thất bại thông khí với áp lực cao nguyên 30 cm H2O mặc dù sử dụng tăng thán chấp nhận ít nhất hai giờ (suy thông khí) hoặc chỉ số oxy hóa ≥ 13 thể hiện bằng hai lần đo khí máu trong một khoảng thời gian sáu giờ (suy oxygen hóa). Tuy nhiên, đôi khi quyết định bắt đầu HFOV là sớm hơn, dựa trên sự đánh giá lâm sàng. Có tính đến một số nhỏ các RCTs ở trẻ em hoặc người lớn HFOV hỗ trợ gợi ý rằng HFOV có thể thành công hơn nếu được áp dụng trước đó trong quá trình bệnh, cách tiếp cận này có thể là hợp lý.[26,35,36]
Tùy thuộc vào điều kiện cơ bản, bạn có thể sử dụng ba chiến lược khác nhau:
- chiến lược thể tích phổi cao hoặc mở phổi (the high-volume or open lung strategy) được thiết kế để nhanh chóng huy động và duy trì thể tích phổi tối ưu trong DAD và xuất huyết phổi (Hình 3). CDP ban đầu được thiết lập 3-5 cm H2O so với áp suất đường thở trung bình (MAP) trong CMV với FiO2 là 1,0. Mục đích là một SaO2 ≥ 90% ở FiO2 ≤ 0.4, độ pH trên 7.25 bất kể PaCO2, và huyết động học ổn định. Để tối ưu hóa phổi, CDP tăng lên theo bước 2 cm H2O với sự giảm FiO2 tiếp theo cho đến khi đạt được mục tiêu oxy hóa. Thường có tần số 10 Hz ở trẻ em < 10 kg, 8 Hz ở trẻ > 10 kg. Biên độ (dP) ban đầu được thiết lập để đạt được độ rung của ngực và điều chỉnh theo tuần tự để đạt được mục tiêu thở máy. Nếu toan hô hấp kéo dài với dP tối đa, tần số sẽ giảm. Cách tiếp cận phù hợp hơn là đặt power ở mức tối đa và điều chỉnh tần số xuống cho đến khi đạt được độ rung của ngực. Điều này sẽ đạt được sự hỗ trợ thông khí ở VT nhỏ nhất,[37,38] nhưng thực tế này vẫn chưa được chấp nhận rộng rãi. Nó cũng đã được biết từ nhiều năm rằng các thủ tục huy động là cần thiết để đảo ngược sự xẹp phổi. Mặc dù các nghiên cứu gần đây đã chứng minh tính an toàn và hiệu quả của những thủ thuật này trên người lớn, nhưng chúng thường không được sử dụng trong PICU. Hình 3 chỉ ra rằng có thể xem xét các thủ tục huy động.
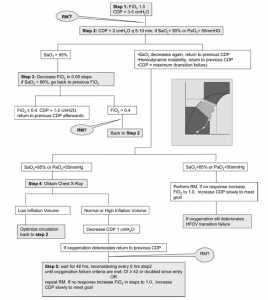
- Chiến lược thể tích phổi thấp (low volume strategy) cho các trường hợp có rò rỉ khí (aie leak), sau một cách tiếp cận ban đầu giống như trong chiến lược phổi mở, CDP sẽ giảm cho đến khi ngưng rò rỉ khí. Cung cấp nồng độ oxy cao hơn và chấp nhận một trị số SaO2 thấp hơn (thiếu oxy cho phép)
- Chiến lược đường thở mở (open airway strategy) ở SAD, CDP được sử dụng để huy động và nong đường thở. Một bắt đầu với FiO2 1.0 và CDP cao hơn MAP 2 cm so với CMV. Nếu cần, CDP sẽ tăng lên tùy theo SaO2, và ngược lại với chiến lược “mở phổi”, cũng cần quan tâm đến PaCO2. Khi CDP được áp dụng trong toàn bộ chu trình hô hấp, đường dẫn khí mở rộng hơn, đường kính đường thở ổn định và sức cản đường thở thì thở ra giảm. Lưu lượng hạn chế phụ thuộc vào đường kính của đường thở nhỏ, và phụ thuộc vào thể tích phổi, do đó ở thể tích phổi cao thì giới hạn lưu lượng có thể được giảm thiểu. Ngoài ra, mở đường thở nhỏ cho phép truyền lan các dao động xuống phế nang tốt hơn. Do đó CDP có ảnh hưởng đến thông khí. Giai đoạn thở ra tích cực hỗ trợ việc vận chuyển khí từ các phế nang.[28,29] Một khi đường thở được mở ra, cần chú ý cẩn thận đến quá căng phế nang vì các phế nang có độ giãn nở bình thường phải đối mặt với CDP tương đối cao. Vì lý do tương tự, các thủ tục huy động bổ sung không được thực hiện. Mọi thay đổi gia tăng trong CDP phải được theo sau bởi sự xác định PaCO2 để xem tại đó CDP có mở được đường thở và làm cho PaCO2 giảm. Có thể nghi ngờ quá căng phế nang nếu tình trạng huyết động học xấu đi, điều này có thể được khôi phục bằng cách giảm CDP hoặc truyền dịch. Mức độ tăng sáng của phổi trên X-quang ngực không được sử dụng để thay đổi CDP.
Dựa trên những kinh nghiệm tích cực trong khoa nhi và với công nghệ phát triển, HFOV hiện đã được áp dụng trong chăm sóc tích cực cho người lớn.[35,39-41]
Chăm sóc điều dưỡng trẻ thở HFOV
Có một số khía cạnh cần được làm nổi bật. Hình ảnh của một đứa trẻ sơ sinh đang ‘dao động’ có thể gây lo lắng cho gia đình, do đó nó là điều cần thiết để cung cấp thông tin đầy đủ. Sau khi bệnh nhân được gắn vào máy HFOV, việc quan sát cẩn thận về kiểu rung (yếu tố rung ngực, the chest wiggle factor) là biện pháp lâm sàng đáng tin cậy nhất, có thể cho thấy bằng chứng sớm về thay đổi trong bệnh phổi hoặc tác dụng phụ. Nếu ngực rung, ống NKQ có thể trượt xuống hoặc trở nên nghẹt. Một bên ngực rung có thể cho biết một tràn khí màng phổi. Nghe phổi trong HFOV có thể là khó khăn, nhưng không vô ích. Giảm âm thở một bên có thể cho thấy thông khí một bên phổi do ống NKQ vào quá sâu hoặc tràn khí màng phổi.[42] Một người cũng có thể lắng nghe cường độ hoặc âm thanh của piston. Tuy nhiên, những gì âm thanh mà một trong những nghĩa vụ phải nghe được tranh luận và bất kỳ giải thích chính xác đòi hỏi phải huấn luyện thích hợp. Việc hút đàm trong 24 giờ đầu tiên thường không cần thiết. Nếu sử dụng một hệ thống hút đàm kín, điều quan trọng là phải rút catheter hút đám ra ngoài sau khi hít đàm xong. Giới hạn cảnh báo phải được đặt trong giới hạn an toàn (thường là 3-5 trên và dưới CDP mong muốn). Khi thay đổi tư thế bệnh nhân, ít nhất hai điều dưỡng nên trợ giúp để bảo vệ ống NKQ. Cuối cùng, điều quan trọng là làm ẩm khí để ngăn ngừa viêm khí phế quản hoại tử.
Cai máy HFOV
Việc cai máy không nên trì hoãn một cách không cần thiết và cũng không nên làm sớm. Thật không may, không có tiêu chí cụ thể nào khái quát hóa cho tất cả trẻ em. Không nên chỉ dựa đơn thuần vào mức độ CDP, mà còn có thể là nhiều hơn các trị số khác. Thông thường, cai máy có thể được xem xét khi CDP ít nhất giảm xuống ≤ 17 cm H2O, FiO2 xuống ≤ 0.4, và bệnh nhân dung nạp với hút đàm. Thông thường đứa trẻ thể hiện sự trao đổi khí thỏa đáng trên CMV với MAP thấp hơn một vài cm dưới CDP cuối cùng trên HFOV. Có thể rút nội khí quản thành công từ HFOV. Tuy nhiên, trẻ lớn hơn thường không chịu được việc giảm dần sự an thần cho phép thở tự phát trên máy HFOV, và hơi thở tự phát của chúng có thể làm giảm đáng kể áp lực trong hệ thống, dẫn đến báo động hoặc thậm chí tắt máy thở.
Giới thiệu về máy thở thông minh và những người sử dụng chúng
Cho phổi nghỉ ngơi là cách tốt nhất để chữa lành thương tích và điều này cũng đúng đối với phổi.[43] Phổi càng ít bị buộc phải giãn nở, càng ít bị tổn thương phổi. Câu hỏi ngày nay là: liệu chúng ta có nên di chuyển về phía các thể tích khí lưu thông càng nhỏ càng tốt mà không cho phép phổi xẹp tất cả xuống? Điều này có thể đạt được bằng cách sử dụng HFOV. Mặc dù các dao động có thể gây áp lực đáng kể trong ống, nhưng sự dao động áp suất giảm đáng kể ở cấp phế nang.[44] Điều này giúp bảo vệ các phế nang khỏi volutrauma.[8] Bằng cách tối ưu hóa việc huy động và sự tưới máu tốt, việc sử dụng HFV cũng cho phép giảm oxy đến mức ít độc hại hơn. Về mặt lý thuyết, HFOV cung cấp chiến lược phổi mở, duy trì thể tích phổi cuối thì thở ra, giảm thiểu sự kéo căng phổi chu kỳ, và tránh quá căng phế nang bằng cách hạn chế VT và áp lực xuyên phổi.[45]
Đó là lời hứa của HFOV, nhưng cũng giống như nhiều lời hứa khác, thật khó để hoàn thành. Mặc dù các nghiên cứu trên động vật cho thấy rõ ràng tổn thương phổi ít hơn bằng cách sử dụng HFOV so với CMV, các thử nghiệm lâm sàng ít rõ ràng hơn. Điều này có thể là do phạm vi rộng các bệnh lý hô hấp cấp tính trong PICU, cùng với xu hướng dần dần hướng tới việc sử dụng các chiến lược thông khí bảo vệ phổi tốt hơn. Mặc dù không có RCT nhi nào chứng minh được lợi ích của sự sống còn, nhưng tất cả họ đều không đủ sức làm như vậy. Tuy nhiên, trẻ được điều trị với HFOV đã chứng minh sự cải thiện oxy hóa, được tiếp xúc với oxy ít hơn và có bệnh phổi mãn tính ít hơn.[22-26,36,46-48] Tất cả các thử nghiệm chứng minh lợi ích oxy hóa với HFOV đã nhấn mạnh việc huy động thể tích phổi.[23,24,26,36]
Trong một phân tích tổng hợp tích lũy cho thấy, qua thời gian, điều trị CMV cải thiện, làm giảm lợi ích tương đối của HFOV.[49] Nó cho thấy rõ ràng cách sử dụng máy thở đã ảnh hưởng nhiều hơn đến kết quả phổi hơn là loại máy thở. Đối với bệnh nhân bị tổn thương phổi, chiến lược thông khí phải dựa trên mức VT thấp, với tần số tương đối nhanh, có hoặc không có PEEP. Tuy nhiên, Rubenfeld và cộng sự cho thấy mặc dù đã chấp nhận rộng rãi dữ liệu về thông khí bảo vệ phổi (LPV, lung protective ventilation), hầu hết bệnh nhân ARDS hiện không được điều trị bằng LPV trong suốt CMV.[50] HFOV không chỉ hoàn toàn phù hợp với những hiểu biết của chúng ta ngày nay trong LPV, có khả năng loại bỏ hầu hết các rào cản đối với việc sử dụng nó trong các bệnh nhân nặng. HFOV rất dễ sử dụng, oxy hóa và thông khí được điều chỉnh độc lập, và ít nhất là an toàn và hiệu quả như CMV ở trẻ em ở mọi lứa tuổi và với các bệnh khác nhau, với những chiến lược nhất định được tuân theo. Một bài học quan trọng được rút ra từ những năm phát triển HFOV là việc áp dụng công nghệ phòng thí nghiệm trong thực hành lâm sàng dễ dàng hơn nhiều so với để đạt được sự đồng thuận về cách sử dụng nó. Bước tiếp theo của câu chuyện sẽ là đánh giá một protocol HFOV tốt hơn (tức là với các động tác huy động thể tích và các tần số cao hơn) đối với bất kỳ lựa chọn thông thường nào tốt nhất vào thời điểm đó.
Practice points
- Thông khí tần số cao với VT nhỏ, các biến đổi áp suất chặt chẽ trong lồng ngực và tách biệt xử trí thông khí với xử trí oxy hóa, dường như là một ứng cử viên lý tưởng cho việc thông khí trong vùng an toàn
- Ngược lại với hầu hết các phương thức HFV, sự thở ra trong HFOV là một quá trình chủ động.
- Sử dụng HFOV sớm có vẻ có lợi hơn
- RCT ở trẻ em và người lớn đã nhấn mạnh vào việc huy động thể tích phổi “tích cực” trong suốt HFOV
- Một cách tiếp cận phù hợp hơn với mức công suất tối đa và tần số điều chỉnh xuống dưới cho đến khi đạt được độ rung của ngực, có thể hỗ trợ thông khí ở mức VT nhỏ nhất có thể.





