Tenofovir được biết đến là một hoạt chất có tác dụng ức chế sự phát triển của các retrovirus và được ứng dụng rất nhiều trong điều trị HBV hay HIV. Ở bài này Heal Central xin được giới thiệu tới các bạn các thông tin về thử nghiệm lâm sàng để đánh giá tác dụng và lịch sử nghiên cứu và phát triển thuốc, hướng dẫn sử dụng thuốc Tenofovir đầy đủ. Dưới đây là thông tin chi tiết.
Lịch sử nghiên cứu và phát triển
Tenofovir là một thuốc kháng retrovirus được sử dụng trong điều trị nhiễm virus viêm gan B (HBV) và virus HIV. Hiện tenofovir được sản xuất dưới dạng tiền thuốc (prodrug), gồm 2 dạng được sử dụng trên lâm sàng là tenofovir disoproxil fumarate (TDF) và tenofovir alafenamide fumarate (TAF), trong đó TAF là loại được ra đời sau với nhiều ưu điểm hơn TDF.
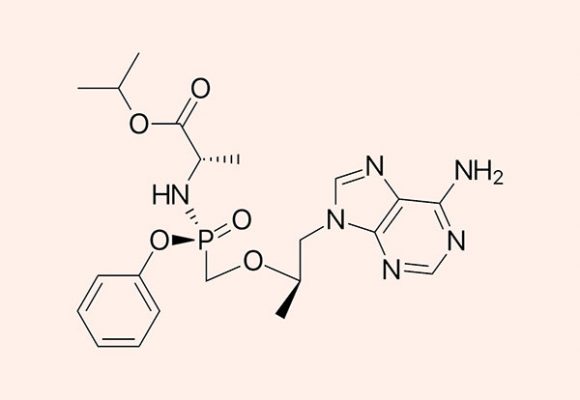
Alafenamide Fumarate
Tenofovir ban đầu được tổng hợp bởi Antonín Holý tại Viện Hóa học hữu cơ và Hóa sinh của Viện hàn lâm Khoa học Cộng hòa Séc tại Prague. Bằng sáng chế được Holý đệ trình năm 1984 không đề cập đến việc sử dụng hợp chất tiềm năng này để điều trị HIV/AIDS.
Năm 1985, De Clercq và Holý đã mô tả hoạt động của PMPA chống lại HIV trong nuôi cấy tế bào. Ngay sau đó, sự hợp tác với công ty công nghệ sinh học Gilead Science đã dẫn đến việc đã dẫn đến việc điều tra tiềm năng của PMPA trong điều trị cho bệnh nhân nhiễm HIV. Năm 1997, các nhà nghiên cứu từ Gilead và Đại học California, San Francisco đã chứng minh rằng tenofovir có tác dụng chống HIV ở người khi được tiêm dưới da.
Dạng ban đầu của Tenofovir được sử dụng trong các nghiên cứu này bị hạn chế sử dụng rộng rãi vì nó không hấp thu khi dùng đường uống. Một nhóm hóa dược tại Gilead đã phát triển một phiên bản sửa đổi của Tenofovir là Tenofovir Disoproxil (TDF). Cấu trúc mới này thân dầu hơn và dễ hấp thu qua đường uống hơn (có thể uống được). Biệt dược gốc của TDF do Gilead sản xuất có tên là Viread.
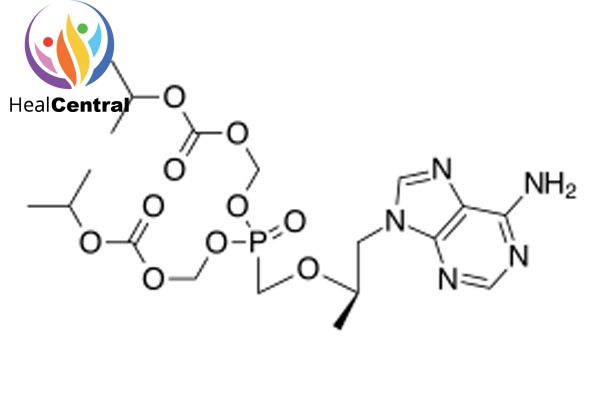
TDF đã được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ phê duyệ ngày 26/10/2001 để điều trị HIV/AIDS và ngày 11/8/2008 để điều trị viêm gan B mạn tính.
TAF được phát triển bởi Gilead Science. TAF có hoạt tính chống virus lớn hơn và phân phối tốt hơn vào các mô bạch huyết so với TDF.
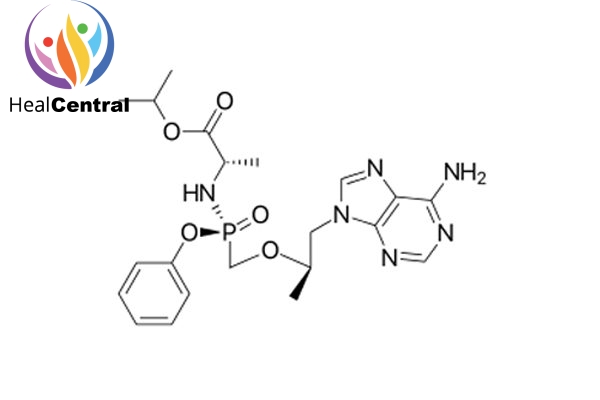
TAF đã được FDA chấp thuận tháng 11/2016 dưới tên thuốc Vemlidy.
Dược lực học
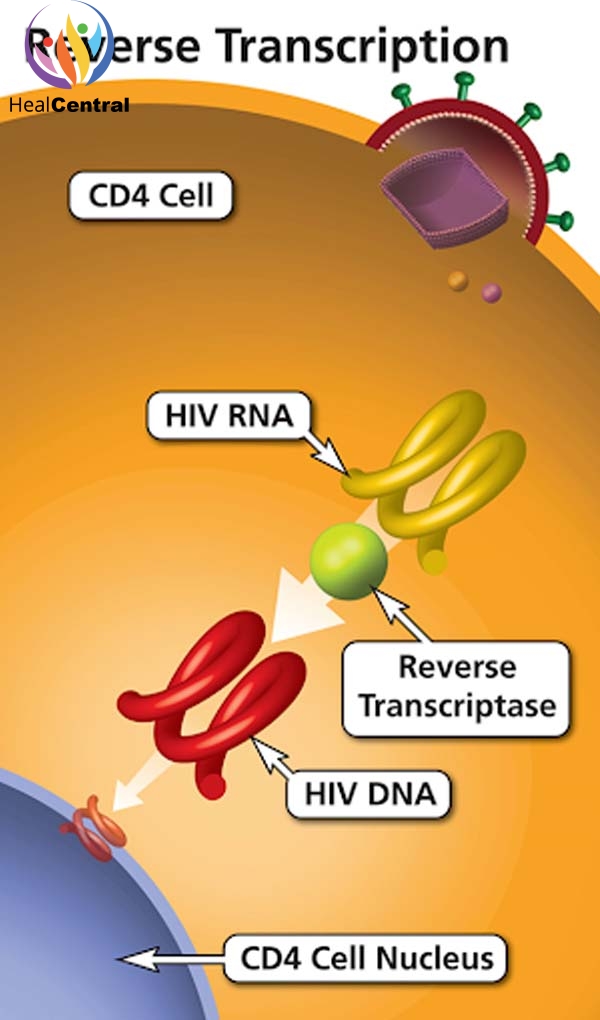
Tenofovir là một thuốc thuộc nhóm chất ức chế enzym phiên mã ngược (RT) có cấu trúc nucleoside (Nucleoside Reserve Transcriptase Inhibitors, NRTIs). RT là 1 enzym tham gia trong quá trình nhân lên của virus. Vai trò quan trọng của men RT đối với virus được thể hiện đơn giản trong hình dưới.
Khi vào trong tế bào, TDF hay TAF đều bị thủy phân tạo thành tenofovir. Sau đó tenofovir trải qua phosphoryl hóa 2 lần để tạo thành tenofovir diphosphate.
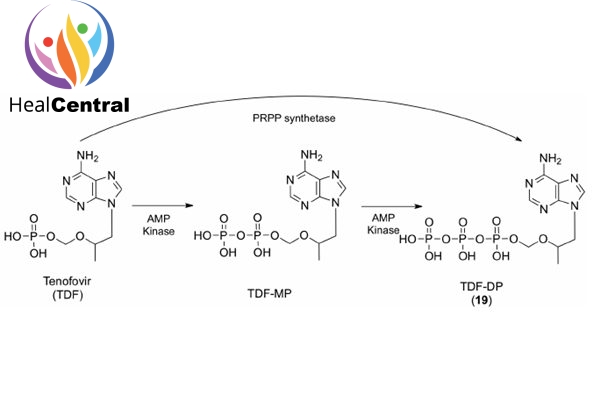
Bản thân Tenofovir trong cấu trúc đã có 1 nhóm phosphate rồi nên sau khi Phosporyl hóa 2 lần, Tenofovir Diphosphate có 3 nhóm phosphate và có cấu trúc tương tự dATP (2’-deoxyadenosine triphosphate) (hình dưới). Đây là 1 trong 4 cơ chất của men RT.
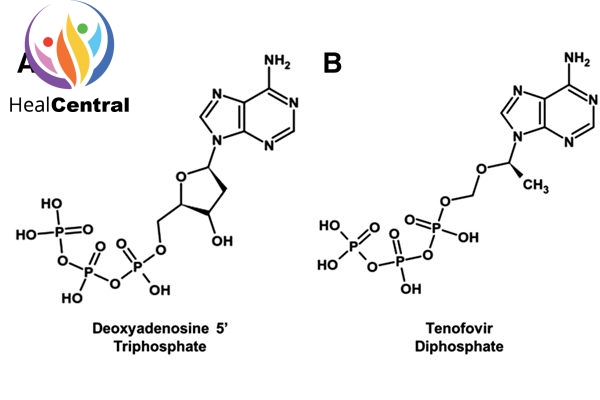
Do có sự tương đồng về cấu trúc nên tenofovir diphosphate sẽ cạnh tranh với dATP trong việc gắn với men RT. Và khi đã được lắp vào chuỗi polynucleotide đang được tồng hợp, Tenofovir Diphosphate sẽ làm dừng quá trình kéo dài chuỗi polynucleotide do trong cấu trúc phân tử của nó không có nhóm OH ở vị trí C-3’ như dATP. Như vậy, thuốc làm ngừng quá trình nhân lên của virus.
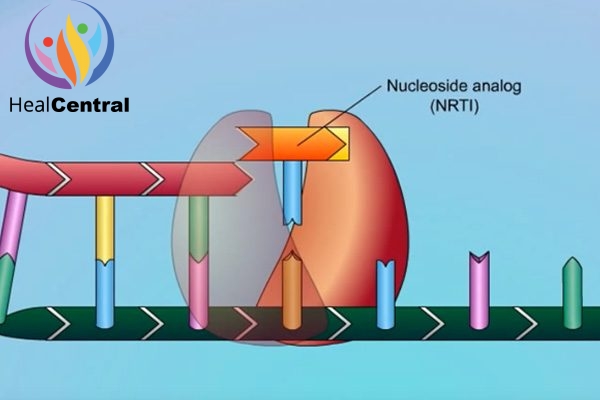
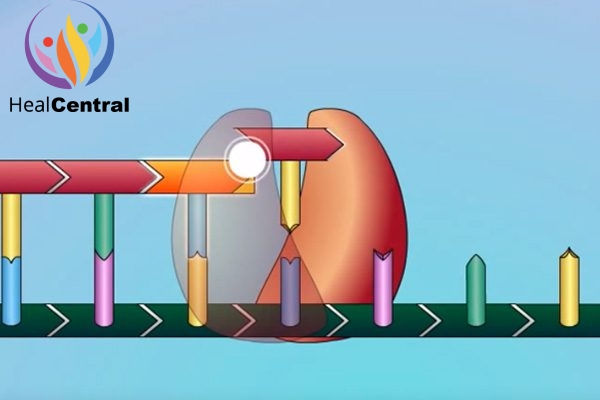
Hiện nay các đột biến kháng thuốc của virus HIV và HBV đã xuất hiện và lan rộng không chỉ với riêng Tenofovir mà còn xảy ra ở tất cả các NRTIs khác. Để tìm hiểu thêm về ý nghĩa lâm sàng của các đột biến kháng NRTIs, mời bạn đọc xem phần Tài liệu tham khảo.
Một số thử nghiệm lâm sàng
Một thử nghiệm pha 3 ngẫu nhiên trong 48 tuần của darunavir / cobicistat / emtricitabine / tenofovir alafenamide trên bệnh nhân bị HIV-1 được điều trị lần đầu của các tác giả Joseph J. Eron, Chloe Orkin, Joel Gallant, Jean-Michel Molina, Eugenia Negredo, Andrea Antinori, Anthony Mills, Jacques Reynes, Erika Van Landuyt, Erkki Lathouwers, Veerle Hufkens, John Jezorwski, Simon Vanveggel, Magda Opsomer, và thay mặt nhóm nghiên cứu AMBER để nghiên cứu hiệu quả và độ an toàn của chế độ liều dùng một viên duy nhất darunavir / cobicistat / emtricitabine / tenofovir alafenamide (D/C/F/TAF) 800/150/200/10 mg so với darunavir / cobicistat cộng với emtricitabine / tenofovir disoproxyl fumarate (TDF) (nhóm chứng) trên bệnh nhân trưởng thành nhiễm HIV-1 được điều trị lần đầu tiên.
Thiết kế: Nghiên cứu so sánh không thua kém hơn, đa trung tâm, đa quốc gia, mù đôi, đối chứng hoạt chất, ngẫu nhiên pha 3 (NCT02431247).
725 người tham gia được chọn ngẫu nhiên theo tỉ lệ 1:1 sử dụng D/C/F/TAF (362) hoặc nhóm chứng (363). Mục tiêu chính là chứng minh sự không thua kém của D/C/F/TAF so với nhóm chứng về tải lượng virus dưới 50 bản sao/mL sau 48 tuần (biên 10%).

Kết quả: Ở tuần 48, D/C/F/TAF không thua kém nhóm chứng (tương ứng 91.4% so với 88.4% đạt được tải lượng virus dưới 50 bản sao/mL; chênh lệch 2.7%; 95% CI -1.6 đến 7.1; P < 0.0001), với 4.4% so với 3.3% bệnh nhân tương ứng có tải lượng virus lớn hơn hoặc bằng 50 bản sao/mL. Không có đột biến điều trị xuất hiện liên quan đến kháng darunavir hoặc kháng TAF/TDF được quan sát ở cả hai nhóm. Một bệnh nhân (D/C/F/TAF) đã được xác định với M184I/V có khả năng kháng emtricitabine. Tỷ lệ mắc các tác dụng phụ cấp 3 và 4 (5% so với 6%), các tác dụng phụ nghiêm trọng (5% so với 6%) và dừng điều trị liên quan đến các phản ứng bất lợi (2 so với 4%) là thấp và tương tự giữa các nhóm. Tỉ lệ protein/creatinine niệu ở bệnh nhân dùng D/C/F/TAF trung bình giảm nhiều hơn so với nhóm chứng (-22.42 so với -10.34 mg/g, P = 0.033). Phần trăm thay đổi trung bình trong mật độ khoáng xương của D/C/F/TAF so với nhóm chứng là 0.21 so với -2.73%, P < 0.0001 (xương hông); -0.68 so với -2.38%, P = 0.004 (cột sống thắt lưng) và -0.26 so với -2.97%, P < 0.0001 (cổ xương đùi). Thay đổi trung bình từ đường cơ sở trong tổng tỷ lệ cholesterol / HDL-C là 0.20 so với 0.08, P = 0.036.
Kết luận: D/C/F/TAF đạt tỉ lệ ức chế virus cao (91.4%) và không thua kém darunavir/cobicistat với F/TDF. D/C/F/TAF cũng được chứng minh TAF an toàn với xương và thận khi kết hợp với darunavir/cobicistat.
Dược động học
TDF:
Hấp thu: Khả dụng sinh học (F) của thuốc là 25% khi đói và 40% khi dùng cùng bữa ăn giàu chất béo (Diện tích dưới đường cong AUC tăng khoảng 40% và nồng độ đỉnh trong huyết tương Cmax tăng khoảng 14%). Thời gian đạt nồng độ đỉnh trong huyết tương (Tmax) tương ứng với 2 trường hợp trên là 1 giờ và 2 giờ.
Phân bố: Tỉ lệ gắn protein huyết thanh dưới 7.2%, huyết tương dưới 0.7% (in vitro) với nồng độ tenofovir từ 0.01 đến 25 µg/mL. Thể tích phân bố (Vd) là 1.2-1.3 L/kg. Các mô được phân bố cao nhất là thận, gan và ruột.
Chuyển hóa: Thuốc được chuyển hóa nội bào bằng phản ứng thủy phân thành tenofovir, sau đó Tenofovir được Phosphoryl hóa 2 lần thành dạng hoạt động. Thuốc không được chuyển hóa bởi hệ enzym gan CYP450.
Thải trừ: Thời gian bán thải (t1/2) là 17 giờ. Bài xuất qua nước tiểu 70-80% nhờ quá trình lọc ở cầu thận và bài tiết ở ống thận, chủ yếu dưới dạng tenofovir không đổi. Thanh thải tổng cộng ước tính khoảng 230 mL/h/kg, thanh thải thận trung bình khoảng 160 mL/h/kg.
TAF:
Hấp thu: Thời gian đạt nồng độ đỉnh trong huyết tương (Tmax) khoảng 30 phút.
Phân bố: Tỉ lệ liên kết protein huyết tương là 80%. Trong các thử nghiệm lâm sàng, thể tích phân bố (Vd) được báo cáo là hơn 100 L.
Chuyển hóa: TDF được chuyển thành tenofovir nhờ phản ứng thủy phân chủ yếu nhờ carboxyesterase-1 (CES-1) trong tế bào gan nguyên phát. Tenofovir nội bào sau đó được phosphoryl hóa bởi các kinase tế bào thành chất chuyển hóa có tác dụng dược lí tenofovir diphosphate. Thuốc cũng được chuyển hóa bởi cathepsin A trong các tế bào đơn nhân máu ngoại vi. Chuyển hóa ở CYP3A là tối thiếu.
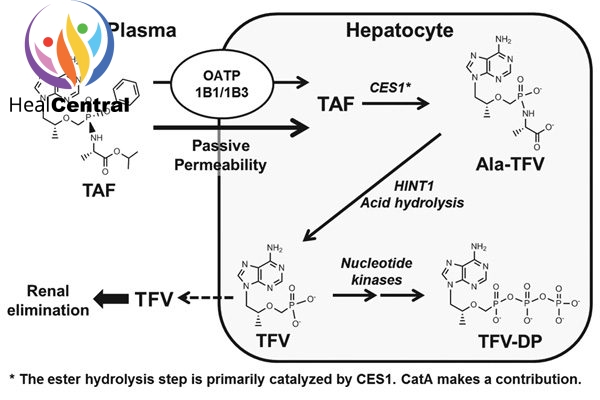
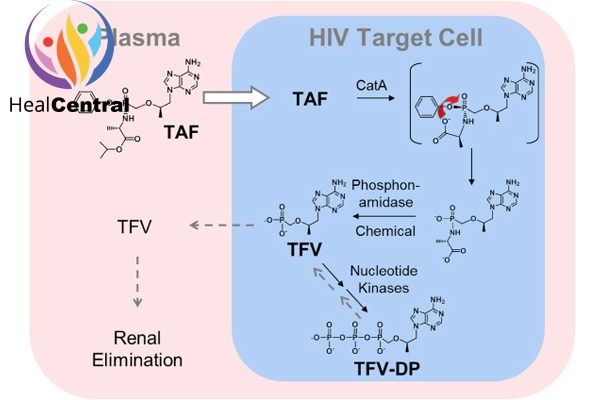
Thải trừ: Thời gian bán thải (t1/2) là 0.51 giờ. Bài xuất chủ yếu qua phân (31.7%), nước tiểu rất ít (< 1%). Tốc độ thanh thải được báo cáo là 117 L/h. Ở bệnh nhân suy thận nặng, nó có thể giảm xuống tới 61.7 L/h.
Chỉ định và liều dùng
TDF:
Nhiễm HIV:
Uống 300 mg/ngày, phối hợp với các thuốc điều trị HIV khác.
Viêm gan B mạn tính:
Uống 300 mg/ngày, phối hợp với các thuốc điều trị HBV khác.
Phòng lây nhiễm HBV từ mẹ sang con (chỉ định mồ côi).
Chỉnh liều ở bệnh nhân suy thận:
CrCl ≥ 50 mL/phút: Không cần chỉnh liều.
CrCl 30-49 mL/phút: Uống 300 mg mỗi 48 giờ.
CrCl 10-29 mL/phút: Uống 300 mg mỗi 72-96 giờ.
CrCl < 10 mL/phút: Không nghiên cứu.
Bệnh nhân chạy thận nhân tạo: Uống 300 mg mỗi 7 ngày hoặc sau mỗi tổng 12 giờ lọc máu.
TAF:
Viêm gan B mạn tính:
Chỉ định ở các bệnh nhân mắc bệnh gan còn bù, phối hợp với các thuốc điều trị HBV khác.
Uống 25 mg/ngày cùng thức ăn.
Nhiễm HIV:
- Uống 25 mg/ngày, phối hợp với các thuốc điều trị HIV khác.
- Chỉ định này không được khuyến cáo.
Chỉnh liều ở bệnh nhân suy thận:
- Bệnh nhân suy thận nhẹ, vừa hoặc nặng: Không cần chỉnh liều.
- Bệnh thận giai đoạn cuối (CrCl < 15 mL/phút): Không nên sử dụng ở những bệnh nhân không được chạy thận nhân tạo. Ở những bệnh nhân được chạy thận nhân tạo, dùng thuốc sau khi hoàn thành lọc máu.
Chỉnh liều ở bệnh nhân suy gan:
- Bệnh nhân suy gan nhẹ (tiêu chuẩn Child-Pugh A): Không cần chỉnh liều.
- Bệnh gan mất bù (tiêu chuẩn Child-Pugh B hoặc C): Không nên sử dụng.
Tác dụng phụ của thuốc Tenofovir

TDF:
Rất thường gặp (> 10%):
Suy nhược (11%).
Tiêu chảy (16%).
Buồn nôn (11%).
Đau (12%).
Thường gặp (1-10%):
Rối loạn tiêu hóa: Chán ăn, khó tiêu, nôn, đầy hơi, đau bụng.
Rối loạn thần kinh: Đau đầu, trầm cảm, bệnh lý thần kinh ngoại biên.
Đau cơ.
Dị ứng: Phát ban.
Giảm bạch cầu trung tính.
Tăng transaminase.
TAF:
Rất thường gặp (> 10%):
Đau đầu (9-12%).
Giảm mật độ xương (5-11%).
Thường gặp (1-10%):
Rối loạn tiêu hóa: Đau bụng (7-9%), buồn nôn (6%), tiêu chảy (5%), khó tiểu (5%).
Rối loạn thần kinh: Mệt mỏi (6%)
Ho (8%).
Rối loạn chức năng gan: ALT > 5 x ULN (8%), AST > 5 x ULN (3%).
Đau lưng (6%), đau khớp (5%).
Rối loạn chuyển hóa: LDL-C (khi đói) > 190 mg/dL (6%), gkucose niệu.
Creatine kinase ≥ 10 x ULN (3%).
Amylase huyết thanh > 2 x ULN (3%).
Tần số không xác định: Đợt cấp tính nặng của viêm gan B ở bệnh nhân nhiễm HBV.
Báo cáo hậu mãi (Postmarketing Reports):
Rối loạn da và mô dưới da: Phù mạch, mày đay.
Lưu ý và thận trọng
Thận trọng với phụ nữ mang thai và đang cho con bú.
Các đợt cấp tính nghiêm trọng của viêm gan B ở bệnh nhân nhiễm HBV đã được báo cáo khi họ dừng điều trị viêm gan B. Cần theo dõi chức năng gan chặt chẽ ở những bệnh nhân này ít nhất vài tháng sau khi dừng điều trị.
Nhiễm toan lactic và gan nhiễm mỡ nặng (bao gồm cả trường hợp tử vong) đã được báo cáo với tất cả các thuốc NRTIs.
Hội chứng phục hồi miễn dịch có thể xảy ra.
TDF:
Gây ra sự phân bố lại hoặc tích tụ mỡ trong cơ thể, gây hội chứng kiểu Cushing.
TDF chỉ nên được sử dụng ở những bệnh nhân đồng nhiễm HIV và HBV để hạn chế sự kháng thuốc.
Độc tính trên thận:
Tăng nguy cơ suy thận. Uớc tính CrCl của tất cả các bệnh nhân trước khi bắt đầu điều trị. Tránh sử dụng cùng các thuốc độc với thận.
Hội chứng Fanconi.
Theo dõi thường xuyên CrCl và phospho huyết thanh.
Các trường hợp cụ thể cần chỉnh liều: Xem phần 5.
Độc tính trên xương:
Có thể giảm mật độ xương.
Nhuyễn xương liên quan đến bệnh lí ống lượn gần. Có thể biểu hiện là đau xương, đau tứ chi, nguy cơ gãy xương.
TAF:
TAF không được khuyến cáo cho điều trị HIV-1. Xét nghiệm HIV trước khi điều trị.
TAF cũng có độc tính trên thận và xương nhưng ít hơn TDF.
Tương tác thuốc
TDF:
Phối hợp với didanosine: Nồng độ didanosine huyết tương tăng lên. Xem xét giảm liều và theo dõi chặt chẽ độc tính của didanosine.
Phối hợp với atazanavir: Nồng độ atazanavir huyết tương giảm đi. Khi phối hợp TDF với atazanavir, cần dùng thêm ritonavir.
Phối hợp với các thuốc ức chế protease HIV-1 hoặc các thuốc điều trị HCV: Nồng độ tenofovir huyết tương tăng lên, quan sát độc tính của tenofovir.
TAF:
P-gp và BCRP:
Các thuốc ảnh hưởng mạnh đến các chất vận chuyển này có thể làm thay đổi hấp thu TAF.
Các thuốc ảnh hưởng đến P-gp dẫn đến giảm hấp thu TAF và nồng độ huyết tương của nó, có thể dẫn đến giảm hiệu quả điều trị (ví dụ: carbamazepine, oxcarbazepine, phenobarbital, phenytoin, rifabutin, rifampin, rifapentine, hoạt chất từ cây Hypericum perforatum).
Các thuốc ức chế P-gp và BCRP có thể làm tăng hấp thu TAF và nồng độ của nó trong huyết tương.
Các thuốc ảnh hưởng đến chức năng thận:
TDF hay TAF khi dùng đồng thời với các thuốc làm giảm chức năng thận hoặc cạnh tranh bài tiết ở ống thận có thể làm tăng nồng độ tenofovir huyết tương, làm gia tăng các phản ứng bất lợi. Điều này đặc biệt thấy rõ ở TDF.
Ví dụ: acyclovir, cidofovir, ganciclovir, valacyclovir, valganciclovir, aminoside, sử dụng NSAIDs liều cao hoặc kéo dài.
Chống chỉ định
Quá mẫn cảm với tenofovir hoặc bất cứ thành phần nào của thuốc.
Tài liệu tham khảo:
https://www.medscape.com/viewarticle/740372_4
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6039393/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5513124/
https://clinicaltrials.gov/ct2/show/NCT01940341