Bài viết Tăng CO2 máu nặng và kết cục của bệnh nhân ARDS trung bình và nặng thở máy được BS. Đặng Thanh Tuấn dịch từ bài viết gốc: Severe hypercapnia and outcome of mechanically ventilated patients with moderate or severe acute respiratory distress syndrome
1.Tóm tắt
1.1 Mục đích
Để phân tích mối quan hệ giữa tăng CO2 máu phát triển trong vòng 48 giờ đầu tiên sau khi bắt đầu thở máy và kết cục ở bệnh nhân ARDS.
1.2 Bệnh nhân và phương pháp
Chúng tôi đã thực hiện phân tích thứ cấp của ba nghiên cứu thuần tập không can thiệp, tập trung vào bệnh nhân ARDS từ 927 đơn vị chăm sóc đặc biệt (ICU) ở 40 quốc gia. Những bệnh nhân này nhận được thông khí cơ học trong hơn 12 giờ trong thời gian 1 tháng vào năm 1998, 2004 và 2010. Chúng tôi đã sử dụng hồi quy logistic đa biến và phân tích điểm số xu hướng để kiểm tra mối liên hệ giữa tăng CO2 máu và tử vong ICU.
1.3 Kết quả chính
Chúng tôi nhận 1899 bệnh nhân ARDS trong nghiên cứu này. Mối quan hệ giữa PaCO2 tối đa trong 48 giờ đầu và tử vong cho thấy tỷ lệ tử vong cao hơn tại PaCO 2 ≥ 50 mmHg. Bệnh nhân bị tăng CO2 máu nặng (PaCO2 ≥ 50 mmHg) có tỷ lệ biến chứng cao hơn, suy cơ quan nhiều hơn và kết quả tồi tệ hơn.
Sau khi điều chỉnh theo tuổi, số điểm SAPS II, tần số thở, PEEP, tỷ lệ PaO2/FiO2, áp lực đẩy, chiến lược giới hạn áp lực/thể tích (PLS, pressure/volume limitation strategy), thông khí phút đã chỉnh sửa và sự hiện diện của toan máu, tăng CO2 máu nặng liên quan đến tăng nguy cơ tử vong do ICU [tỷ lệ chênh (OR) 1,93, khoảng tin cậy 95% (CI) 1,32 đến 2,81; p = 0,001]. Ở những bệnh nhân bị tăng CO2 máu nặng phù hợp với tất cả các biến khác, thông khí với PLS có liên quan đến tử vong ICU cao hơn (OR 1.58, CI 95% 1.04–2.41; p = 0.032).
1.4 Kết luận
Tăng CO2 máu nặng dường như liên quan độc lập với tỷ lệ tử vong ICU cao hơn ở bệnh nhân ARDS.
2. Giới thiệu
Thông khí cơ học (MV) với thể tích khí lưu thông cao đã được chứng minh là nguyên nhân và làm trầm trọng thêm chấn thương phổi [1-3]. Hickling et al. [4] báo cáo rằng trong MV của hội chứng suy hô hấp cấp tính (ARDS), giới hạn áp lực đường thở < 30 cmH2O có liên quan đến tỷ lệ tử vong thấp hơn ở những bệnh nhân bị tổn thương phổi cấp tính.
Giới hạn thể tích khí lưu thông và áp lực đường thở hiện được sử dụng như một chiến lược bảo vệ phổi trong MV ở bệnh nhân ARDS. Tuy nhiên, chiến lược này đôi khi có thể dẫn đến áp lực riêng phần của carbon dioxide trong máu động mạch (PaCO2) cao [5, 6].
Vào đầu những năm 1990, khái niệm về tăng CO 2 máu cho phép (permissive hypercapnia) đã được đề xuất cho những bệnh nhân bị chấn thương phổi cấp tính. Trong nghiên cứu ARDS Network so sánh thể tích khí lưu thông thấp và cao [7], bệnh nhân trong nhóm thể tích khí lưu thông thấp chỉ có những thay đổi nhỏ ở PaCO 2 (35 ± 8 so với 40 ± 10 mmHg), có thể do tần số thở cao hơn trong nhóm đó. Ngoài ra, trong các mô hình thí nghiệm về tổn thương phổi cấp tính do nhiễm trùng huyết, có báo cáo về tác dụng có lợi của nhiễm toan tăng CO2 máu [8, 9].
Nó thậm chí còn gợi ý rằng “tăng CO2 máu điều trị” – “therapeutic hypercapnia” – có thể có lợi [10–12]. Tuy nhiên, nhiều nghiên cứu gần đây đã báo cáo rằng tăng CO2 máu có tác dụng có hại, bao gồm suy giảm chức năng biểu mô phế nang, tăng sinh tế bào, và chức năng cơ cũng như chức năng bạch cầu trung tính và miễn dịch bẩm sinh [13–21]. Tăng CO2 máu cấp tính cũng có thể có hậu quả huyết động đáng kể và dẫn đến tăng áp phổi, rối loạn chức năng tâm thất phải, và rò rỉ phế quản – màng phổi kéo dài [22].
Theo quan điểm của mô hình phổ biến về khả năng chịu đựng chứng tăng CO 2 máu ở bệnh nhân ARDS và các báo cáo mâu thuẫn gần đây về tác dụng sinh học của tăng CO2 máu, chúng tôi đã tìm cách đánh giá tác động của PaCO 2 cao lên kết cục của chăm sóc đặc biệt (ICU) trong một nhóm bệnh nhân ARDS lớn được MV.
3. Phương pháp
3.1 Bệnh nhân
Chúng tôi đã tiến hành phân tích dữ liệu thứ cấp từ 18.302 bệnh nhân được nhận vào 927 ICU ở 40 quốc gia đã đăng ký một trong ba nghiên cứu quan sát, đa trung tâm, không can thiệp, quan sát quốc tế được thực hiện vào năm 1998, 2004 và 2010 [23-25] và đã nhận được MV cho > 12 giờ trong khoảng thời gian 1 tháng.
Ủy ban đạo đức nghiên cứu của mỗi tổ chức tham gia đã phê duyệt giao thức nghiên cứu. Với mục đích của nghiên cứu này, chúng tôi đã chọn bệnh nhân nhận MV xâm lấn trong hơn 24 giờ vì ARDS hoặc phát triển ARDS sau 24 giờ đầu tiên của MV.
ARDS được xác định theo các tiêu chuẩn do Hội nghị đồng thuận Mỹ – Châu Âu thiết lập: khởi phát cấp tính, PaO2/FiO2 < 200 mmHg, thâm nhiễm hai bên trên X quang ngực, không có suy tim và chẩn đoán ARDS của bác sĩ phụ trách. Chúng tôi coi những bệnh nhân này có ARDS trung bình hoặc nặng theo định nghĩa của Berlin.
Chúng tôi thu thập các đặc điểm cơ bản, đo khí máu động mạch đầu tiên và các thiết lập thông khí tương ứng, trao đổi khí hàng ngày, quản lý lâm sàng, và biến chứng trong khi bệnh nhân được thông khí hoặc cho đến ngày 28.
Nếu có nhiều lần đo khí máu cho cùng một bệnh nhân trong 24 giờ đầu tiên của MV, chúng tôi đã sử dụng giá trị PaCO2 tồi tệ nhất trong giai đoạn này để phân tích. Tử vong trong bệnh viện và thời gian lưu trú đã được ghi nhận.
Mô tả đầy đủ về phương pháp đã được xuất bản trước đây [25]. Mục tiêu chính của chúng tôi là đánh giá hiệu quả độc lập của PaCO 2 đối với tỷ lệ tử vong ICU ở bệnh nhân ARDS. Mục tiêu thứ yếu là xác định ảnh hưởng của PaCO2 đối với thời gian lưu trú của ICU, thời gian nằm viện và các biến chứng trong quá trình MV.
3.2 Phân tích thống kê
Dữ liệu được biểu diễn dưới dạng giá trị trung bình ± độ lệch chuẩn, giá trị trung bình với phạm vi interquartile và tỷ lệ (tần số tuyệt đối và tương đối) khi thích hợp.
Student’s t test hoặc Mann–Whitney test được sử dụng để so sánh các biến liên tục, trong khi χ2 test hoặc Fisher’s exact test được sử dụng để so sánh các tỷ lệ. Giá trị p < 0,05 được xem là có sự khác biệt có ý nghĩa thống kê.
PaCO2 tối đa trong 48 giờ đầu tiên sau khi bắt đầu MV được phân loại thành sáu nhóm (<30, 30–39, 40–49, 50–59, 60–69, và> 70 mmHg); các điểm cắt giảm (cutoffs) tương ứng với khoảng 5th, 35th, 70th, 85th và 95th của PaCO 2 cao hơn trong vòng 48 giờ sau khi chẩn đoán ARDS, tương ứng. Các nhóm có PaCO2 30–39 và 40–49 mmHg có tỷ lệ tử vong ICU thấp nhất. Các giá trị PaCO2 liên quan đến tử vong ICU tăng đáng kể được định nghĩa là “tăng CO 2 máu nghiêm trọng”.
Chúng tôi cũng thực hiện phân vùng, cho thấy ảnh hưởng của tăng CO 2 máu và giảm CO2 máu (được định nghĩa là PaCO2 > 30 mmHg) trên tử vong ICU.
Để đánh giá hiệu quả độc lập của tăng CO 2 máu trên kết quả (tỷ lệ tử vong do ICU), chúng tôi đã thực hiện một phân tích đơn biến đầy đủ về mối liên hệ giữa các biến số nghiêm trọng của bệnh và tử vong ICU. Một mô hình tối đa (maximum model) sau đó được xây dựng bằng cách thực hiện mô hình hồi quy logistic đa biến dự đoán, bao gồm tất cả các biến được chọn trong phân tích đơn biến được đo ở 80% bệnh nhân và cho thấy sự liên kết thống kê đáng kể (p < 0,10) trong phân tích đơn biến.
Do đó, mô hình cuối cùng đã được lựa chọn dựa trên diện tích cao nhất theo đường cong đặc tính hoạt động sau khi loại bỏ các biến không quan trọng. Hơn nữa, một số biến số khác đã được đưa vào mô hình đa biến để khám phá những nhiễu không lường trước có thể liên quan đến tử vong ICU, chẳng hạn như áp lực đẩy [được xác định là áp lực cao nguyên trừ áp lực dương cuối kỳ thở ra (PEEP)] và sử dụng chiến lược giới hạn áp lực/thể tích (PLS).
Điều này được xác định bằng sự đồng thuận là thể tích khí lưu thông < 8 ml/kg trọng lượng cơ thể thực tế và áp lực cao nguyên hoặc áp lực hô hấp đỉnh < 30 cmH2O [24]. Bởi vì thực hành lâm sàng liên quan đến chiến lược MV ở những bệnh nhân được chẩn đoán ARDS đã thay đổi theo thời gian, mô hình cũng đã điều chỉnh trong thời gian nghiên cứu.
Ngoài ra, vì khoảng chết liên quan chặt chẽ với tỷ lệ tử vong [26] và có thể là yếu tố gây tăng CO2 máu, chúng tôi tính toán thông khí phút được điều chỉnh (VEcorr) cho một PaCO2 bình thường (tính theo thông khí phút × PaCO2 thực tế/40 mmHg) thay thế cho khoảng chết [27] và đưa biến này như là một đồng biến vào mô hình đơn biến và đa biến. Chúng tôi đã tạo ra một đồ thị theo chiều dọc cho thấy tỷ lệ chênh lệch được điều chỉnh (OR) cho tỷ lệ tử vong ICU và PaCO2 được phân loại.
Tương tác giữa tăng CO2 máu và toan, khoảng chết, và PLS, tương ứng, được kiểm tra bằng hồi quy logistic. Chúng tôi đã xem xét giá trị p < 0,2 để hiển thị tương tác có ý nghĩa thống kê [Tài liệu bổ sung điện tử (ESM) Hình. E2]. Mối quan hệ tiềm năng phi tuyến tính của biến được kiểm tra bằng cách sử dụng các đa thức phân đoạn. Các lỗi tiêu chuẩn được tính toán bằng cách lấy 1000 bootstrap như một phân tích xác thực.
Phân tích độ nhạy và khám phá hiệu quả của tăng CO2 máu cao dưới điều kiện lâm sàng không thuận lợi nhất hiện diện ở những bệnh nhân được thông khí bảo vệ, nơi phát triển tăng CO2 máu có thể là điểm đánh dấu mức độ nghiêm trọng với ảnh hưởng mâu thuẫn (contradictory effect) với tỷ lệ tử vong do ICU như một biến nhiễu, chúng tôi đã sử dụng hồi quy logistic để phát triển một mô hình điểm số xu hướng để ước lượng mối quan hệ giữa tăng CO2 máu nặng và tử vong ICU ở bệnh nhân MV với VT < 8 ml/kg.
Tỷ lệ log của xác suất mà một bệnh nhân bị tăng CO2 máu nặng (logit) được mô hình hóa như là một chức năng của những yều tố gây nhiễu bằng hồi quy logistic mà chúng tôi đã xác định và đưa vào tập dữ liệu của chúng tôi. Sau đó, chúng tôi thực hiện phân tích đối sánh một-một mà không thay thế trên cơ sở điểm số ước lượng xu hướng (khả năng phát triển chứng tăng CO2 máu cao nghiêm trọng) của từng bệnh nhân.
Thuật toán kết hợp lân cận gần nhất được sử dụng để khớp với bệnh nhân dựa trên trạng thái tăng CO2 máu (hiện tại hoặc vắng mặt) và logit của điểm số xu hướng của chúng, với sự phù hợp xảy ra nếu chênh lệch về điểm số xu hướng < 0,2 lần độ lệch chuẩn của logit (chiều rộng caliper). Chúng tôi đã chọn 0,2 vì giá trị này đã được chứng minh là loại bỏ khoảng 90% độ lệch trong các nhiễu đã quan sát [28]. Chúng tôi ước tính sự khác biệt tiêu chuẩn cho tất cả các biến số trước và sau khi kết hợp, với sự khác biệt tiêu chuẩn ≥ 10% được coi là dấu hiệu của sự mất cân bằng [29].
Tất cả các phân tích tiếp theo được thực hiện trong mẫu phù hợp, sử dụng các phương pháp thích hợp để phân tích dữ liệu phù hợp để ước tính hiệu quả điều trị trung bình như sự khác biệt về kết cục (tử vong ICU) trong nhóm phơi nhiễm (tăng CO2 máu nặng) và nhóm chưa kết hợp tăng CO2 máu) [30].
Chúng tôi đã tính toán các lỗi chuẩn được khởi động để tạo ra khoảng tin cậy (CI) 95%. Sau khi kết hợp, các biến hiển thị kết quả không cân bằng (được định nghĩa là chênh lệch chuẩn hóa > 10%) được đưa vào điểm số xu hướng là các thuật ngữ phi tuyến tính. Nếu các biến này giữ mức chênh lệch tiêu chuẩn > 10%, mô hình phương trình ước lượng tổng quát được trang bị thêm chúng.
Các phân tích thống kê được thực hiện bằng phần mềm IBM SPSS (ver. 21.0; IBM Corp., Armonk, NY) và Stata (ver.1.1.1; StataCorp LP, College Station, TX).
4. Kết quả
Nhìn chung, có 1899 bệnh nhân ARDS được đưa vào phân tích. Hình 1 cho thấy biểu
đồ dòng nghiên cứu.

4.1 Giá trị của PaCO2 trong vòng 48 giờ đầu tiên của MV và tử vong ICU
Tỷ lệ tử vong cao hơn đáng kể ở những bệnh nhân có PaCO2 tối đa ≥ 50 mmHg trong 48 giờ đầu tiên của MV so với bệnh nhân có PaCO 2 tối đa < 50 mmHg (Bảng 1; ESM Hình. E1). Để xác minh kết quả này, chúng tôi đã thực hiện hồi quy logistic với dữ liệu được điều chỉnh theo độ tuổi, điểm số sinh lý đơn giản (SAPS) II tại ICU, tỷ lệ PaO2/FiO2, PEEP, tần số thở, nhiễm toan, sử dụng PLS trong lần đầu tiên 48 giờ sau khi bắt đầu MV và thời gian nghiên cứu, sử dụng PaCO 2 40–49 mmHg làm danh mục tham chiếu. Phân tích này xác nhận tỷ lệ tử vong ICU cao hơn đáng kể với giá trị PaCO2 tối đa cao hơn (Hình 2).
![Hình 2: Hiệu quả điều chỉnh của PaCO 2 lúc 48 giờ kể từ khi bắt đầu MV đến tử vong ở đơn vị chăm sóc đặc biệt (ICU). Mỗi hình vuông màu đen đại diện cho tỷ lệ chênh lệch cho mỗi khoảng thời gian PaCO2 được điều chỉnh theo tuổi, Điểm số sinh lý cấp II đơn giản, PaO 2/FiO2, chiến lược giới hạn áp lực/thể tích, tần số thở, sự hiện diện của nhiễm toan, khoảng chết và năm nghiên cứu, các đường thẳng đứng [Khoảng tin cậy 95%], ngưỡng dòng nằm ngang giữa các chênh lệch không đáng kể và có ý nghĩa thống kê (tỷ lệ chênh = 1).](https://www.healcentral.org/wp-content/uploads/2021/02/b1_anh_2.jpg)
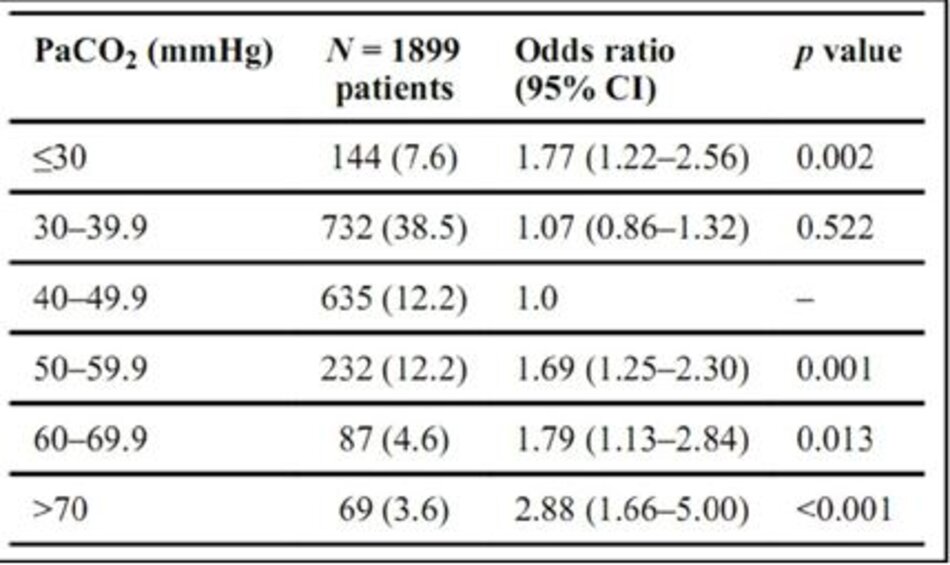
Do đó, chúng tôi đã định nghĩa “tăng CO 2 máu cao” là PaCO2 ≥ 50 mmHg. Nhìn chung, tỷ lệ tử vong do ICU cho bệnh nhân trong phân tích là 53% (999/1899).
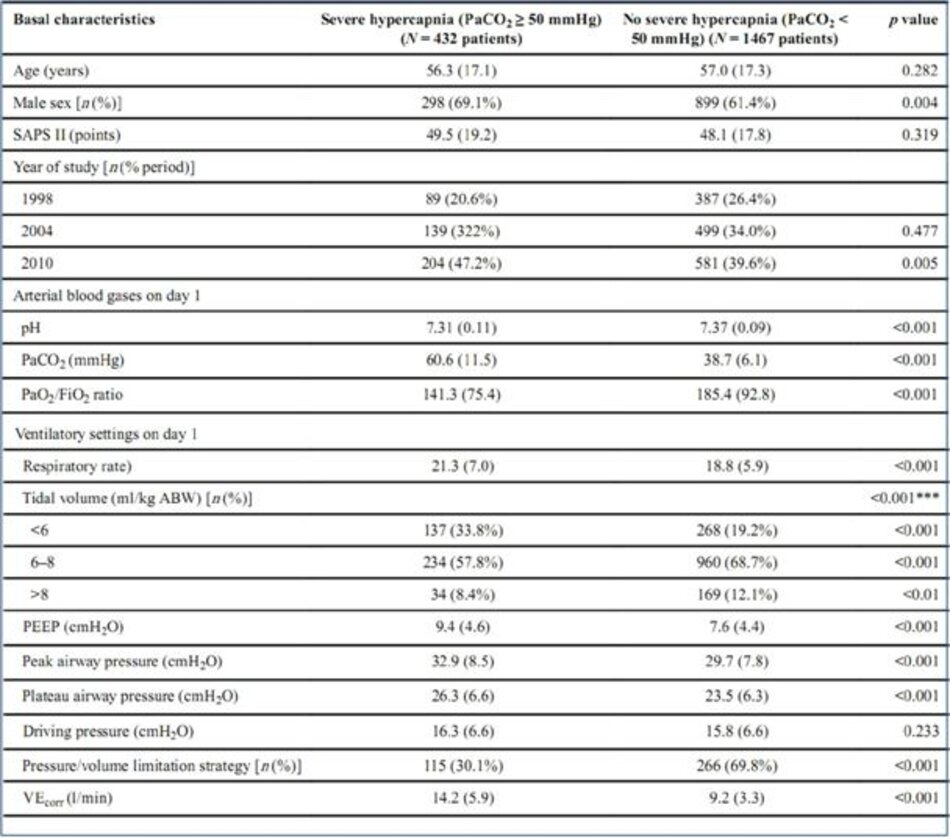
4.2 Đặc điểm lâm sàng của bệnh nhân tăng CO2 máu nặng
Bệnh nhân bị tăng CO2 máu cao nặng có nhiều khả năng là nam giới hơn. Tăng CO2 máu cao nặng thường gặp hơn ở bệnh nhân ARDS trong hai giai đoạn cuối (1998 so với năm 2004, p < 0,01; 1998 so với năm 2010, p < 0,001) và cao hơn trong giai đoạn trước (2004 so với năm 2010, p < 0,01). Tỷ lệ PaO2/FiO2 thấp hơn đáng kể ở những bệnh nhân bị tăng CO2 máu nặng và áp lực đường thở đỉnh, áp lực đường thở cao nguyên và PEEP cao hơn ở những bệnh nhân bị tăng CO2 máu nặng (Bảng 2).
4.3 Các sự kiện lâm sàng trong quá trình thực hiện MV và kết quả
Bệnh nhân bị tăng CO2 máu nặng có nhiều biến chứng và rối loạn chức năng cơ quan nhiều hơn trong quá trình điều trị MV so với những người không tăng CO 2 máu nặng, bao gồm cả rối loạn nhịp tim, rối loạn chức năng thận và rối loạn chức năng tim mạch (Bảng 3).
Phân tích đơn biến về mối liên hệ giữa các biến số nghiêm trọng của bệnh và kết quả lâm sàng (tình trạng xuất viện ICU) cho thấy giá trị PaCO2 cao hơn đáng kể ở những người không sống sót hơn so với những người sống sót (ESM Table E1).
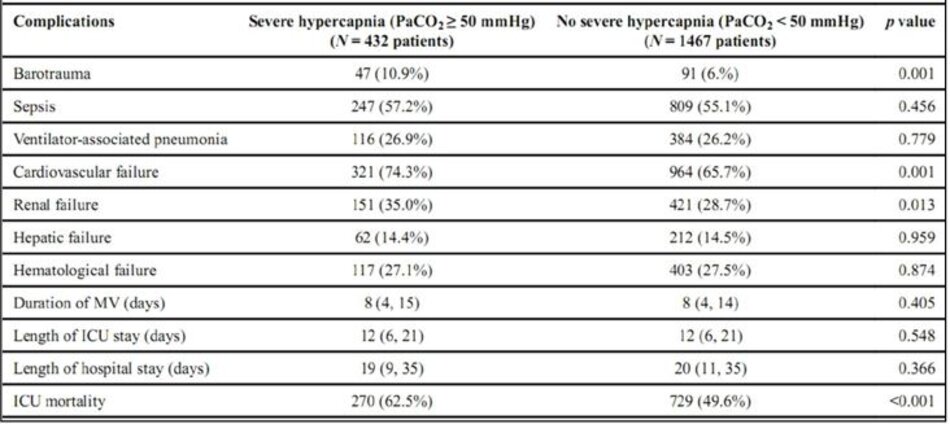
Bệnh nhân có và không có tăng CO2 máu nặng có thời gian MV và thời gian nằm ICU tương tự (Bảng 3). Tỷ lệ tử vong ICU thô cao hơn đáng kể ở những bệnh nhân bị tăng CO2 máu nặng hơn ở những bệnh nhân không tăng CO2 máu nặng (62,5% so với 49,6%).
4.4 Mối liên hệ giữa tăng CO2 máu và tử vong ICU
Trong phân tích đơn biến, chứng tăng CO2 máu nặng có liên quan đến tăng nguy cơ tử vong do ICU (OR 1,68, KTC 95% 1,35–2,10; p ≤ 0,001). Sau khi điều chỉnh các biến cơ sở, bao gồm tuổi, SAPS II tại nhập viện ICU, VEcorr, sử dụng PLS, sự hiện diện của toan, áp lực, tỷ lệ PaO2/FiO2 và thời gian nghiên cứu, sự hiện diện của tăng CO2 máu cao vẫn độc lập liên quan với nguy cơ tử vong ICU cao hơn (OR 1,93, KTC 95% 1,32–2,81; p = 0,001) (Bảng 4). Hiệu ứng được nhất quán lấy PaCO 2 như là một biến liên tục và điều chỉnh cho cùng các biến số như trên (Hình 2).
Quan trọng hơn, nhiễm toan hoặc sự kết hợp của tăng CO2 máu và toan độc lập làm tăng nguy cơ tử vong ICU, mặc dù không có sự tương tác có ý nghĩa thống kê giữa hai yếu tố này được xác định (p = 0,28; ESM Hình E2). Chúng tôi thấy không có sự tương tác đáng kể với PLS hoặc VEcorr (p = 0,28 và p = 0,64, tương ứng).
Dựa trên ảnh hưởng của nhiễm toan đến tăng CO2 nặng và tử vong do ICU, cuối cùng chúng tôi đã phát triển mô hình logistic nhị thức điều chỉnh bao gồm tất cả các biến trước đó (tuổi, SAPS II tại ICU, PEEP, VEcorr, chiến lược thông khí LPS, áp lực đẩy, tần số thở, tỷ lệ PaO2/FiO2, suy huyết học và thời gian nghiên cứu). Chúng tôi bỏ qua tình trạng nhiễm toan để tránh bị điều chỉnh quá mức vì sự tương tác giữa acidosis và tăng CO2 máu.
Mô hình chỉ ra rằng chứng tăng CO2 máu nặng có liên quan rõ rệt và độc lập với nguy cơ tử vong do ICU cao hơn (OR 2.40, KTC 95% 1.67–3.46; p <0.001) (ESM Tables E2 và E3).
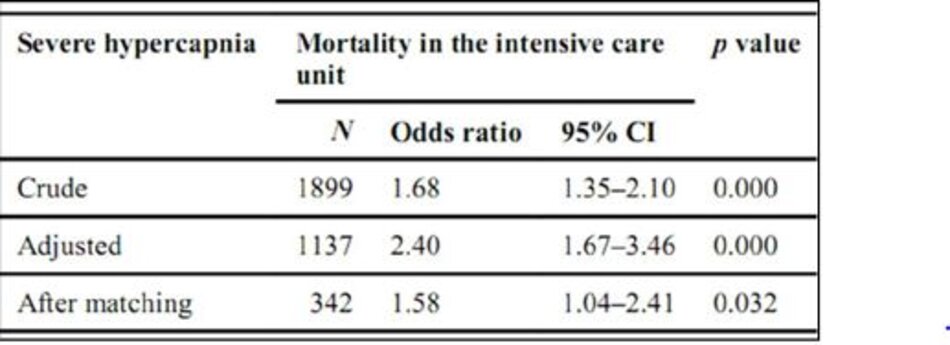
Sau khi so sánh điểm số xu hướng (xem ESM Bảng E4 và ESM Hình. E3 về chất lượng của quá trình so khớp), có sự khác biệt đáng kể về ảnh hưởng của tăng CO2 máu nặng lên tử vong ICU giữa bệnh nhân nhận thể tích thủy < 8 ml/kg (n = 344) và những người nhận được thể tích khí lưu thông > 8 ml/kg (tỷ lệ tử vong ICU có nguy cơ điều chỉnh: OR 1,58, KTC 95% 1,04–2,41; p = 0,032).
5. Thảo luận
Sau nhiều lần điều chỉnh và phân tích xu hướng, chúng tôi thấy rằng chứng tăng CO2 máu cao nghiêm trọng liên quan đến tỷ lệ tử vong do ICU, với tỷ lệ rối loạn chức năng cơ quan cao hơn và nhiều biến chứng hơn trong MV ở những bệnh nhân ARDS vừa hoặc nặng. Những phát hiện này có thể có những tác động lâm sàng.
Sự liên quan giữa tăng CO2 máu và biến chứng trong MV trong các phân tích không điều chỉnh có thể là một chức năng của tổn thương phổi nặng hơn, nhưng sau khi điều chỉnh đa biến tăng CO2 máu vẫn liên quan đến tử vong ICU ở bệnh nhân ARDS.
Việc sử dụng tăng CO2 máu cho phép dựa trên các báo cáo quan sát trong những năm 1990 cho thấy rằng lượng khí lưu thông thấp hơn trong MV có liên quan đến sự sống còn tốt hơn. Tuy nhiên, không có nghiên cứu độc lập nào về tác dụng cụ thể của tăng CO2 máu bằng kết quả được thực hiện [4, 5].
Trong một nghiên cứu sau này của 49 trẻ sinh non, không có sự khác biệt về tỷ lệ tử vong giữa bệnh nhân bị tăng CO2 máu và những người CO2 máu bình thường [30], dẫn đến kết luận rằng tăng CO2 máu cho phép là an toàn nhưng không bảo vệ.
Trong phân tích dữ liệu thứ cấp từ nghiên cứu ARDSNet [31], các tác giả báo cáo rằng sự hiện diện của nhiễm toan tăng CO2 máu (được xác định là pH < 7,35 và PaCO2 > 45 mmHg) tại thời điểm ngẫu nhiên, dựa trên phân tích hồi quy logistic đa biến và kiểm soát các bệnh đi kèm khác và mức độ nghiêm trọng của chấn thương phổi, kết hợp với tỷ lệ tử vong thấp hơn 28 ngày chỉ ở những bệnh nhân được phân ngẫu nhiên thành thể tích khí lưu thông 12 ml/kg.
Các tác giả thấy không có ảnh hưởng đến tỷ lệ tử vong ở những bệnh nhân được phân ngẫu nhiên đến 6 ml/kg thể tích khí lưu thông. Nghiên cứu này bị giới hạn bởi số lượng nhỏ bệnh nhân có trong mỗi phân nhóm và cho thấy không có sự khác biệt ở bệnh nhân “thông khí bảo vệ”, nơi dự đoán chứng tăng CO2 máu.
Trong nghiên cứu của chúng tôi, bệnh nhân nhận được thông khí bảo vệ phổi với thể tích khí lưu thông ≤ 6 ml/kg trọng lượng cơ thể thực tế đã có tỷ lệ cao tăng CO 2 máu nặng (Bảng 2) do thể tích khí lưu thông thấp hơn và sau đó giảm thông khí phế nang.
Các khu vực thông khí/tưới máu cao (V/Q) và khoảng chết cao hơn cũng có thể làm tăng mức độ tăng CO 2 máu do chấn thương phổi nặng hơn (Bảng 2). Một mối tương quan giữa khoảng chết cao và tử vong đã được tìm thấy ở bệnh nhân ARDS [26].
Do đó, trong phân tích của chúng tôi, chúng tôi đã sử dụng “thông khí phút được điều chỉnh” (VEcorr) làm đại diện cho khoảng chết [27] và thấy rằng ngay cả sau khi điều chỉnh cho VEcorr, tăng CO2 máu nặng vẫn liên quan chặt chẽ đến tỷ lệ tử vong. Hơn nữa, Brown et al. [32] cho thấy rằng một phút thông khí > 13,9 lít/phút là một yếu tố dự báo quan trọng về tử vong tại bệnh viện sau 90 ngày trong chấn thương phổi cấp tính, tương tự như kết quả của chúng tôi (> 14 lít/phút).
Các nghiên cứu ban đầu về các mô hình động vật gây tổn thương phổi và nhiễm trùng do thở máy đã báo cáo tác dụng có lợi của chứng tăng CO 2 máu, hỗ trợ khái niệm “tăng CO2 máu cho phép” cho bệnh nhân bị chấn thương phổi [8, 9]. Các nghiên cứu gần đây đã báo cáo rằng mức độ cao của PaCO 2 kích hoạt các đường truyền tín hiệu cụ thể, độc lập với pH hoặc các loại oxy phản ứng, dẫn đến suy giảm chức năng phổi [19, 33, 34].
Hơn nữa, trong một mô hình tổn thương phổi do máy thở gây ra, xác suất sửa chữa vết thương đã giảm đáng kể trong điều kiện tăng CO 2 máu [9]. Khái niệm này được khám phá sâu hơn trong một nghiên cứu mà chứng tăng CO2 máu gây stress cho ty thể thông qua sự kích hoạt của microRNA (miR)-183, bằng cách khử isocitrate dehydrogenase 2 có tác động bất lợi đến sự tăng sinh tế bào, có thể giải thích việc sửa chữa vết thương bị suy yếu [18, 19].
Tăng CO2 máu cũng làm suy giảm miễn dịch bẩm sinh trong Drosophila melanogaster [16] bằng cách giảm sự biểu hiện của các peptide kháng khuẩn, và chứng tăng CO2 máu cao đã được quan sát để tăng tỷ lệ tử vong trong một mô hình chuột bị viêm phổi Pseudomonas aeruginosa [20].
Ngoài ra, nồng độ CO2 cao đã được tìm thấy góp phần làm tăng độc lực của vi khuẩn và nấm, có thể làm cho các mô tăng CO2 máu dễ bị nhiễm trùng hơn [35-38]. Những dữ liệu này và các báo cáo gần đây khác cho thấy rằng tăng CO 2 máu làm giảm khả năng miễn dịch bẩm sinh thông qua cơ chế bảo tồn tiến hóa (evolutionarily conserved mechanisms) [17] và giải thích lý do tại sao bệnh nhân tiếp xúc với tăng CO2 máu suy giảm khả năng chống nhiễm trùng. Hơn nữa, tăng CO2 máu có hậu quả huyết động, tăng áp phổi và chức năng tâm thất phải xấu đi [38]; những tác động này có liên quan đến kết quả tồi tệ hơn ở những bệnh nhân bị thương phổi cấp tính [38–41].
Mối quan hệ giữa PaCO2 và tử vong của ICU mô tả theo đường cong hình chữ U (Hình 2). Tỷ lệ tử vong cao hơn ở mức thấp PaCO2 có thể cho thấy sự tăng thông khí tương đối và hiện diện vùng phổi với tỷ lệ V/Q cao và nguy cơ bị tổn thương phổi do máy thở. Dữ liệu gần đây cho thấy tăng CO2 máu có liên quan đến kết quả tồi tệ hơn ở bệnh nhân viêm phổi [36, 33], mặc dù không có dữ liệu từ bệnh nhân ARDS.
Nghiên cứu của chúng tôi cung cấp thông tin mới cho thấy tăng CO 2 máu dường như độc lập với kết cục xấu hơn ở bệnh nhân ARDS. Phát hiện này đặt ra câu hỏi liệu mô hình được đề xuất trước đó rằng tăng CO 2 máu có tác dụng bảo vệ ở những bệnh nhân bị chấn thương phổi là an toàn, ít nhất là trên một phạm vi nhất định.
Nghiên cứu của chúng tôi là một cuộc khảo sát đa quốc gia phản ánh thực hành MV trên toàn thế giới trong bối cảnh thực tế. Hơn nữa, thiết kế phi can thiệp tiền cứu phát hiện, lần đầu tiên, một mối liên hệ độc lập giữa tăng CO 2 máu nặng và tử vong ICU của bệnh nhân ARDS thở máy từ ICU ở 40 quốc gia. Tuy nhiên, nghiên cứu cũng có một số hạn chế. Đầu tiên, dữ liệu thu được từ một nghiên cứu quan sát không được thiết kế chủ yếu để kiểm tra một giả thuyết cụ thể.
Chỉ có 1899 trong tổng số 18.302 bệnh nhân được phân tích (chỉ có bệnh nhân ARDS được công nhận), và số lượng bệnh nhân trong loại tăng PaCO2 máu khá nhỏ. Hơn nữa, khí máu động mạch và các thông số tương tác của bệnh nhân – máy thở được ghi nhận một lần mỗi ngày, và một phép đo duy nhất mỗi ngày có thể không đủ để phản ánh sự tiến triển hô hấp đầy đủ trong cả ngày. Tuy nhiên, việc thu thập dữ liệu luôn được thực hiện cùng một lúc trong ngày. Nhiều bệnh nhân phải được loại trừ khỏi phân tích vì dữ liệu khí máu động mạch bị thiếu (11,5%; 2114/18,302 bệnh nhân được chọn).
Một hạn chế khác là không có đánh giá huyết động. Cuối cùng, các suy luận nhân quả có thể rút ra từ các nghiên cứu quan sát chắc chắn sẽ bị hạn chế. Mặc dù điều chỉnh oxy hóa và sử dụng một đại diện cho khoảng chết, những yếu tố gây nhiễu không được đo lường có thể ảnh hưởng đến mối quan hệ giữa tăng CO2 máu và tử vong ICU. Bằng cách kết hợp các bệnh nhân được thông khí với thể tích khí lưu thông < 8 ml/kg, chúng tôi thực hiện phù hợp với điểm số xu hướng như là một phân tích độ nhạy và hiệu quả của chứng tăng CO 2 máu cao nghiêm trọng là phù hợp.
Chúng tôi đã khám phá sự tương tác giữa chiến lược PLS và khoảng chết, và bệnh nhân ARDS bị tăng CO2 máu vẫn cho thấy tử vong ICU cao hơn. Chúng tôi đã phát hiện một hiệu ứng nhất quán của chứng tăng CO 2 máu nặng sau khi loại bỏ những yếu tố gây nhiễu đã biết, chẳng hạn như sự hiện diện của nhiễm toan hoặc chiến lược thông khí bảo vệ.
Ngoài ra, một tác dụng độc hại có hại của nhiễm toan trên tử vong ICU đã được quan sát, mặc dù hiệu quả độc lập của chứng tăng CO2 máu nghiêm trọng vẫn còn ngay cả ở những bệnh nhân ARDS đã phát triển chứng nhiễm toan. Do đó, nguy cơ tử vong do ICU điều chỉnh ở những bệnh nhân ARDS bị tăng CO2 máu không bao gồm sự hiện diện của nhiễm toan để tránh điều chỉnh quá mức [34].
Tóm lại, kết quả trong các nhóm bệnh nhân thở máy ARDS này cho thấy chứng tăng CO2 máu cao trong vòng 48 giờ đầu tiên của MV có liên quan độc lập với tỷ lệ tử vong do ICU cao hơn. Dữ liệu của chúng tôi cũng cho thấy rằng những bệnh nhân này có nhiều biến chứng liên quan đến máy thở.
Bất chấp những nỗ lực của chúng tôi để điều chỉnh các yếu tố liên quan đến chuỗi nhân quả giữa tăng CO2 máu nặng và tử vong ICU, chúng tôi không thể loại trừ sự hiện diện của những yếu tố gây rối không được đo lường, phát sinh từ thiết kế nghiên cứu quan sát và không can thiệp có thể ảnh hưởng đến kết quả.
Thật vậy, những phát hiện này phải được hiểu là một tín hiệu sinh học có thể yêu cầu xác nhận bằng các thử nghiệm lâm sàng được thiết kế đặc biệt cho mục đích này. Nhìn chung, dữ liệu được báo cáo ở đây có thể phục vụ như là một bước đầu tiên hướng tới việc xác định các giới hạn có thể cho chứng tăng CO 2 máu.
Trong trường hợp không có bằng chứng rõ ràng, các phát hiện của chúng tôi có thể cung cấp một số hướng dẫn cho các giới hạn hợp lý của PaCO2 cho bệnh nhân ARDS trong ICU và cũng để đánh giá lại tiềm năng của giả định trước rằng chứng tăng CO 2 máu cao nghiêm trọng là an toàn.
6. Take-home message
Chứng tăng CO2 máu nặng có vẻ liên quan độc lập với tỷ lệ tử vong ICU cao hơn ở bệnh nhân ARDS.
7. References
1. Webb H, Tierney DF. Experimental pulmonary edema due to intermittent positive pressure ventilation with high tidal inflation pressures. Am Rev Respir Dis. 1974;110:556–565. [PubMed]
2. Dreyfuss D, Soler P, Basset G, Saumon G. High inflation pressure pulmonary edema. Respective effects of high airway pressure, high tidal volume, and positive end-expiratory pressure. Am Rev Respir Dis. 1988;137:1159–1164. [PubMed]
3. Corbridge TC, Wood LD, Crawford GP, Chudoba MJ, Yanos J, Sznajder JI. Adverse effects of large tidal volume and low PEEP in canine acid aspiration. Am Rev Respir Dis. 1990;142:311–315. [PubMed]
4. Hickling KG, Henderson SJ, Jackson R. Low mortality associated with low volume pressure limited ventilation with permissive hypercapnia in severe adult respiratory distress syndrome. Intensive Care Med. 1990;16:372–377. [PubMed]
5. Stewart TE, Meade MO, Cook DJ, Stewart TE, Meade MO, Cook DJ Pressure- and Volume- Limited Ventilation Strategy Group. Evaluation of a ventilation strategy to prevent barotrauma in patients at high risk for acute respiratory distress syndrome. N Engl J Med. 1998;338:355–361. [PubMed]
6. Amato MB, Barbas CS, Medeiros DM, Magaldi RB, Schettino GP, Lorenzi-Filho G, Kairalla RA, Deheinzelin D, Munoz C, Oliveira R, Takagaki TY, Carvalho CR. Effect of a protective- ventilation strategy on mortality in the acute respiratory distress syndrome. N Engl J Med. 1998;338:347–354. [PubMed]
7. The Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med. 2000;342:1301–1308. [PubMed]
8. Broccard AF, Hotchkiss JR, Vannay C, Markert M, Sauty A, Feihl F, Schaller MD. Protective effects of hypercapnia acidosis on ventilator-induced lung injury. Am J Respir Crit Care Med. 2001;22:802–806. [PubMed]
9. Sinclair SE, Kregenow DA, Lamm WJ, Starr IR, Chi EY, Hlastala MP. Hypercapnia acidosis is protective in an in vivo model of ventilator-induced lung injury. Am J Respir Crit Care Med. 2002;166:403–408. [PubMed]
10. Feihl F, Perret C. Permissive hypercapnia: how permissive should we be? Am J Respir Crit Care Med. 1994;150:1722–1737. [PubMed]
11. Laffey JG, Kavanagh BP. Carbon dioxide and the critically ill—too little of a good thing? Lancet. 1999;354:1283–1286. [PubMed]
12. Laffey JG, Tanaka M, Engelberts D, Luo X, Yuan S, Tanswell AK, Post M, Lindsay T, Kavanagh BP. Therapeutic hypercapnia reduces pulmonary and systemic injury following in vivo lung reperfusion. Am J Respir Crit Care Med. 2000;162:2287–2294. [PubMed]
13. Jaitovich A, Angulo M, Lecuona E, Dada LA, Welch LC, Cheng Y, Gusarova G, Ceco E, Liu C, Shigemura M, Barreiro E, Patterson C, Nader GA, Sznajder JI. High CO2 levels cause skeletal muscle atrophy via AMP-activated kinase (AMPK), FoxO3a protein, and muscle- specific Ring finger protein 1 (MuRF1) J Biol Chem. 2015;290:9183–9194. [PMC free article] [PubMed]
14. Briva A, Vadász I, Lecuona E, Welch LC, Chen J, Dada LA, Trejo HE, Dumasius V, Azzam ZS, Myrianthefs PM, Batlle D, Gruenbaum Y, Sznajder JI. High CO2 levels impair alveolar epithelial function independently of pH. PLoS ONE. 2007;211:1238. [PMC free article] [PubMed]
15. Doerr CH, Gajic O, Berrios JC, Caples S, Abdel M, Lymp JF, Hubmayr RD. Hypercapnia acidosis impairs plasma membrane wound resealing in ventilator-injured lungs. Am J Respir Crit Care Med. 2005;171:1371–1377. [PMC free article] [PubMed]
16. Helenius IT, Krupinski T, Turnbull DW, Gruenbaum Y, Silverman N, Johnson EA, Sporn PH, Sznajder JI, Beitel GJ. Elevated CO2 suppresses specific drosophila innate immune responses and resistance to bacterial infection. Proc Natl Acad Sci USA. 2009;106:18710– 18715. [PMC free article] [PubMed]
17. Sharabi K, Hurwitz A, Simon AJ, Beitel GJ, Morimoto RI, Rechavi G, Sznajder JI, Gruenbaum Y. Elevated CO2 levels affect development, motility, and fertility and extend life span in Caenorhabditis elegans. Proc Natl Acad Sci USA. 2009;106:4024–4029. [PMC free article] [PubMed]
18. Vohwinkel CU, Lecuona E, Sun H, Sommer N, Vadász I, Chandel NS, Sznajder JI. Hypercapnia leads to mitochondrial dysfunction and decreased cell proliferation. J Biol Chem. 2011;286:37067–37076. [PMC free article] [PubMed]
19. Vadász I, Dada LA, Briva A, Helenius IT, Sharabi K, Welch LC, Kelly AM, Grzesik BA, Budinger GR, Liu J, Seeger W, Beitel GJ, Gruenbaum Y, Sznajder JI. Evolutionary conserved role of c-Jun-N-terminal kinase in CO2-induced epithelial dysfunction. PLoS ONE. 2012;7:e46696. [PMC free article] [PubMed]
20. Gates KL, Howell HA, Nair A. Hypercapnia impairs lung neutrophil function and increases mortality in murine Pseudomonas pneumonia. Am J Respir Cell Mol Biol. 2013;49:821–828. [PMC free article] [PubMed]
21. Dada LA, Trejo Bittar HE, Welch LC, Vagin O, Deiss-Yehiely N, Kelly AM, Baker MR, Capri J, Cohn W, Whitelegge JP, Vadász I, Gruenbaum Y, Sznajder JI. High CO2 leads to Na, K-ATPase endocytosis via c-Jun amino-terminal kinase-induced LMO7b phosphorylation. Mol Cell Biol. 2015;35:3962–3973. [PMC free article] [PubMed]
22. Bharat A, Graf N, Mullen A, Kanter J, Andrei AC, Sporn PH, DeCamp MM, Sznajder JI. Pleural hypercarbia after lung surgery is associated with persistent alveolo-pleural fistulae. Chest. 2016;149:220–227. [PubMed]
23. Esteban A, Anzueto A, Frutos F, Alía I, Brochard L, Stewart TE, Benito S, Epstein SK, Apezteguía C, Nightingale P, Arroliga AC, Tobin MJ Mechanical Ventilation International Study Group. Characteristics and outcomes in adult patients receiving mechanical ventilation: a 28-day international study. JAMA. 2002;287:345–355. [PubMed]
24. Esteban A, Ferguson ND, Meade MO, Frutos-Vivar F, Apezteguia C, Brochard L, Raymondos K, Nin N, Hurtado J, et al. Evolution of mechanical ventilation in response to clinical research. Am J Respir Crit Care Med. 2008;177:170–177. [PubMed]
25. Esteban A, Frutos-Vivar F, Muriel A, Ferguson ND, Peñuelas O, Abraira V, Raymondos K, Rios F, Nin N, Apezteguía C, et al. Evolution of mortality over time in patients receiving mechanical ventilation. Am J Respir Crit Care Med. 2013;188:220–230. [PubMed]
26. Nuckton TJ, Alonso JA, Kallet RH, Daniel BM, Pittet JF, Eisner MD, Matthay MA. Pulmonary dead-space fraction as a risk factor for death in the acute respiratory distress syndrome. N Engl J Med. 2002;346:1281–1286. [PubMed]
27. Wexler HR, Lok P. A simple formula for adjusting arterial carbon dioxide tension. Can Anaesth Soc J. 1981;28:370–372. [PubMed]
28. Rosenbaum P, Rubin D. The central role of the propensity score in observational studies for causal effects. Biometrika. 1983;70:41–55.
29. Austin PC. Optimal caliper widths for propensity-score matching when estimating differences in means and differences in proportions in observational studies. Pharm Stat. 2011;10:150–161. [PMC free article] [PubMed]
30. Mariani G, Cifuentes J, Carlo WA. Randomized trial of permissive hypercapnia in preterm infants. Pediatrics. 1999;104:1082–1088. [PubMed]
31. Kregenow DA, Rubenfeld GD, Hudson LD, Swenson ER. Hypercapnia acidosis and mortality in acute lung injury. Crit Care Med. 2006;34:1–7. [PubMed]
32. Brown LM, Calfee CS, Matthay MA, Brower RG, Thompson BT, Checkley W National Institutes of Health Acute Respiratory Distress Syndrome Network Investigators. A simple classification model for hospital mortality in patients with acute lung injury managed with lung protective ventilation. Crit Care Med. 2011;39:2645–2651. [PMC free article] [PubMed]
33. Laserna E, Sibila O, Aguilar PR, Mortensen EM, Anzueto A, Blanquer JM, Sanz F, Rello J, Marcos PJ, Velez MI, Aziz N, Restrepo MI. Hypocapnia and hypercapnia are predictors for ICU admission and mortality in hospitalized patients with community-acquired pneumonia. Chest. 2012;142:1193–1199. [PMC free article] [PubMed]
34. Schisterman EF, Cole SR, Platt RW. Over adjustment bias and unnecessary adjustment in epidemiologic studies. Epidemiology. 2009;20:488–495. [PMC free article] [PubMed]
35. Passalacqua KD, Varadarajan A, Byrd B, Bergman NH. Comparative transcriptional profiling of Bacillus cereus sensu lato strains during growth in CO2-bicarbonate and aerobic atmospheres. PLoS ONE. 2009;4:e4904. [PMC free article] [PubMed]
36. Sin DD, Man SF, Marrie TJ. Arterial carbon dioxide tension on admission as a marker of in- hospital mortality in community-acquired pneumonia. Am J Med. 2005;118:145–150. [PubMed]
37. Granger DL, Perfect JR, Durack DT. Virulence of Cryptococcus neoformans: regulation of capsule synthesis by carbon dioxide. J Clin Invest. 1985;76:508–516. [PMC free article] [PubMed]
38. Mekontso Dessap A, Charron C, Devaquet J, Aboab J, Jardin F, Brochard L, Vieillard-Baron
A. Impact of acute hypercapnia and augmented positive end-expiratory pressure on right ventricle function in severe acute respiratory distress syndrome. Intensive Care Med. 2009;35:1850–1858. [PMC free article] [PubMed]
39. Bull TM, Clark B, McFann K, Moss M. Pulmonary vascular dysfunction is associated with poor outcomes in patients with acute lung injury. Am J Respir Crit Care Med. 2010;182:1123– 1128. [PMC free article] [PubMed]
40. Boissier F, Katsahian S, Razazi K, Thille AW, Roche-Campo F, Leon R, Vivier E, Brochard L, Vieillard-Baron A, Brun-Buisson C, Mekontso Dessap A. Prevalence and prognosis of cor- pulmonale during protective ventilation for acute respiratory distress syndrome. Intensive Care Med. 2013;39:1725–1733. [PubMed]
41. Schmitt JM, Vieillard-Baron A, Augarde R, Prin S, Page B, Jardin F. Acute cor pulmonale in acute respiratory distress syndrome submitted to protective ventilation: incidence, clinical implications, and prognosis. Crit Care Med. 2001;29:1551–1555. [PubMed]





