Tác giả: Bác sĩ Đặng Thanh Tuấn
1. Giới thiệu
Hội chứng suy hô hấp cấp tính (ARDS) là một dạng suy hô hấp do thiếu oxy đặc trưng bởi tổn thương viêm nặng đối với hàng rào mao mạch – phế nang. Tổn thương này có thể được kích hoạt do tổn thương nguyên phát của tế bào biểu mô (ARDS tại phổi, pulmonary ARDS), như trong các trường hợp viêm phổi hoặc hít vào phế quản, hoặc tổn thương tế bào nội mạc (ARDS ngoài phổi, extrapulmonary ARDS), như trong các trường hợp nhiễm trùng huyết không do phổi [37, 51, 54]. Gần đây, bằng chứng cho thấy sự khác biệt về kiểu hình phân tử giữa hai nguyên nhân này [8]. Ngoài ra, bệnh nhân phát triển ARDS sau chấn thương (tổn thương phổi liên quan đến chấn thương, trauma-associated lung injury) có thể biểu hiện các đặc điểm lâm sàng và xét nghiệm sinh học khác biệt so với các dạng ARDS khác [7]. Không chỉ sự khác biệt về mức độ nặng giữa các bệnh nhân ARDS là quan trọng, mà còn phân biệt giữa các kiểu hình và nguyên nhân ARDS khác nhau, tức là, liên quan đến chấn thương, truyền máu, ung thư và nhiễm trùng. Các liệu pháp mới nhắm mục tiêu cụ thể vào các thực thể này có thể được hưởng lợi từ sự khác biệt về sinh lý bệnh.
2. Sinh lý bệnh của Hội chứng suy hô hấp cấp tính: Các diễn viên
Phản ứng miễn dịch bẩm sinh đóng một vai trò sâu sắc trong sinh lý bệnh của ARDS. Nhiều quá trình miễn dịch liên quan đến đại thực bào, bạch cầu đa nhân trung tính, và các tế bào biểu mô và tế bào nội mô có liên quan đến tổn thương mô trung gian.
2.1 Đại thực bào phế nang
Đại thực bào phế nang (alveolar macrophages) tạo thành tuyến phòng thủ đầu tiên chống lại các phần tử và vi sinh vật trong không khí và sử dụng một loạt các cơ chế và thụ thể nhận dạng mẫu để cảm nhận và thực bào các mầm bệnh [2]. Trong quá trình viêm phổi, tồn tại hai trạng thái biệt hóa chính, được đặc trưng bởi các đại thực bào được kích hoạt cổ điển (CAM, classically activated macrophages) và các đại thực bào được kích hoạt thay thế (AAM, alternatively activated macrophages). CAM hiển thị kiểu hình đại thực bào M1 và tạo ra các cytokine tiền viêm cao, chẳng hạn như interleukin (IL) -1β, yếu tố hoại tử khối u (TNF) -α, IL-12 và nitric oxide synthase (iNOS) gây ra tín hiệu paracrine từ interferon T helper 1 (Th1) (IFN) -γ và đáp ứng với tín hiệu autocrine bằng IFN-β [28, 62]. AAM hiển thị kiểu hình đại thực bào M2 và tạo ra các cytokine kháng viêm IL-10 và IL-1Ra để đáp ứng với tín hiệu từ các cytokine Th2 IL-4 và IL-13. Hầu hết các nghiên cứu về phát hiện kiểu hình đại thực bào đã được thử nghiệm, và mặc dù có rất ít nghiên cứu được thực hiện ở người, những nghiên cứu này rất đáng chú ý. Trong một so sánh về dịch rửa phế quản phế nang (BALF, bronchoalveolar lavage fluid) từ bệnh nhân bị ARDS và phù phổi do tim, cả thở máy và từ người tình nguyện khỏe mạnh không thở máy, Rosseau et al. cho thấy các đại thực bào phế nang từ các bệnh nhân ARDS bị lệch về phía các đại thực bào được kích hoạt cổ điển, tức là kiểu hình M1. Sự tồn tại của kiểu hình M1 có liên quan đến kết quả tồi tệ hơn [52]. Sau khi các đối tượng khỏe mạnh của con người tiếp xúc với LPS trong khí quản, đã quan sát thấy sự gia tăng các đại thực bào phế nang, chủ yếu được cấu thành từ các tế bào giống như tế bào đơn nhân phổi. Các tế bào này đã được tuyển dụng vào khoảng phế nang và là CD16−, khá c với các tế bào đơn nhân CD16 + không cư trú [71].
2.2 Bạch cầu đa nhân trung tính
Bạch cầu đa nhân trung tính (neutrophils) là bạch cầu đầu tiên được tuyển dụng vào các vị trí viêm để đáp ứng với các yếu tố hóa học được giải phóng bởi các đại thực bào được kích hoạt và các tế bào biểu mô phổi và tế bào nội mô [67]. Nó đã được báo cáo rằng nồng độ bạch cầu đa nhân trung tính trong BALF của bệnh nhân mắc ARDS tương quan với mức độ nghiêm trọng của bệnh và với kết cục xấu [33]. Bạch cầu đa nhân trung tính có liên quan đến sự phá vỡ hàng rào biểu mô nội mô [16]. Mặt khác, bệnh nhân giảm bạch cầu đa nhân trung tính có thể phát triển ARDS trong trường hợp không có bạch cầu đa nhân trung tính xâm lấn [44]. Điều này ảo tưởng về sự không đồng nhất của ARDS, vì nó có thể liên quan đến các quá trình độc lập với bạch cầu đa nhân trung tính và phụ thuộc vào bạch cầu đa nhân trung tính. Chemokine IL-8, còn được gọi là CXCL8, được cho là trung tâm của việc thu nhận bạch cầu đa nhân trung tính vào phổi trong ARDS [68]. Các mối tương quan quan trọng đã được rút ra từ các mẫu ARDS lâm sàng, bao gồm hút dịch phù phổi và BALF, giữa nồng độ IL-8 tăng, mức độ nặng của bệnh [38] và di chuyển bạch cầu đa nhân trung tính vào khoảng khí (airspaces) [39]. IL-8 được coi là chất hóa học hấp dẫn bạch cầu đa nhân trung tính mạnh nhất trong BALF từ bệnh nhân ARDS và là chemokine trung tính chiếm ưu thế được giải phóng từ các đại thực bào của con người được kích thích bằng LPS [26]. Không chỉ phân lập IL-8 mà cả các phức hợp của nó cũng được liên kết với sinh lý bệnh ARDS. Các phức hợp miễn dịch IL-8 được đặc trưng bởi IL-8 liên kết với immunoglobulin nội sinh G (IgG), chủ yếu là các phân lớp IgG3 và IgG4. Mức độ phức hợp miễn dịch IL-8 tăng cao có liên quan đến kết quả lâm sàng kém ở bệnh nhân mắc ARDS và ở những người có nguy cơ phát triển ARDS [27]. Một cơ chế có thể là sự giảm tỷ lệ chết tế bào theo chương trình (apoptosis) bạch cầu đa nhân trung tính, có liên quan đến sự gia tăng biểu hiện của Bcl-xL và giảm Bak và Bax [17]. Trong dòng này, người ta đã xác định rõ rằng apoptosis bạch cầu đa nhân trung tính bị trì hoãn ở những bệnh nhân mắc ARDS [29], điều này có thể giải thích sự tồn tại của tổn thương mô bằng cách ly giải các sản phẩm bạch cầu đa nhân trung tính, cụ thể là proteinase-3, cathepsin-G và ma trận metal- licoproteinase (MMP). Một cơ chế khác của tác động bạch cầu đa nhân trung tính là giải phóng các bẫy bạch cầu đa nhân trung tính ngoại bào (NET, neutrophil extracellular traps), trong một quá trình chết tế bào được gọi là NETosis [5]. Sự hình thành NET liên quan đến sự tan rã của màng nhân, ngưng tụ chromatin và giải phóng DNA và protein hạt vào khoảng ngoại bào [6]. Mặc dù NET có đặc tính kháng khuẩn mạnh, nhưng chúng có chứa histone, enzyme và peptide gây độc trực tiếp cho tế bào chủ. NET cũng đã được quan sát thấy trong tổn thương phổi cấp tính liên quan đến truyền máu (TRALI) ở người [60], và bảo vệ chống TRALI đã được quan sát để theo dõi sự ức chế của histone ngoại bào [9]. Do đó, trong một kịch bản của sự hình thành NET không bị kiểm soát, sự ức chế của nó có thể là một chiến lược hấp dẫn.
2.3 Biểu mô phế nang (alveolar epithelium)
Sau khi tổn thương trực tiếp, biểu mô phổi là cấu trúc bị tổn thương chính. Tổn thương biểu mô dẫn đến ngập lụt phế nang [65], giảm loại bỏ dịch phù từ khoảng phế nang [40], giảm sản xuất và hoạt động của chất hoạt động bề mặt [21], và xơ hóa [4]. Một nghiên cứu gần đây với hai đoàn hệ bệnh nhân khác biệt [8] cho thấy ARDS tại phổi được đặc trưng bởi tổn thương tế bào biểu mô phổi nặng hơn so với ARDS gián tiếp và ngược lại, ARDS gián tiếp được đặc trưng bởi tổn thương và viêm tế bào nội mô nghiêm trọng hơn. Trong số nhiều loại dấu ấn sinh học huyết tương được phân tích (surfactant protein [SP]-D, IL-6, IL-8, angiopoietin [Angpt]-2, thụ thể của advanced glycation end products [RAGE] và yếu tố von Willebrand [vWF]) và các giá trị tiên lượng tương ứng của chúng, SP-D là phân tử chỉ điểm đáng tin cậy nhất của kiểu hình tổn thương phổi trực tiếp. SP-D, được sản xuất bởi các tế bào biểu mô và tế bào loại II, là một protein ưa nước lớn tương tác với glycoconjugates và lipid thông qua miền nhận biết carbohydrate (CRD, carbohy- drate recognition domain) trên bề mặt vi sinh vật, bao gồm cả vi khuẩn Gram dương và Gram âm [22]. Nó có thể gây ra sự ngưng kết vi khuẩn, cản trở sự xâm nhập của chúng vào tế bào chủ và lây lan, và có thể dẫn đến cái chết của vi khuẩn thông qua sự thẩm thấu của thành tế bào vi khuẩn, làm tăng quá trình đốt cháy hô hấp của đại thực bào và bạch cầu đa nhân trung tính và tăng cường quá trình quang hóa của tế bào thực bào [25].
2.4 Nội mạc phế nang (alveolar endothelium)
Nội mạc mạch máu (vascular endothelium) là rào cản đầu tiên gặp phải bởi các thoát dịch hoặc tế bào viêm từ mạch máu đến phế nang. Chức năng hàng rào nội mô là một quá trình thiết yếu và được kiểm soát chặt chẽ, đảm bảo ngăn cách hợp lý các khoảng mạch máu và khoảng kẽ trong khi cho phép trao đổi khuếch tán các phân tử nhỏ và kiểm soát sự đi xuyên qua của các đại phân tử và tế bào miễn dịch [36]. Hư hỏng hàng rào nội mô dẫn đến rò rỉ quá nhiều dịch và protein từ mạch máu vào khoảng khí. Mất tính toàn vẹn của hàng rào có thể là hậu quả của hoạt động bạch cầu đa nhân trung tính, trong đó chúng tích tụ trong vi tuần hoàn của phổi, được kích hoạt, và sau đó làm thoái hóa và giải phóng một số chất trung gian độc hại, bao gồm các chủng oxy phản ứng (ROS, reactive oxygen species), protease, các cytokine tiền viêm, và các phân tử tiền đông máu. Tổn thương được thực hiện bởi bạch cầu đa nhân trung tính và các sản phẩm nội bào của chúng có thể làm tăng tính thấm thành mạch bằng cách thay đổi tính gắn kết các tế bào tại chổ, tích hợp xuyên màng và hóa cốt tế bào của các tế bào nội mô. Các chất trung gian gây viêm khác, mặc dù bạch cầu đa nhân trung tính, có thể tác động trực tiếp lên mao mạch phổi, dẫn đến tăng biểu hiện của chemokine và các phân tử bề mặt tế bào rất quan trọng đối với sự kết dính của bạch cầu [35, 49]. Hơn nữa, tổn thương hàng rào nội mô có thể qua trung gian bởi các sản phẩm vi khuẩn hoặc virus, độc lập với tác động của bạch cầu kích hoạt. Ví dụ, độc tố do Pseudomonas aeruginosa và Staphylococcus aureus sản xuất phá vỡ hàng rào nội mô cũng như hàng rào biểu mô [12, 66]. Không chỉ các chất trung gian gây viêm đường dẫn truyền NF-κB mà cả các tyrosine xuyên màng đặc hiệu từ các tế bào nội mô (Tie-2) đóng một vai trò quan trọng trong sinh lý bệnh ARDS. Các phối tử Angpt-1 và Angpt-2 của chúng, với ái lực nano, có thể có tác dụng đối nghịch với chức năng tế bào nội mô. Angpt-1 phần lớn được tổng hợp và tiết ra bởi các tế bào xung quanh nội mạc và tiểu cầu, trong khi Angpt-2 được tổng hợp trong nội mô, nơi protein được tạo thành trước được lưu trữ để giải phóng nhanh trong các hạt gọi là Weibel–Palade bodies [15]. Vùng đầu N của Angpt-1 thậm chí có thể thúc đẩy sự độ giãn nở cục bộ với ma trận ngoại bào [61], dẫn đến nồng độ mô cao mặc dù mức độ lưu thông thấp. Trong nhiễm trùng huyết, ARDS và các tình trạng liên quan, Angpt-1 lưu hành dường như bị triệt tiêu [48]. Ngoài ra, mức độ suy giảm Angpt-1 có xu hướng giảm từ hai đến ba lần hoặc ít hơn, tương đương với mức tăng gấp 5 đến 20 lần của Angpt-2 lưu hành, quan sát thấy trong nhiễm trùng huyết hoặc ARDS. Nồng độ Angpt-2 lưu hành có dải động rộng hơn nhiều so với Angpt-1. Năm 2006, Parikh và cộng sự. báo cáo mức độ lưu thông Angpt-2 tăng gấp 10 đến 20 lần ở những người bị nhiễm trùng huyết nặng tại thời điểm nhập viện ICU so với bệnh nhân nhiễm trùng huyết không biến chứng và các bệnh nhân khỏe mạnh nhập viện. Các tác giả lưu ý rằng những đối tượng bị nhiễm trùng huyết nặng đã phát triển nồng độ Angpt-2 đỉnh cao hơn so với những người bị nhiễm trùng huyết không biến chứng và quan sát thêm rằng những người bị suy yếu trao đổi khí phổi có giá trị Angpt-2 cao hơn so với những người có trao đổi khí bình thường [69]. Trong các nghiên cứu đoàn hệ đơn trung tâm và đa trung tâm, Angpt-2 là một chỉ số mạnh mẽ của ARDS ngoài phổi [8]. Cảm ứng của Angpt- 2 rõ ràng có kết quả bất lợi, một điểm được minh họa mạnh mẽ trong một nghiên cứu tại khoa cấp cứu trên 270 người trưởng thành bị nghi nhiễm trùng, khi lưu hành Angpt-2 trong vòng một giờ nhập viện dự đoán tỷ lệ tử vong ở bệnh nhân nội trú, với một khu vực dưới đường cong ROC là 0,91 [10]. Khi so sánh một số dấu ấn sinh học có liên quan, Angpt-2 là chất duy nhất có khả năng dự đoán mức độ nghiêm trọng, theo dõi tiến trình và tiên lượng kết quả của ARDS khởi phát muộn ở bệnh nhân sốt nặng, không phân biệt yếu tố nguy cơ tiềm ẩn [23].
3. ARDS tại phổi vs ngoài phổi: Chuyện hoang đường là một sự thật
ARDS từ lâu đã được coi là một biểu hiện thống nhất của một phản ứng viêm lan tỏa, áp đảo của nhu mô phổi đối với một loạt các bệnh nghiêm trọng. Các nguyên nhân thường gặp nhất bao gồm nhiễm trùng huyết, viêm phổi nặng, viêm phúc mạc và đa chấn thương. Từ năm 1999, Gattinoni et al. đã nhấn mạnh các phản ứng khác biệt của cơ học hô hấp trong ARDS có nguồn gốc tại phổi so với ngoài phổi [18]. Điều này có thể được liên kết với các bệnh lý cơ bản khác nhau do hai con đường gây bệnh khác nhau: một tổn thương trực tiếp đối với nhu mô phổi trong ARDS gây ra bởi các bệnh về phổi, như viêm phổi lan tỏa, so với một bệnh nhân ARDS bị tổn thương phổi gián tiếp gây ra bởi các bệnh ngoài phổi, chẳng hạn như nhiễm trùng ổ bụng hoặc viêm tụy [45]. Một lời giải thích cho sự khác biệt thu thập được từ nghiên cứu mang tính bước ngoặt này là sự đông đặc phổi phổ biến trong ARDS loại tổn thương trực tiếp, trong khi phù nề kẽ và xẹp phế nang phổ biến được thấy trong ARDS loại chấn thương gián tiếp [37, 51, 54]. Mười sáu năm, Calfee et al. đã chứng minh rằng ARDS tại phổi được đặc trưng bởi tổn thương tế bào biểu mô phổi nghiêm trọng hơn so với ARDS ngoài phổi, trong khi ARDS ngoài phổi được đặc trưng bởi tổn thương và viêm tế bào nội mô nghiêm trọng hơn [8]. Với một vài ngoại lệ, những phát hiện này là mạnh mẽ để điều chỉnh sự khác biệt về mức độ nặng của bệnh và tổn thương phổi. Những kiểu hình phân tử khác biệt của tổn thương tại phổi so với ngoài phổi cung cấp bằng chứng mạnh mẽ cho thấy sự không đồng nhất trong sinh bệnh học ARDS được quan sát trong các mô hình thực nghiệm [37] có liên quan đến ARDS ở người, một phát hiện có thể có ý nghĩa quan trọng đối với các thử nghiệm lâm sàng của các liệu pháp mới. Cũng như kiểu hình phân tử, tính thấm của phổi dường như cũng khác nhau giữa ARDS tại phổi và ngoài phổi. Trong các phân tích với phương pháp điều trị nhiệt qua phổi, bệnh nhân mắc ARDS tại phổi biểu hiện chỉ số thẩm thấu mạch máu phổi cao hơn so với bệnh nhân ARDS ngoài phổi trong 3 ngày đầu tiên ở ICU [42]. Mặt khác, chỉ số nước phổi ngoài mạch máu chỉ khác nhau ở ngày thứ 3 (ARDS ngoài phổi, 14,9 ± 6,0; ARDS tại phổi, 17,6 ± 7,8, p = 0,02). Mặc dù nghiên cứu này có ít bệnh nhân, phân bổ không cân bằng và điểm SOFA ở các chỉ số đo cơ sở, phương pháp pha loãng nhiệt xuyên phổi (transpulmonary thermodilution method) có thể phân biệt giữa các nguyên nhân ARDS thông qua đánh giá tính thấm của phổi. Nói tóm lại, dường như có sự khác biệt rõ ràng về sinh lý bệnh học, các khía cạnh hình thái, cơ học hô hấp và các thông số huyết động giữa ARDS tại phổi và ngoài phổi ở người.
4. Kiểu hình ARDS (Phenotypes)
Việc thiết lập các định nghĩa rõ ràng về ARDS đã dẫn đến những tiến bộ đáng kể trong việc tiêu chuẩn hóa dân số trong các nghiên cứu; tuy nhiên, một số nghiên cứu đã cho thấy sự không đồng nhất đáng kể trong dân số bệnh nhân đáp ứng các tiêu chí đồng thuận đối với ARDS [13, 63]. Sự không đồng nhất đã được mô tả trên cơ sở tổn thương thúc đẩy, chẳng hạn như nhiễm trùng huyết, ung thư, truyền máu và chấn thương, hoặc do chấn thương cơ học, chẳng hạn như tổn thương phổi trực tiếp hoặc gián tiếp [7]. Một ví dụ gần đây chứng thực sự khác biệt trong kiểu hình ARDS liên quan đến sự hiện diện hoặc vắng mặt của tổn thương phế nang lan tỏa (DAD) trong phân tích sau khi chết. Lorente và cộng sự. [31] cho thấy những người không sống sót của ARDS có các đặc điểm lâm sàng khác nhau phụ thuộc vào mô học cơ bản. Bệnh nhân mắc ARDS và DAD sau khi chết có kiểu hình lâm sàng khác với bệnh nhân mắc ARDS và các kết quả mô học khác không có DAD. Những phát hiện này ủng hộ khái niệm rằng sự hiện diện của DAD xác định một kiểu phenotype cụ thể trong bệnh nhân được chẩn đoán lâm sàng về ARDS. Làm thế nào để phát hiện kiểu hình này hoặc các kiểu hình khác ở đầu giường vẫn chưa rõ ràng. Hình 2.1 cung cấp tổng quan về các kiểu hình ARDS phổ biến nhất, bao gồm mức sinh học dự kiến, các yếu tố nguy cơ có khả năng và liên quan đến các chấn thương cụ thể.
4.1 Kiểu hình nhiễm trùng huyết và ung thư
Các nghiên cứu đo dấu ấn sinh học lưu hành ở bệnh nhân mắc ARDS cho thấy nồng độ protein C thấp hơn ở những bệnh nhân mắc ARDS liên quan đến nhiễm trùng huyết so với những người có ARDS không liên quan đến nhiễm trùng huyết, trong khi procalcitonin, neopterin, kháng nguyên yếu tố von Willebrand và mức độ E-selectin hòa tan cao hơn [34]. Trong số các dấu ấn sinh học này, nồng độ IL-6, IL-8 và IL-10 cao hơn trong ARDS liên quan đến nhiễm trùng huyết, cho thấy mức độ viêm cấp tính cao hơn, hoạt động của tế bào nội mô và kích hoạt đông máu. Sheu et al. [55] nhận thấy rằng ARDS liên quan đến nhiễm trùng huyết có liên quan đến mức độ nghiêm trọng của bệnh tổng thể cao hơn, khả năng phục hồi sau chấn thương phổi kém hơn, tỷ lệ rút ống thành công thấp hơn và tỷ lệ tử vong cao hơn ARDS không liên quan đến nhiễm trùng huyết. Kết quả lâm sàng tồi tệ hơn trong ARDS liên quan đến nhiễm trùng huyết dường như được điều khiển bởi mức độ nặng của bệnh và bệnh đi kèm. Trong số các bệnh đi kèm, xơ gan có liên quan chặt chẽ đến tử vong trong các kịch bản ARDS. Trong một phân tích hồi quy Cox đa biến, các tác giả cho thấy ung thư di căn là chỉ số dự đoán độc lập của tử vong ARDS. Bệnh nhân ung thư tiềm ẩn phát triển ARDS có nguy cơ tử vong trong 28 ngày cao hơn đáng kể so với những người không mắc bệnh ung thư, chủ yếu là do mức độ nghiêm trọng của bệnh hiện tại và tuổi già của những người mắc bệnh ung thư [58]. Có khả năng giải thích cho kết quả này bao gồm các tình trạng nhiễm trùng nghiêm trọng, chẳng hạn như nhiễm vi khuẩn kháng thuốc, nhiễm nấm và virus; sử dụng các tác nhân hóa học và tiếp xúc với bức xạ; và sự chậm trễ trong chẩn đoán ARDS. Trong nghiên cứu này, sự chậm trễ giữa khởi phát các triệu chứng hô hấp và nhập viện ICU vượt quá 2 ngày và điều này góp phần độc lập vào tỷ lệ tử vong 28 ngày cao hơn [41].
4.2 Các kiểu hình chấn thương và truyền máu
Nó đã được chứng minh rằng những bệnh nhân mắc ARDS liên quan đến chấn thương có đặc điểm lâm sàng khác biệt rõ rệt so với bệnh nhân mắc các nguyên nhân lâm sàng khác của ARDS [7].
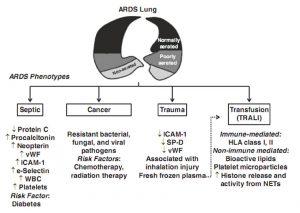
Những khác biệt này có liên quan đến mức huyết tương thấp hơn của một số dấu ấn sinh học trước đây có liên quan đến kết quả lâm sàng kém ở ARDS, bao gồm ICAM-1, SP-D, sTNFr-1 và vWF. Mặc dù một nghiên cứu trước đây [3] chỉ tập trung vào sự phổ biến của ARDS dựa trên định nghĩa của Berlin trong các bệnh nhân trong quân đội, các tác giả cung cấp thông tin quan trọng về kiểu hình ARDS. Bất kể chấn thương, bệnh nhân được phân biệt thành các nhóm ARDS nhẹ, trung bình và nặng, với tỷ lệ tử vong lần lượt là 11,1%, 36,1% và 43,8%. Các biến sau đây liên quan độc lập với ARDS vừa hoặc nặng trong dân số này: tổn thương hô hấp do hít, thang điểm độ nặng của chấn thương, viêm phổi và sử dụng huyết tương tươi đông lạnh. Trên thực tế, các nghiên cứu trước đây đã chỉ ra mối liên hệ chặt chẽ giữa việc sử dụng huyết tương tươi đông lạnh và phát triển ARDS ở những bệnh nhân bị thương nặng [24, 64]. Tổn thương phổi cấp tính liên quan đến truyền máu (TRALI, transfusion-related acute lung injury) có thể được xác định. Về mặt kinh điển, TRALI có liên quan đến các sự kiện qua trung gian miễn dịch và không qua trung gian miễn dịch. Nguyên nhân thứ nhất là do kháng nguyên bạch cầu tế bào người (HLA, human leukocyte antigen) loại I và II và/hoặc ít thường gặp hơn là kháng thể chống lại các kháng nguyên bạch cầu hạt đặc hiệu, kháng nguyên bạch cầu đa nhân trung tính ở người (HNA, human neutrophil antigen), có thể có trong huyết thanh của người nhận hoặc người hiến bạch cầu của người cho hoặc người nhận, tương ứng [43]. Các sự kiện không qua trung gian miễn dịch có thể được quy cho việc truyền các hợp chất hoạt tính sinh học tích lũy trong các thành phần máu được lưu trữ, chẳng hạn như lipid hoạt tính sinh học, cytokine tiền viêm hoặc vi hạt tiểu cầu có hoạt tính procoagulant cao [59]. Một cơ chế nữa có thể là sự giải phóng các phân tử liên quan đến tổn thương ty thể (DAMPs, mitochondrial damage-associated molecular patterns), bao gồm các axit deoxyribonucleic ty thể (mtDNA, mitochondrial deoxyribonucleic acid) và các protein liên quan đến mtDNA [30]. Trên lâm sàng, theo dõi huyết động giúp phân biệt TRALI với phù phổi do tim. Áp suất mao mạch phổi bít và giá trị áp lực tĩnh mạch trung tâm bình thường hoặc thấp là đặc trưng của TRALI [56]. Cần theo dõi huyết động để loại trừ các nguyên nhân khác của TRALI, vì các triệu chứng của nó tương tự như các tình trạng khác, bao gồm phản ứng phản vệ, phù phổi, ARDS và nhiễm khuẩn. Thỉnh thoảng, có thể phát hiện giảm bạch cầu, giảm bạch cầu đa nhân trung tính, giảm albumin máu và giảm bổ thể máu. Triệu chứng phổ biến nhất là giảm bạch cầu thoáng qua, chiếm 5-35% bệnh nhân [14].
Phổi có xu hướng bị ảnh hưởng thường xuyên hơn bất kỳ cơ quan nào khác ở những bệnh nhân chết vì sốc lâm sàng hoặc sau chấn thương, một hiện tượng liên quan đến thâm nhiễm bạch cầu đa nhân trung tính, phù phổi, xuất huyết và huyết khối vi mạch [32]. Các sự kiện bệnh sinh căn bản liên quan đến chấn thương vẫn chưa được mô tả đầy đủ. Các nghiên cứu đã chỉ ra rằng các protein hạt nhân (nuclear proteins), chẳng hạn như high mobility group box-1 (HMGB-1) [46] và histones [1] tăng lên sau các sự kiện chấn thương liên quan đến các bối cảnh ARDS. Đặc biệt là histones đã chứng minh khả năng làm trung gian tổn thương cơ quan từ xa, đặc biệt là ở phổi và góp phần gây ra suy đa tạng. Một cơ chế ổn định có thể là các histone ngoại bào liên kết với phospholipid, phá vỡ màng tế bào và gây ra dòng canxi vào tế bào. Hoạt động này trên tất cả các tế bào được thử nghiệm dẫn đến tăng [Ca+2] nội bào, gây tổn thương tế bào và giải phóng các chất dự trữ và chứa trong tế bào. Hơn nữa, sự gia tăng nồng độ histone có thể liên quan đến sự hình thành NET và có thể trở thành một dấu ấn mới phản ánh hoạt động của bệnh. Trên thực tế, nguồn histone chiếm ưu thế trong ARDS có thể là bạch cầu đa nhân trung tính đã được kích hoạt bởi C5a để tạo thành NET, dường như là một quá trình liên tục đối với việc duy trì tình trạng viêm nhiễm [20]. Các histone ngoại bào có tích chất tiền viêm cao và đã được chứng minh là gây ra thiệt hại nghiêm trọng cho chức năng hô hấp. Nhỏ giọt histones qua khí quản dẫn đến sản xuất chất trung gian gây viêm, tổn thương tế bào biểu mô, rối loạn trao đổi khí mao mạch – phế nang, đông đặc phổi và kích hoạt dòng thác đông máu [20]. Nhắm mục tiêu histone với kháng thể trung hòa hoặc heparin cho thấy tác dụng bảo vệ mạnh mẽ, gợi ý một chiến lược điều trị mới [70].
Trong quần thể chấn thương, các kiểu ARDS khác nhau khởi phát với các yếu tố nguy cơ ARDS khác nhau đã được mô tả theo kinh nghiệm và có thể liên quan đến các con đường sinh bệnh học khác nhau [11]. Bằng cách sử dụng phân tích lớp tiềm ẩn (LCA, latent class analysis), một phương pháp thống kê được sử dụng để xác định các mẫu không quan sát được (tiềm ẩn) ẩn dưới sự không đồng nhất quan sát được trong quần thể, một nghiên cứu đã xác định ba nhóm ARDS dựa trên thời gian khởi phát và chẩn đoán chắc chắn trong một đoàn hệ bệnh nhân chấn thương nặng [47]. Mô hình đã xác định điểm cắt khoảng 48 giờ sau khi trình bày tách các nhóm con khởi phát sớm và muộn của ARDS. ARDS khởi phát sớm có liên quan đến độ nặng của chấn thương ngực, tăng huyết áp sớm và truyền máu hồng cầu lắng nhiều trong hồi sức ban đầu khi so sánh với phân nhóm khởi phát muộn hơn. Ngoài ra, các dấu ấn sinh học sRAGE và Angpt-2 cao hơn đáng kể trong bệnh nhân mắc ARDS khởi phát sớm, trong khi tất cả các dấu ấn sinh học khác, bao gồm các dấu hiệu viêm hệ thống, giống nhau giữa hai nhóm ARDS, cho thấy cấu hình phân tử khác biệt trong giai đoạn đầu sau chấn thương.
5 Viễn cảnh tương lai
Một số phương pháp điều trị bằng thuốc được đề xuất hoặc đánh giá cho ARDS tìm cách bảo vệ các tế bào nội mô, do đó giảm thiểu sự xuất tiết dịch vào khoảng phế nang [35]. Những nghiên cứu này dựa trên nền tảng sinh lý nhưng nó chưa được chuyển sang bối cảnh lâm sàng [53]. Một bài báo gần đây [19, 57] đã đánh giá một phức hợp ức chế mới, FG-4497, một chất ức chế prolyl hydroxylase domain 2 (PHD2), đã được chứng minh là kích hoạt sao chép yếu tố gây thiếu oxy- 2α (HIF-2α) trong một mô hình ARDS gây ra bởi nội độc tố. Sau khi được kích hoạt, HIF-2α làm tăng biểu hiện của tyrosine phosphatase protein nội mô mạch máu (VE-PTP), do đó, có thể làm giảm quá trình phosphoryl hóa VE-cadherin, hỗ trợ sự toàn vẹn của các mối nối (Ajs, adherens junctions) và ngăn ngừa mất liên kết nội mô. FG- 4497 có thể báo trước một chiến lược dược lý mới cho ARDS. Cũng liên quan đến điều trị dược lý, một bài báo gần đây [50] cho thấy chất ức chế tyrosine kinase, imatinib được FDA phê chuẩn đã làm giảm tình trạng viêm và rò rỉ mạch máu do lipopolysaccharide gây ra khi kết hợp với tổn thương phổi do máy thở (VILI) và các tác dụng bảo vệ này gây ra tổn thương phổi (VILI). Can thiệp này được báo cáo trước đây chỉ trong VILI. Cùng với việc giảm viêm, imatinib có thể tác động lên một số mô hình rò rỉ mạch máu, vì nó ức chế c-Abl, một thành phần của họ kinase là chất trung gian quan trọng của chức năng mạch máu với cả tác dụng bảo vệ và phá vỡ.
6. Phần kết luận
Các tế bào khác nhau đóng vai trò trong viêm phổi quan sát thấy trong ARDS. Sự kết hợp giữa các tế bào thường trú (đại thực bào cấu trúc và phế nang) và tế bào không thường trú (bạch cầu tuần hoàn, bạch cầu đa nhân trung tính) dẫn đến tổn thương phổi và liên quan đến các cơ chế phục hồi trong phổi ARDS. Việc nhận ra các khác biệt trong các biểu hiện ARDS tùy thuộc vào sự tổn thương thúc đẩy, dù hướng đến biểu mô hay nội mô, cho dù có liên quan đến các sự kiện nhiễm trùng, ung thư tiềm ẩn, hay chấn thương đã cho phép làm sáng tỏ thêm các kiểu hình của tình trạng này. Đây là một bước quan trọng; như thể hiện bởi sự phát triển của các bệnh phổi tương tự như hen suyễn và bệnh phổi tắc nghẽn mạn tính, phenotype dẫn đến việc làm sáng tỏ bệnh sinh và phát hiện ra các mục tiêu cho các liệu pháp mới.





