Tóm tắt
Mất ổn định huyết động liên quan đến điều trị thay thế thận (HIRRT – Hemodynamic instability related to renal replacement therapy) là một biến chứng thường gặp của tất cả các phương thức điều trị thay thế thận (RRT) thường được sử dụng trong đơn vị chăm sóc đặc biệt. HIRRT có liên quan đến tăng tỷ lệ tử vong và có thể làm giảm quá trình phục hồi thận. Sự hiểu biết hiện tại của chúng ta về cơ sở sinh lý của HIRRT chủ yếu đến từ các nghiên cứu ở bệnh nhân mắc bệnh thận giai đoạn cuối khi chạy thận nhân tạo định kỳ trong đó HIRRT được gọi là “hạ huyết áp trong lúc thẩm tách máu”. Tuy nhiên, có nhiều nghiên cứu cung cấp những hiểu biết bổ sung về các cơ chế cơ bản cho HIRRT đặc biệt ở những bệnh nhân bị bệnh nặng. Cụ thể, bằng chứng khá thách thức gần đây quan niệm rằng HIRRT gần như hoàn toàn liên quan đến siêu lọc quá mức. Mặc dù siêu lọc quá mức là một cơ chế chính, nhiều cơ chế liên quan đến RRT khác có thể thúc đẩy HIRRT và điều này có thể có ý nghĩa đối với cách quản lý điều trị HIRRT (ví dụ, một điều chỉnh thích hợp có thể không phải luôn luôn là giảm siêu lọc, đặc biệt là trong bối cảnh quá tải dịch đáng kể). Tổng quan này tóm tắt ngắn gọn về tỷ lệ mắc và tác dụng phụ của HIRRT và xem xét những gì hiện được biết về các cơ chế củng cố nó. Điều này bao gồm việc xem xét các bằng chứng xuất hiện cho các can thiệp khác nhau liên quan đến RRT để ngăn chặn hoặc hạn chế HIRRT. Sự hiểu biết nâng cao về các cơ chế làm nền tảng cho HIRRT, ngoài việc siêu lọc quá mức, có thể dẫn đến các can thiệp liên quan đến RRT hiệu quả hơn để giảm thiểu sự xuất hiện và hậu quả của nó.
Tác giả: Thạc sĩ – Bác sĩ Hồ Hoàng Kim – ICU Bệnh viện NGUYỄN TRI PHƯƠNG.
Giới thiệu
Tổn thương thận cấp tính (AKI) cần điều trị thay thế thận (RRT) là một biến chứng thường gặp của bệnh nhân bị bệnh nặng, xảy ra ở ~ 15% bệnh nhân nhập viện tại khoa chăm sóc đặc biệt (ICU) [1]. Mất ổn định huyết động liên quan đến điều trị thay thế thận (HIRRT) là biến chứng của tất cả các phương thức RRT thường được sử dụng trong ICU, bao gồm chạy thận nhân tạo ngắt quản (IHD), lọc máu thận chậm (SLED) và điều trị thay thế thận liên tục (CRRT). Cụ thể hơn, HIRRT đã được chứng minh là có ảnh hưởng đến 10 – 70% phương pháp điều trị HD [2-5] và 19-43% phương pháp điều trị CRRT [6, 7]. Sự thay đổi về tần số được báo cáo trong các phương thức RRT một phần là do thiếu định nghĩa đồng thuận cho HIRRT [8,9]. Định nghĩa K-DOQI về hạ huyết áp trong lúc thẩm tách (IDH- intradialytic hypotension) đối với bệnh nhân mắc bệnh thận giai đoạn cuối (ESKD) khi HD định kỳ liên quan đến việc giảm huyết áp tâm thu (SBP) xuống 20 mmHg hoặc giảm 10 mmHg huyết áp động mạch trung bình (MAP) và sự hiện diện của các triệu chứng liên quan đến IDH. Định nghĩa này không đề cập đến các bệnh nhân bị bệnh nghiêm trọng, những người không thể báo cáo các triệu chứng hạ huyết áp hoặc hạ huyết áp điển hình và huyết áp bị ảnh hưởng mạnh bởi bệnh đồng thời (ví dụ như nhiễm trùng huyết, sốc tim) và các phương pháp điều trị (ví dụ, thở máy, thuốc vận mạch).
HIRRT có vấn đề lâm sàng không? Dường như HIRRT không chỉ liên quan đến tỷ lệ tử vong tại bệnh viện cao hơn [10] mà còn có thể liên quan đến việc giảm phục hồi thận [11]. Dữ liệu trên người và động vật cho thấy bệnh nhân bị AKI có thể đặc biệt dễ bị tổn thương thận do thiếu máu cục bộ khi huyết áp giảm do việc tự điều hòa tưới máu thận bị suy giảm trong lúc lọc[12, 13].
Thông tin mang về nhà:
- Không chỉ là kết quả của quá trình siêu lọc quá mức, sự mất ổn định huyết động liên quan đến liệu pháp thay thế thận (HIRRT) có thể là kết quả của nhiều cơ chế độc lập, và có khả năng chồng chéo qua đó RRT dẫn đến giảm cung lượng tim hoặc giảm sức cản ngoại biên. Sự hiểu biết được cải thiện về các cơ chế này có thể dẫn đến các can thiệp tốt hơn để hạn chế HIRRT trên tất cả các phương thức RRT thường được sử dụng trong ICU.
Đánh giá có hệ thống gần đây của chúng ta về các nghiên cứu can thiệp đối với HIRRT ở những bệnh nhân bị bệnh nặng đã tìm thấy rất ít bằng chứng chất lượng để hướng dẫn phòng ngừa và điều trị biến chứng nghiêm trọng và phổ biến này [9]. Tuy nhiên, nhiều nghiên cứu cung cấp cái nhìn sâu sắc về các cơ chế cơ bản gây HIRRT ở bệnh nhân bị bệnh nặng với AKI. Mặc dù có sự chồng chéo đáng kể và HIRRT có thể là hậu quả của nhiều cơ chế ở bất kỳ bệnh nhân nào, nhưng các cơ chế cơ bản liên quan (xem Hình 1) là giảm cung lượng tim [cũng như do hậu quả của giảm thể tích máu (xem Hình 2) và/hoặc suy bơm (xem hình 3)] và giảm sức cản ngoại biên (sốc phân phối) (xem hình 4), tất cả điều này xảy ra trong một bối cảnh bù đắp sinh lý không đầy đủ của bệnh nhân bị bệnh nặng. Các phản ứng sinh lý bù bình thường đối với hạ huyết áp (ví dụ: huy động thể tích máu không tham gia tuần hoàn, tăng nhịp tim và co bóp do kích hoạt giao cảm) có nhiều khả năng bị suy yếu ở bệnh nhân bị bệnh nghiêm trọng với AKI. Mặc dù siêu lọc quá mức có thể là nguyên nhân đơn độc dẫn đến HIRRT, bằng chứng gần đây cho thấy rằng nó thường không phải là yếu tố thúc đẩy chính ở bệnh nhân bị bệnh nặng [4, 5]. Trong phần tiếp theo, chúng tôi xem xét các cơ chế liên quan đến HIRRT cho RRT (xem Bảng 1), bao gồm cả việc đánh giá các can thiệp hiệu quả để giảm thiểu nó.
Các cơ chế liên quan đến RRT gây HIRRT
Siêu lọc quá mức
Ngay cả khi không có sốc giảm thể tích, sinh lý bệnh của hạ huyết áp thường liên quan đến việc giảm tiền tải tim do giảm khả năng huy động của thể tích máu không tham gia tuần hoàn do mất khả năng co tĩnh mạch [14] cũng như phân phối lại các chất dịch từ khoang kẽ vào nội mạch do nhiễm trùng huyết và phản ứng viêm [15]. Tuy nhiên, truyền dịch lặp đi lặp lại để điều chỉnh sự suy giảm thể tích nội mạch có thể dẫn đến sự tích tụ dịch đáng kể và có khả năng gây hại. Cân bằng tích lũy dịch là một yếu tố nguy cơ độc lập làm tăng tỷ lệ tử vong trong sốc nhiễm trùng và AKI [10, 16, 17], và do đó RRT thường được dùng để rút dịch. Khả năng có lợi sử dụng RRT để điều chỉnh quá tải dịch mạnh mẽ hơn đã được chứng minh trong một nghiên cứu của Murugan et al đánh giá các bệnh nhân bị bệnh nghiêm trọng với tình trạng quá tải dịch (tăng 5% trọng lượng cơ thể) và phát hiện ra rằng siêu lọc tích cực hơn (UF) (tức là rút dịch bằng RRT) có liên quan đến tỷ lệ tử vong thấp hơn sau 1 năm khi được điều chỉnh các yếu tố nguy cơ [18].
Bản thân RRT có thể dẫn đến giảm tiền tải tim cấp tính do siêu lọc và/hoặc dịch chuyển dịch liên quan đến thay đổi thẩm thấu (được thảo luận dưới đây và được nêu trong Hình 2). Làm đầy thể tích huyết tương từ dịch trong khoang kẽ và nội bào bù cho việc loại bỏ dịch bằng UF. Khi tỷ lệ UF vượt quá tốc độ bù lại huyết tương, giảm thể tích nội mạch xảy ra trong bối cảnh các cơ chế bù không đủ sẽ dẫn đến HIRRT [14, 19]. Các phương thức RRT sử dụng tỷ lệ UF thấp hơn nhưng đạt được loại bỏ dịch tương đương nhờ thời gian điều trị lâu hơn có thể ít có khả năng thúc đẩy HIRRT do cơ chế này (ví dụ, CRRT <SLED <HD gián đoạn). Mặc dù rõ ràng, nó đảm bảo nhấn mạnh rằng, bất kể tỷ lệ UF, khi tỷ lệ tích lũy dịch ròng đồng thời là dương, UF quá mức có thể là nguyên nhân của HIRRT.
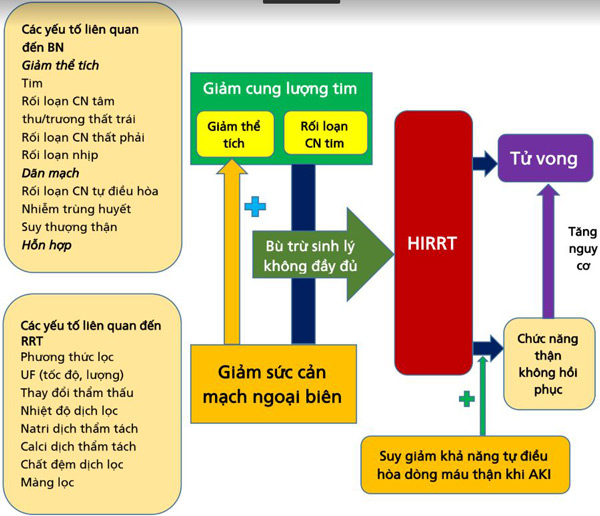
Hình 1. Tóm tắt các cơ chế cơ bản góp phần gây HIRRT. Các cơ chế bao gồm: (1) giảm thể tích máu, (2) rối loạn chức năng tâm thu / tâm trương và (3) giảm trương lực mạch máu do sốc phân phối. Chúng có thể là do các yếu tố liên quan đến bệnh nhân hoặc RRT hoặc cả hai. Thường có sự chồng chéo của các cơ chế này. HIRRT có liên quan đến tăng tỷ lệ tử vong. HIRRT (tức là hạ huyết áp tái phát) có thể làm suy giảm quá trình phục hồi thận, một hiện tượng có thể trở nên trầm trọng hơn do suy giảm khả năng tự điều hòa tưới máu thận trong AKI.
Sự phụ thuộc tiền tải, được định nghĩa là sự gia tăng đáng kể về chỉ số tim (CI) khi tăng tiền tải, có thể được đánh giá bằng thử thách dịch hoặc nâng cao chân thụ động (PLR), một thao tác làm tăng hồi lưu tĩnh mạch cho tim phải khoảng 300 mL [20]. Không có gì đáng ngạc nhiên, một PLR dương tính trước RRT đã được báo cáo là có thể dự đoán cho HIRRT. Trong một nghiên cứu của Monnet et al. [21], HIRRT được định nghĩa là MAP thấp hơn 65 mmHg (hoặc MAP thấp hơn 80 mmHg ở bệnh nhân tăng huyết áp mãn tính) và đòi hỏi phải can thiệp lâm sàng. Nghiên cứu này trên 39 bệnh nhân đã đo CI bằng cách sử dụng phương pháp pha loãng nhiệt qua phổi trước PLR và CI trong lúc PLR bằng phân tích xung liên tục. Các tác giả nhận thấy rằng sự gia tăng CI > 9% với PLR dự đoán sự xuất hiện của HIRRT với độ nhạy 77% và độ đặc hiệu 96% [21]. Một nghiên cứu khác về 47 bệnh nhân ICU cần HD trong ICU của Bitker et al. [4] CI đo bằng cách sử dụng phân tích xung liên tục với thiết bị PiCCO® và thực hiện test PLR khi bắt đầu HIRRT, được xác định là lần xuất hiện đầu tiên của MAP dưới 65 mmHg. Họ thấy rằng sự phụ thuộc tiền tải chỉ có mặt ở 19% các đợt như vậy. Điều này cho thấy sự phụ thuộc tiền tải, mặc dù có liên quan rõ ràng trong HIRRT, có thể không phải là nguyên nhân chính của HIRRT ở nhiều bệnh nhân bị bệnh nghiêm trọng với AKI đang điều trị bằng RRT trong ICU [4]. Để phù hợp với phát hiện này, Schortgen et al. [5] trước đây cho thấy HIRRT thường xuyên xảy ra sớm trong quá trình HD ở bệnh nhân ICU, trước khi xảy ra rút dịch đáng kể qua UF. Hơn nữa, các biến số lâm sàng liên quan đến HIRRT phụ thuộc vào tiền tải được xác định bởi Bitker et al. bao gồm việc sử dụng thông khí cơ học và chỉ số thấm mạch máu phổi cao hơn (PVPI) khi khởi phát HD. Thông khí cơ học áp lực dương sẽ tự làm giảm tiền tải thất phải và do đó có thể khiến bệnh nhân mắc phải HIRRT khi có giảm tiền tải với RRT. PVPI cao hơn phản ánh tính thấm mao mạch tăng trong mạch máu phổi và có khả năng tương quan với việc làm đầy thể tích huyết tương bị suy yếu (ngoài phổi) [4]. Điều này nhấn mạnh một giải thích quan trọng giúp củng cố nguy cơ HIRRT ở những bệnh nhân nguy kịch: viêm do bệnh nặng dẫn đến tăng rò rỉ mao mạch và suy giảm khả năng làm đầy lại thể tích huyết tương. Điều này làm tăng khả năng HIRRT với UF. Việc bù lại thể tích huyết tương cũng có thể bị suy yếu hiệu quả do sự gián đoạn hoặc tắc nghẽn hệ thống bạch huyết do hậu quả của phù kẽ ở bệnh nhân bị bệnh nặng [22]. Khi suy giảm khả năng bù trừ vì bất kỳ lý do gì, thậm chí tỷ lệ UF thấp hơn có thể tiên đoán sẽ thúc đẩy HIRRT.
Cuối cùng, giảm thể tích máu liên quan lọc máu có thể bị làm trầm trọng thêm bởi phản xạ Bezold -Jarisch, được kích hoạt bởi LV bóp rỗng, dẫn đến mất trương lực vận mạch giao cảm ngoại biên, hạ huyết áp và nhịp tim chậm [23]. Bệnh nhân có bệnh nền phì đại thất trái (LVH) và rối loạn chức năng tâm trương được cho là có liên quan đến hiện tượng này [14].
Hiện tượng chuyển dịch nhanh chóng áp lực thẩm thấu và keo
Khi RRT dẫn đến sự thanh thải chất tan trong huyết tương nhanh chóng, do đó, việc giảm thẩm thấu huyết tương sẽ thúc đẩy nước tự do chuyển từ khoang nội mạch sang khoang kẽ và nội bào với độ thẩm thấu tương đối cao hơn. Điều này dẫn đến giảm thể tích máu động mạch hiệu quả và giảm khả năng bù trừ thể tích huyết tương dẫn đến HIRRT khi cơ chế bù không đủ hoặc nếu kết hợp với UF quá mức. Tốc độ thay đổi độ thẩm thấu huyết tương phụ thuộc vào độ thẩm thấu trước RRT của bệnh nhân và độ thanh thải chất tan nhỏ đạt được bởi RRT. Do đó, người ta có thể mong đợi tác động dịch chuyển thẩm thấu dần dần với các phương thức RRT ngắt quản hoặc liên tục kéo dài.
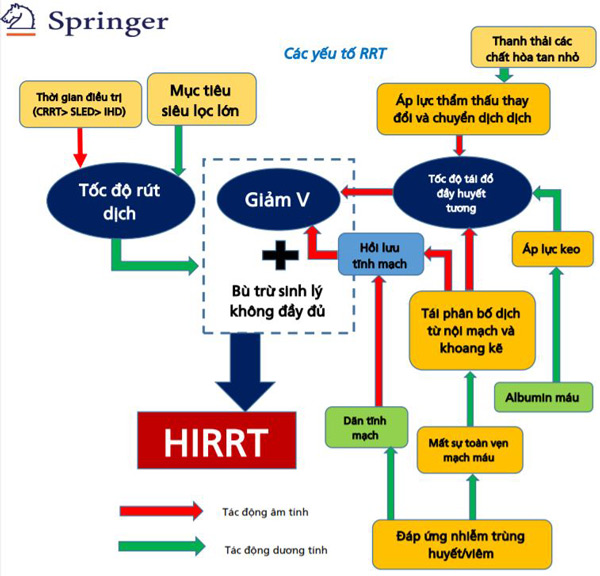
Hình 2. Các yếu tố đóng góp vào tình trạng giảm thể tích máu và HIRRT ở những bệnh nhân bị bệnh nặng có AKI cần điều trị RRT. Cả hai yếu tố liên quan đến RRT và liên quan đến bệnh nhân đều có thể góp phần gây giảm thể tích máu và phát triển HIRRT trong bối cảnh bù đắp sinh lý không đầy đủ.
Bệnh nhân HD định kỳ với ESKD với tăng độ thẩm thấu huyết tương trước lọc máu, trong khoảng là 291- 339 mOsm/kg (bình thường 275 – 295 mOsm/kg) và độ thẩm thấu huyết tương có thể giảm tới 33 mOsm/kg với HD [24 – 27]. Thẩm thấu huyết tương tính toán cao tương quan với tăng nguy cơ IDH trong nhóm dân số này [28]. Hơn nữa, liều lọc máu cao hơn với HD và tốc độ loại bỏ urê lớn hơn cũng đã được chứng minh là tương quan với IDH [29]. Dựa vào mối liên quan giữa IDH và tốc độ giảm thẩm thấu huyết do lọc máu, các nghiên cứu đã đánh giá hiệu quả của UF đơn độc (không gây ra thay đổi thẩm thấu) và các giải pháp dịch ưu trương (ngăn ngừa dịch chuyển dịch) để giảm thiểu HIRRT. Một nghiên cứu trên các bệnh nhân HD cho thấy UF đơn độc [nghĩa là HD thực hiện UF rút dịch mà không có bất kỳ loại bỏ chất hòa tan nào (nghĩa là siêu lọc)] duy trì sự ổn định huyết áp so với HD thông thường, cũng độ thẩm thấu huyết tương ổn định và ngăn ngừa hạ huyết áp thế đứng sau lọc máu với sử dụng dung dịch manitol [30]. Một nghiên cứu lớn hơn bao gồm cả bệnh nhân AKI có HD ngắt quản (không bao gồm những người dùng thuốc vận mạch hoặc chuyển cấp từ CRRT) đã phát hiện ra rằng việc sử dụng mannitol ưu trương trong khi bắt đầu HD đã ngăn chặn sự mất ổn định huyết động [31].
Mặc dù dữ liệu này chủ yếu đến từ các bệnh nhân ESKD khi HD ngắt quản, nhưng bệnh nhân bị AKI nặng bắt đầu RRT với tình trạng tăng thẩm thấu huyết tương do urê huyết cao đáng kể cũng có thể gặp phải sự thay đổi thẩm thấu nhanh chóng và có thể góp phần vào HIRRT. Các can thiệp RRT được đánh giá để chỉ ra cơ chế này ở những bệnh nhân bị bệnh nặng bao gồm việc sử dụng dịch thẩm tách natri có hoặc không có UF, và đã cho thấy kết quả hỗn hợp trong nhóm dân số này [32,34]. Tóm lại, thông tin natri liên quan đến việc bắt đầu RRT với natri thẩm tách cao, được giảm theo cách từng bước, làm giảm dịch chuyển độ thẩm thấu giữa các khoang nội mạch và kẽ [35]. Thông tin UF đề cập đến việc sử dụng tỷ lệ UF thay đổi trong điều trị để có thể sử dụng tỷ lệ tối ưu trong 1 khả năng dung nạp tốt nhất (nghĩa là khi bắt đầu thay vì kết thúc điều trị lọc máu mới sử dụng dịch để bù lại thể tích huyết tương, hoặc dựa theo một phép đo trực tuyến ‘thể tích máu tương đối’ / thể tích hồng cầu (được phản ánh bằng theo dõi hematocrit liên tục). Tác động của những can thiệp này đối với huyết động học với CRRT vẫn chưa được khám phá. Tuy nhiên, thay đổi thẩm thấu huyết thanh với CRRT sẽ chậm hơn so với các phương thức RRT khác và ít có khả năng kích thích HIRRT do thay đổi thẩm thấu.
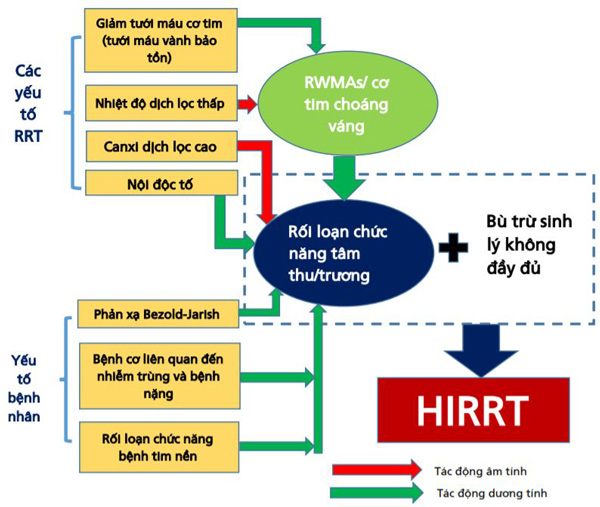
Hình 3. Các yếu tố góp phần cho rối loạn chức năng tim và HIRRT ở bệnh nhân bị bệnh nặng có AKI cần điều trị RRT. Cả RRT và các yếu tố liên quan đến bệnh nhân đều có liên quan, trong trường hợp bù đắp sinh lý không đầy đủ. RRT gây ra các đợt thoáng qua của giảm tưới máu cơ tim, dẫn đến cảnh cơ tim choáng váng, gây bất thường vận động vùng (RWMA). Sự thay đổi của UF và thẩm thấu có thể gây ra giảm thể tích máu có thể làm thúc đẩy xuất hiện phản xạ Bezold-Jarisch. Các yếu tố của bệnh nhân bao gồm bệnh tim tiềm ẩn, mức độ bệnh nặng và điều trị liên quan (thở máy, dịch và thuốc vận mạch) và các biến chứng của bệnh nặng như thiếu máu cục bộ mà bản thân có thể bị trầm trọng hơn do HIRRT (không được hiển thị).
Sử dụng nồng độ dialysate natri cao (> 145 mmol/L, không có hồ sơ), để hạn chế sự thay đổi thẩm thấu và thúc đẩy sự ổn định huyết động, là một thành phần của chế độ cho thấy hạn chế HIRRT trong một nghiên cứu quan trọng của Schortgen et al. [5] (thảo luận chi tiết hơn trong phần về tiếp cận Phương pháp tiếp cận đa phương thức để ngăn chặn HIRRT,). Tuy nhiên, cần lưu ý rằng các biện pháp can thiệp đồng thời (chẳng hạn như sử dụng phương pháp thẩm tách mát) cũng có thể đóng một vai trò trong hiệu quả của chế độ này. Một mối quan tâm về mặt lý thuyết của thẩm tách natri cao ở bệnh nhân ESKD là nó có thể dẫn đến cân bằng natri dương tính cho bệnh nhân khi kết thúc điều trị do đó làm trầm trọng thêm tình trạng quá tải chất lỏng trong thời gian dài hơn, vì điều này sẽ làm tăng cơn khát. Điều này có thể ít áp dụng cho bệnh nhân bị bệnh nặng. Tải natri cũng có thể được bãi bỏ phần nào nếu những cải thiện về độ ổn định huyết động cho phép loại bỏ chất lỏng (chứa natri) lớn hơn thông qua UF.
Bản thân áp lực keo huyết tương chủ yếu do albumin và hạ albumine máu có liên quan đến tăng nguy cơ IDH trong các nghiên cứu đoàn hệ của bệnh nhân HD [36, 37]. Bệnh nhân mắc bệnh nặng thường bị hạ albumine máu [38] và vì albumin là tác nhân chính gây ra áp lực keo huyết tương [39], đây có thể là một cơ chế góp phần làm suy giảm thể tích nội mạch tương đối trong nhóm dân số này. Do đó, albumin thường được đề xuất để ngăn ngừa hoặc điều trị HIRRT trong việc HD và nhóm dân số bị bệnh nặng. Tuy nhiên, rất ít bằng chứng tồn tại trong lĩnh vực này. Một thử nghiệm chéo ngẫu nhiên ở bệnh nhân HD có IDH được điều trị bằng 5% albumin so với nước muối báo cáo không có sự khác biệt đáng kể trong việc đạt được mục tiêu rút dịch [40]. Ở những bệnh nhân bị nhiễm trùng nghiêm trọng, một nghiên cứu đã đánh giá việc mồi HD với dung dịch 17,5% albumin so với nước muối và thấy rằng albumin cải thiện đáng kể khả năng dung nạp huyết động của HD. Tuy nhiên, cần lưu ý rằng đây là một thử nghiệm chéo chỉ bao gồm tám bệnh nhân [41].
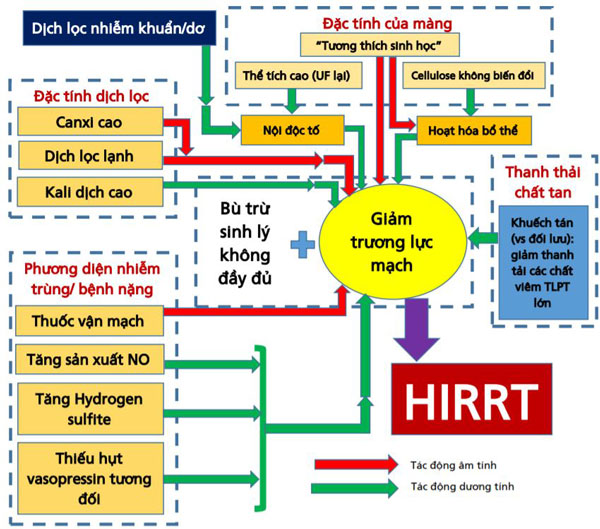
Hình 4. Những yếu tố đóng góp làm giảm trương lực mạch máu dẫn đến HIRRT ở những bệnh nhân bị bệnh nặng có AKI cần RRT (+) và một số chiến lược điều trị (-). Các yếu tố liên quan đến RRT và liên quan đến bệnh nhân, tương ứng được biểu thị ở trên cùng và dưới cùng của hình.
Hiện tượng cơ tim choáng váng
Các cơ chế liên quan đến tim bao gồm các yếu tố thúc đẩy HIRRT của bệnh nhân và RRT được tóm tắt trong Hình 3.
Rối loạn chức năng tim thoáng qua ở bệnh nhân HD duy trì, đặc trưng bởi các rối loạn vận động vùng bất thường (RWMAs- regional wall motion abnormalities) hoặc “cơ tim choáng váng”, đã được báo cáo và xuất hiện liên quan đến giảm tưới máu cơ tim trong trường hợp không có bệnh mạch vành do xơ vữa động mạch [47]. Mặc dù không rõ đây là nguyên nhân hay hậu quả của HIRRT, nhưng có bằng chứng cho thấy hiện tượng này không phụ thuộc vào việc loại bỏ thể tích, do các rối loạn chức năng tâm thu và tâm trương LV thường xảy ra sớm sau khi bắt đầu các phiên HD, trước khi xảy ra quá trình siêu lọc. Ngoài ra, lưu lượng máu động mạch vành dường như được duy trì ở bệnh nhân HD trong khi họ đang gặp phải hiện tượng này [48]. Các phản ứng viêm liên quan đến tiếp xúc máu với bề mặt màng lọc có thể góp phần vào cơ chế không phụ thuộc thể tích này của cơ chế cơ tim choáng váng [49, 50]. Không phụ thuộc vào nguyên nhân nền, choáng váng cơ tim liên quan đến RRT cũng đã được mô tả ở những bệnh nhân bị bệnh nặng: một nghiên cứu thí điểm trên 11 bệnh nhân nhập viện với AKI được điều trị bằng HD, không cần điều trị các thuốc inotrope hoặc máy thở, cho thấy tất cả các bệnh nhân đều phát triển bệnh cơ tim choáng váng với hiện tượng RWMA trong quá trình lọc máu và suy giảm khả năng co bóp toàn bộ LV [51]. Hiện tượng này gần đây cũng đã được báo cáo ở những bệnh nhân bị bệnh nặng được điều trị bằng CRRT: 10 trong số 11 bệnh nhân đã phát triển RWMA mới trong 4 giờ đầu bắt đầu CRRT (mặc dù duy trì huyết động ổn định) [52].
Bảng 1. Các can thiệp liên quan đến RRT để hạn chế HIRRT
| Can thiệp | Cơ chế chính | Bằng chứng ủng hộ | Thông tin thêm |
| Giới hạn UF Giảm mục tiêu UF Kéo dài thời gian điều trị | Cho phép làm đầy thể tích huyết tương để thay thế loại bỏ dịch nội mạch bằng UF và do đó ngăn ngừa giảm thể tích máu nội mạch. | Lợi ích huyết động của CRRT/SLED so với IHD được cho là bằng chứng nhưng mức độ cao từ các thử nghiệm so sánh là thiếu (vì chúng có thể không khả thi/an toàn). | Giảm các mục tiêu loại bỏ dịch có thể dẫn đến quá tải dịch lớn hơn có liên quan tăng tỷ lệ tử vong. Cần thêm nguồn lực chăm sóc sức khỏe nếu cần thêm thời gian lọc máu. HIRRT là phổ biến trên các phương thức RRT (bao gồm CRRT). |
| Phương thức RRT chậm (i.e., SLED/CRRT). | Ít chuyển dịch độ thẩm thấu và giảm tỷ lệ UF: tăng tái tạo thể tích huyết tương và ít bị giảm thể tích máu. | Lợi ích huyết động của CRRT/SLED so với IHD được cho là bằng chứng nhưng mức độ cao từ các thử nghiệm so sánh là thiếu (vì chúng có thể không khả thi/an toàn). | Giảm các mục tiêu loại bỏ dịch có thể dẫn đến quá tải dịch lớn hơn có liên quan tăng tỷ lệ tử vong. Cần thêm nguồn lực chăm sóc sức khỏe nếu cần thêm thời gian lọc máu. HIRRT là phổ biến trên các phương thức RRT (bao gồm CRRT) |
| Chỉ UF (không lấy chất hoàn tan) | Không có sự chuyển dịch độ thẩm thấu, tăng bù thể tích huyết tương. | Ổn định huyết động của UF mà không có thanh thải khuếch tán so với HD. | UF đơn độc cho phép loại bỏ dịch nhưng không thanh thải chất hòa tan. [Nó chỉ liên quan đến thanh thải bằng đối lưu (thông qua lực kéo chất tan) nếu thêm dịch pha loãng. Không có thanh thải khuếch tán là hiệu quả hơn nhiều trong việc xóa các phân tử nhỏ]. |
| Truyền dịch ưu trương (nước muối ưu trương, mannitol, albumin). | Chuyển dịch độ thẩm thấu ít hơn, tăng áp lực kéo ngăn ngừa giảm thể tích máu nội mạch. | Thẩm thấu huyết tương trước HD cao hơn và giảm albumin huyết liên quan đến tăng nguy cơ HIRRT; thiếu bằng chứng cho truyền albumin. | Ở những bệnh nhân nguy kịch, tỷ lệ tinh thể: keo hoàn toàn thấp hơn mong đợi. Ở những bệnh nhân bị nhiễm trùng có mao mạch bị rò rỉ, albumin (hoặc mannitol) có thể ít tồn tại trong khoang nội mạch để tạo ra sự thẩm thấu hoặc áp lực keo. |
| Dịch thẩm tách có Na+ cao hơn. | Dịch chuyển thẩm thấu ít hơn; giảm lưu lượng máu nội mạch ít hơn. | Lợi ích huyết động ở bệnh nhân nguy kịch có kết quả hỗn hợp. | Có thể dẫn đến cân bằng natri dương, tương quan với tăng cân giữa các kỳ lọc trong IHD. Không rõ điều này có liên quan đến dân số bệnh nhân AKI/bệnh nhân nguy kịch không? |
| Dịch thẩm tách có nhiệt độ thấp hơn. | Thúc đẩy sự co mạch, tăng SVR, giới hạn hiện tượng cơ tim choáng váng. | Lợi ích huyết động ở bệnh nhân ESRD khi IHD và bảo vệ tim mạch: giảm khối lượng LV, chức năng LV được bảo tồn. | Bằng chứng mạnh mẽ cho thấy nó cải thiện sự ổn định huyết động ở bệnh nhân chạy thận nhân tạo duy trì. Hạn chế hiện tượng choáng váng cơ tim trong nhóm dân số này. Các nghiên cứu cho thấy choáng váng cơ tim cũng xảy ra ở những bệnh nhân nguy kịch trên IHD và CRRT. |
| Dịch thẩm tách giàu Ca2+ Chênh Ca2+ máu và dịch thấp. | Tăng co bóp cơ tim, giảm nguy cơ rối loạn nhịp tim, tăng trương lực mạch máu. | Cải thiện dung nạp huyết động; tăng nguy cơ ngừng tim khi có thẩm tách chứa Ca2+ thấp hơn; tăng tỷ lệ tử vong với giảm Ca2+ trong AKI ở bệnh nhân bị bệnh nặng. | Hạ huyết trong lúc lọc máu ở bệnh nhân chạy thận nhân tạo duy trì.
Những tác hại tiềm ẩn liên quan đến cân bằng canxi dương trong dân số này. Rủi ro/lợi ích không rõ ràng ở những bệnh nhân nguy kịch. |
| Đệm Bicarbonate (so với lactate). | Không gây nhiễm axit lactic. Nhiễm axit có thể dẫn đến liệt mạch, ít đáp ứng với thuốc vận mạch. | Ít HIRRT (và nhiễm toan) với đệm bicarbonate vs đệm lactate. | Sự tích lũy lactate xảy ra với dung dịch đệm lactate khi rối loạn chức năng gan ngăn cản sự chuyển đổi nhanh chóng thông thường của lactate thành bicarbonate. |
| Màng tương thích sinh học. | Giảm thiểu kích hoạt bổ thể và phản ứng viêm. | Cellulose không biến đổi (cuprophane) liên quan đến kết quả tồi tệ hơn. | Màng lọc tương thích sinh học là tiêu chuẩn trong thực tế hiện nay. |
| Thanh thải thông qua đối lưu; HVHF. | Cải thiện độ thanh thải của các chất hòa tan có trọng lượng phân tử cao hơn có thể làm giảm viêm và do đó làm giảm sự giãn mạch, làm choáng váng cơ tim. | Bằng chứng hỗn hợp cho lợi ích huyết động hoặc cải thiện tỷ lệ tử vong; HVHF không được chứng minh là có lợi trong AKI do nhiễm trùng máu. | Loại bỏ các yếu tố chống viêm trọng lượng phân tử cao cũng xảy ra với HVHF và có thể phủ nhận bất kỳ lợi ích tiềm năng nào trong nhiễm trùng huyết/AKI. |
Ảnh hưởng của nhiệt độ trong RRT
Việc sử dụng phương pháp dịch thẩm tách mát có thể cải thiện khả năng chịu đựng huyết động của RRT bằng cách tăng sức cản mạch máu toàn thân và tập trung lượng máu bằng cách co mạch ngoại vi và nội tạng [14, 53]. Điều chỉnh nhiệt độ thẩm tách thấp phổ biến nhất gồm có làm mát cố định, lập trình và đẳng nhiệt, giảm nhiệt độ thẩm tách theo kinh nghiệm, giảm nhiệt độ thẩm tách tiêu chuẩn dưới nhiệt độ cơ thể và duy trì nhiệt độ trước lọc máu, tương ứng[53]. Bằng chứng về phương pháp thẩm tách mát giúp cải thiện khả năng chịu huyết động của RRT mà không ảnh hưởng đến tính thỏa đáng của điều trị được tóm tắt trong các tổng quan hệ thống và phân tích tổng hợp từ các nghiên cứu ở bệnh nhân ESKD mãn tính trên HD, cũng như bao gồm các phương pháp làm mát trong các phân tích [54, 55]. Một nghiên cứu quan trọng của Selby et al. cũng chứng minh rằng, ở những bệnh nhân ESKD trên HD, rối loạn chức năng thất trái do lọc máu (cơ tim choáng váng) đã được cải thiện bằng cách sử dụng phương pháp thẩm tách mát [56].
Việc sử dụng phương pháp thẩm tách RRT mát để phòng ngừa HIRRT ở những bệnh nhân bị bệnh nghiêm trọng trên các phương thức RRT ít được thiết lập. Lọc máu đẳng nhiệt với theo dõi thể tích máu, một kỹ thuật theo đó nhiệt độ thẩm tách được điều chỉnh để duy trì nhiệt độ bệnh nhân và lượng máu được theo dõi để dự đoán hạ huyết áp, không làm giảm tỷ lệ mắc HIRRT với HD trong RCT của 74 bệnh nhân bị bệnh nặng với AKI (N = 574 phiên RRT). Tuy nhiên, nhóm điều trị chuẩn trong nghiên cứu này đã được thẩm tách bằng phương pháp thẩm tách mát và nồng độ natri và canxi thẩm tách cao [57]. Một RCT khác gồm 39 bệnh nhân bị bệnh nặng đã đánh giá các phiên SLED (N = 62 phiên) bằng cách sử dụng phương pháp thẩm tách mát kết hợp với mô hình natri và UF và điều này giúp cải thiện huyết động học [33]. Một nghiên cứu thử nghiệm ngẫu nhiên chéo ngẫu nhiên gần đây trên bệnh nhân dùng SLED cho AKI (N = 21 bệnh nhân, 39 phiên RRT mỗi nhóm) cho thấy rằng phương pháp thẩm tách đơn thuần (không có mô hình natri hoặc UF) đã bảo vệ chống lại HIRRT [58].
Trong CRRT, bằng chứng liên quan đến việc làm mát kém mạnh mẽ hơn. Rokyta et al. đã thực hiện một nghiên cứu về làm mát bằng phương pháp lọc máu tĩnh mạch liên tục (CVVH) (chứ không phải phương pháp thẩm tách mát) trên huyết động học toàn phần ở chín bệnh nhân nhiễm trùng huyết, cho thấy làm mát lõi nhẹ làm tăng SVR và MAP, mà không ảnh hưởng đến cân bằng năng lượng và oxy của gan [59]. Một nghiên cứu thí điểm nhỏ (RCT với thiết kế chéo, N = 30 bệnh nhân) về cài đặt nhiệt độ thấp hơn tại thời điểm bắt đầu CRRT cho thấy nó đã cải thiện độ ổn định huyết động [60]. Nhìn chung, việc giảm nhiệt độ cơ thể bằng RRT xuất hiện một chiến lược đầy hứa hẹn để tinh chỉnh và theo đuổi với mục tiêu giảm HIRRT qua các phương thức RRT.
Các thành phần dịch lọc/RRT
Nồng độ canxi
Nồng độ canxi của dịch thẩm tách (phạm vi điển hình trong dịch là 1,0-1,75 mmol/L) cũng có thể ảnh hưởng đến sự co bóp của cơ tim và nguy cơ rối loạn nhịp tim, cũng như trương lực mạch máu. Nồng độ canxi thẩm tách thấp hơn và do đó độ chênh canxi huyết thanh – thẩm tách có liên quan đến việc tăng nguy cơ ngừng tim đột ngột ở bệnh nhân HD [61]. Hạ canxi máu thường gặp ở bệnh nhân bị bệnh nặng và canxi ion hóa <1,0 mmol/L đã được tìm thấy là một yếu tố dự báo độc lập về tỷ lệ tử vong do mọi nguyên nhân cao hơn ở bệnh nhân bị bệnh nghiêm trọng có AKI cần điều trị RRT [62]. Mặc dù Fellner và cộng sự. [63] nhận thấy rằng toàn bộ sức cản mạch máu toàn thân không bị ảnh hưởng đáng kể bởi sự thay đổi nồng độ canxi ion hóa trong máu, Scholze et al. [64] cho thấy trong quá trình HD với nồng độ canxi dịch thẩm tách là 1,75 mmol/L, nồng độ canxi ngoại bào tăng lên cùng với tăng trương lực động mạch thu được từ sóng xung động mạch. Về mặt cơ học, những thay đổi liên quan đến sinh lý của canxi ngoại bào trong RRT có thể làm giảm nguy cơ HIRRT bằng cách tăng trương lực mạch máu thông qua kích hoạt trực tiếp các thụ thể nhạy cảm canxi (CaSR) biểu hiện trên các tế bào cơ trơn mạch máu [65]. Chưa có nghiên cứu nào đánh giá tác động huyết động của canxi dịch thẩm tách cao ở bệnh nhân bị bệnh nặng có AKI. Thay vào đó, một số nghiên cứu đã sử dụng nồng độ canxi thẩm tách 1,75 mmol/L trong đơn thuốc chạy thận tiêu chuẩn của họ [5,33,57], đề nghị sử dụng chuẩn canxi thẩm tách cao hơn trong ICU của họ, mặc dù không có sự đồng thuận về thực hành này trong tài liệu hiện nay [ 66].
Mặc dù có thể kết luận rằng nồng độ canxi trong huyết thanh có tác động đến huyết động học cũng như các kết quả khác và tăng nồng độ canxi dịch thẩm tách có thể là một chiến lược khả thi để giảm HIRRT, và có những cảnh báo quan trọng. Điều này không có khả năng áp dụng cho những bệnh nhân dùng CRRT với thuốc chống đông máu citrate tiêu chuẩn do yêu cầu về các giải pháp không chứa canxi (và truyền canxi sau bơm) để đạt được chống đông máu cục bộ. Quan trọng hơn, một số nghiên cứu tiền lâm sàng và lâm sàng đã chỉ ra rằng việc sử dụng canxi để điều trị hạ canxi máu ở bệnh nhân bị bệnh nghiêm trọng không cần điều trị RRT có thể gây hại [67]. Việc sử dụng canxi trong dịch thẩm tách cao hơn để ngăn ngừa HIRRT không phải là đối tượng của các nghiên cứu nghiêm ngặt đánh giá sự an toàn của nó ở những bệnh nhân nguy kịch. Nhìn chung, điều này nhấn mạnh sự cần thiết của các thử nghiệm đánh giá kết quả lâm sàng có ý nghĩa trước khi áp dụng các biện pháp can thiệp thường xuyên để giảm thiểu HIRRT chỉ dựa trên các nguyên tắc sinh lý.
Bảng 2. Tóm tắt các nghiên cứu đánh giá các can thiệp liên quan đến RRT đối với HIRRT ở bệnh nhân bị bệnh nặng.
| Nghiên cứu | Thiết kế | Can thiệp | Xuất hiện HIRRT | Thống kê |
| IHD | ||||
| Lynch [82] | Đoàn hệ hồi cứu N = 191 BN; 892 phiên. | Dịch thẩm tách thêm Natri | Case: 36/242 = 14.9% Control: 59/650 = 9.1% | NS |
| du Cheyron [83] | RCT
N = 74 BN 574 phiên |
Kiểm soát máu và nhiệt độ. | BVM: 33/190= 17.4% BVM + BTM: 30/194 = 15.5% Control: 32/188 =17.0% | NS |
| du Cheyron et al. [57] | Đoàn hệ tiến cứu N = 62 BN; 572 phiên | Kiểm soát máu và nhiệt độ | Case: 41/189= 21.7% Control: 110/383 = 28.7% | P = 0.09 |
| Schortgen et al. [5] | Đoàn hệ hồi cứu N = 121 BN; 537 phiên | Tiếp cận đa phương thức | Case: 176/289 = 60.9% Control: 176/248 = 71.0% | P = 0.015 |
| Paganini et al. [34] | Bắt chéo ngẫu nhiên N = 10 BN; 60 phiên | Biến đổi natri dịch thẩm tách và UF | Case: 16.0% Control: 45.5% | Not reported |
| Jardin et al. [41] | Đoàn hệ tiến cứu N = 8 BN; 53 phiên | Mồi dịch 17.5% albumin vs saline | Albumin: MAP ổn định và UF hơn (530 mL/h vs 366 mL/h) | MAP: P < 0.001 UF không báo cáo |
| SLED | ||||
| Edrees et al. [58]Băt chéo ngẫu nhiên | N = 21 BN 78 phiên | Nhiệt độ dịch thẩm tách thấp hơn (35°C vs 37°C) | Case: 0.7± 0.7 Control: 1.5 ± 1.1 | P < 0.0001. |
| Albino [84] RCT | N = 75 BN
195 phiên |
Thời gian RRT: 6 h vs 10 h | 6h: 63/100 =55.8% 10h: 53/95 =63.0% | NS |
| Lima et al. [33] RCT | N = 39 BN 62 phiên | Hạ nhiệt độ thẩm tách với điều chỉnh thẩm tách natri và UF | Case: 8/34 = 23.5%.
Control: 16/28 = 57.1% |
P = 0.009 |
| CRRT | ||||
| Robert et al. [60] | Bắt chéo ngẫu nhiên N = 30 BN | Làm ấm thấp hơn (36 °C vs 38 °C) | Ít can thiệp hơn cho HIRRT với nhiệt độ lạnh hơn | P = 0.08 |
| Eastwood et al. [46] | Đoàn hệ tiến cứu N = 21 BN 41 bắt đầu RRT | Tốc độ bơm CRRT | Không có HIRRT được báo cáo khi bắt đầu CRRT | Không |
| Rokyta et al. [59] | Đoàn hệ tiến cứu N = 9 BN | CRRT làm mát (SF và RB làm ấm 37°C vs không làm ấm) | MAP và SVR tăng với việc làm lạnh | P < 0.05 |
P < 0.05Theo dõi thể tích máu BVM, theo dõi nhiệt độ máu BTM, điều trị thay thế thận liên tục CRRT, mất ổn định huyết động liên quan đến điều trị thay thế thận HIRRT, huyết áp trung bình MAP, thử nghiệm ngẫu nhiên có kiểm soát RCT, thay thế SF, máu trở lại RB, siêu lọc UF.
Kali có đặc tính vận mạch: truyền kali vào động mạch gây ra sự giãn mạch từ quá trình siêu phân cực của các tế bào cơ trơn mạch máu do kích hoạt cả hai kênh Na+ /K + -ATPase và kênh Kali đi vào(Kir), và làm giảm nồng độ kali trong máu gây co mạch [68]. Dolson et al. [69] so sánh ảnh hưởng của nồng độ kali trong dịch thẩm tách khác nhau (1.0, 2.0 và 3.0 mmol/L) ở 11 bệnh nhân ESKD trên HD, và mặc dù không có sự khác biệt đáng kể về huyết áp trong máu giữa các nhóm, họ thấy có ý nghĩa tăng huyết áp 1h sau lọc máu với nồng độ kali dịch thẩm tách thấp hơn (1,0 – 2,0 mmol/L), mà nghiên cứu gọi là ‘tăng huyết áp hồi phục’. Họ đưa ra giả thuyết rằng hiệu ứng này đã qua trung gian một phần bởi sự co mạch động mạch hệ thống [69]. Một nghiên cứu chéo ngẫu nhiên của Gabutti et al. [70] trong số 24 bệnh nhân ESKD và 288 buổi HD cho thấy, tuy nhiên, nồng độ kali dịch thẩm tách thấp, làm giảm kali huyết thanh nhanh chóng, dẫn đến giảm huyết áp, tương quan với giảm sức cản ngoại biên. Hiệu ứng huyết động này được thấy rõ nhất trong giai đoạn lọc máu ban đầu khi sự khác biệt kali giữa thẩm tách và huyết thanh là lớn nhất và giảm dần trong suốt phiên khi khoảng cách thu hẹp [70]. Sự giảm huyết áp thoáng qua liên quan đến việc hạ kali huyết thanh do sử dụng kali thẩm tách thấp không phù hợp với sinh lý thực nghiệm được mô tả ở trên. Điều này có thể được quy cho sự khác biệt quan trọng giữa sinh lý của các mô hình thí nghiệm trên động vật và bệnh nhân mắc ESKD cần RRT, những người dễ bị rối loạn chức năng tim và tự chủ. Hơn nữa, không có nghiên cứu đánh giá ảnh hưởng của nồng độ kali thẩm tách ở bệnh nhân bị bệnh nặng có AKI.
Chất đệm
Trong lịch sử, hệ đệm trong dịch thẩm tách dựa vào acetate có liên quan đến HIRRT nhưng không còn phù hợp với thực hành lâm sàng hiện tại.
Lactate, đôi khi được sử dụng làm chất đệm thẩm tách, thường được gan chuyển hóa thành bicarbonate. Nếu quá trình này bị suy yếu do rối loạn chức năng gan trong bệnh hiểm nghèo, nhiễm toan do tích lũy lactate có thể dẫn đến [71]. Một tổng quan hệ thống của Cochrane về bốn nghiên cứu so sánh các dịch đệm bicarbonate với các dịch đệm lactate cho AKI đã kết luận rằng, mặc dù không có sự khác biệt đáng kể về tỷ lệ tử vong, phương pháp thẩm tách dựa trên bicarbonate dẫn đến HIRRT ít hơn và nồng độ lactate huyết thanh thấp hơn [72]. Kết quả là, bộ đệm dựa trên bicarbonate là tiêu chuẩn trong thực tế hiện nay [73].
Màng tương thích sinh học
Không tương thích sinh học màng lọc (bộ lọc) có thể gây sốc dãn mạch (bao gồm sốc phản vệ) và HIRRT. Không tương thích sinh học đề cập việc tăng bạch cầu và hoạt hóa bổ thể trong mạch ngoại bào chủ yếu ở màng lọc máu, nơi máu tiếp xúc với vật liệu phi sinh học [73]. Màng lọc không tương thích sinh học không còn được sử dụng thường xuyên và hầu hết các vấn đề liên quan đến việc sử dụng màng cellulose không biến đổi trong lịch sử. Các nguyên nhân và nhiều chi tiết khác, HIRRT liên quan đến tính không tương thích sinh học của màng được xem xét trong Bảng 1.
Nội độc tố
RRT có nguy cơ ô nhiễm vi khuẩn dịch thẩm tách với endotoxin và giải phóng đoạn DNA vi khuẩn có thể kích hoạt các con đường viêm [74] dẫn đến các biến chứng lâm sàng [75]. Hơn nữa, tính thấm nội độc tố có thể khác nhau giữa các loại màng lọc tổng hợp [76]. Màng lọc thẩm tách lưu lượng cao được sử dụng trong HD đòi hỏi dịch thẩm tách siêu tinh khiết để giảm nguy cơ ô nhiễm vi khuẩn hoặc nội độc tố bằng cách lọc ngược (ví dụ, chuyển đối lưu) [77]. Cần xử lý nước đúng cách và kiểm soát chất lượng nước và dịch thẩm tách để giảm nguy cơ bệnh nhân tiếp xúc với vi khuẩn và các sản phẩm của chúng, dẫn đến việc thiết lập các tiêu chuẩn về nước và dịch thẩm tách [78].
Bảng 3. Gợi ý phòng ngừa và quản lý HIRRT ở bệnh nhân bệnh nặng
| Yếu tố RRT | Đề nghị | Lý do | Bàn luận |
| Tỷ lệ Siêu lọc (loại bỏ fuid). | Đặt mục tiêu loại bỏ dịch để tránh/ giảm cân bằng dịch dương. Kiểm tra sự phụ thuộc tiền tải khi HIRRT xảy ra và chỉ làm giảm các mục tiêu siêu lọc nếu có sự phụ thuộc tiền tải. | HIRRT có nhiều nguyên nhân vượt ra ngoài sự siêu lọc quá mức. Do đó, việc giảm mục tiêu siêu lọc không phải lúc nào cũng là phản ứng thích hợp đối với HIRRT (đặc biệt đối với những bệnh nhân bị quá tải dịch ngày càng tồi tệ). | Bắt đầu (hoặc tăng liều) thuốc vận mạch hoặc inotrope có thể là một chiến lược phù hợp hơn để quản lý HIRRT khi nó không liên quan đến siêu lọc quá mức. |
| Thời gian điều trị. | Kéo dài thời gian điều trị cho các phương thức RRT không liên tục nếu cần loại bỏ dịch. Ví dụ, đối với HD không liên tục, sử dụng thời gian điều trị tối thiểu 4 giờ; đối với SLED, xem xét kéo dài thời gian điều trị thông thường. | Thời gian điều trị lâu hơn cho phép tỷ lệ siêu lọc thấp hơn để đạt được cùng một mục tiêu siêu lọc. Như vậy, nhiều khả năng cho phép tái tạo làm đầy huyết tương để ngăn ngừa HIRRT. | Đối với HD không liên tục, không kéo dài thời gian điều trị vượt quá 4-5 h nếu sử dụng phương pháp thẩm tách máu tốc độ dòng máu thông thường (có thể dẫn đến mất cân bằng lọc máu do quá trình thai thải chất tan quá mức). Đối với SLED, hãy xem xét các phiên quay lần này đến lần khác để đạt được mục tiêu loại bỏ dịch nếu phần mềm máy không cho phép gia hạn thời gian điều trị. |
| Liều lượng (tỷ lệ dòng). | Bắt đầu với độ thanh thải chất tan nhỏ vừa phải, đặc biệt là ở những bệnh nhân mắc bệnh urê huyết đáng kể (tăng áp lực thẩm thấu). Ví dụ, đối với HD không liên tục, QB ≤ 200 mL/phút và QB ≤ 300 mL/phút; đối với CRRT, tổng tốc độ hiệu quả 20-25 mL/kg/giờ. | Giảm dần độ thẩm thấu huyết tương gây ra sự dịch chuyển ít hơn và thúc đẩy quá trình tái tạo huyết tương. Đảm bảo đủ liều RRT khi độ thẩm thấu/urê huyết đã giảm. | Tốc độ máu không ảnh hưởng đến độ thanh thải chất tan nhỏ trong CRRT (phụ thuộc nhiều hơn vào tổng tốc độ dịch đến). Do đó, người ta không nên giảm QB trong CRRT xuống thấp hơn bình thường (~ 150 đến 200 mL/phút) vì nguy cơ đông máu sẽ tăng lên và sẽ không giảm HIRRT. |
| Thẩm tách nồng độ natri. | Sử dụng nồng độ natri thẩm tách cao hơn cho các liệu pháp không liên tục (HD và SLED): ví dụ: ≥ 145 mmol/L. | Sự chuyển dịch thẩm thấu giảm cho phép xảy ra nhiều phản ứng huyết tương hơn. | Không sử dụng chiến lược này ở những bệnh nhân bị hạ natri máu do nguy cơ điều chỉnh quá nhanh nếu sử dụng các giải pháp thẩm tách natri cao hơn. |
| Nồng độ canxi dịch thẩm tách. | Cân nhắc sử dụng nồng độ canxi dịch thẩm tách cao hơn (ví dụ: 1,5 hoặc 1,75 mmol/L) cho các liệu pháp không liên tục (HD và SLED). | Kích hoạt các thụ thể nhạy cảm canxi trên các tế bào cơ trơn mạch máu làm tăng trương lực mạch máu. Canxi cao làm tăng cường tim co bóp. | Một số nghiên cứu đã chỉ ra rằng sử dụng canxi để điều chỉnh hạ canxi máu ở bệnh nhân bị bệnh nặng (không cần điều trị RRT) có thể gây hại. Sự an toàn của việc sử dụng thường xuyên nồng độ canxi trong dịch thẩm tách cao hơn ở những bệnh nhân nguy kịch chưa được nghiên cứu. |
| Nhiệt độ dịch lọc. | Sử dụng phương pháp thẩm tách mát cho HD hoặc SLED không liên tục: tức là, thấp hơn 0,5°C so với nhiệt độ của bệnh nhân (giảm xuống tối thiểu 35,0 – 35,5°C). | Làm mát thúc đẩy co mạch ngoại vi và tăng thể tích máu trở lại. Cũng làm giảm hiện tượng choáng váng cơ tim (có lẽ dẫn đến cải thiện cung lượng tim). | Hầu hết các máy HD không liên tục, phần mềm không cho phép cài đặt nhiệt độ thẩm tách < 35.0-35,5°C (và sự an toàn của việc sử dụng nhiệt độ thấp hơn mức này chưa được nghiên cứu). Có ít bằng chứng liên quan đến tác động của bệnh nhân làm mát khi sử dụng CRRT so với việc hỗ trợ sử dụng phương pháp thẩm tách mát trong SLED và HD ngắt quản. |
| Dung dịch đệm | Sử dụng một dung dịch đệm dựa trên bicarbonate (so với dựa trên lactate). | Các hoạt động dựa trên Lactate xuất hiện nhiều HIRRT hơn. | Các phép bổ trợ dựa trên axetat không còn được sử dụng do tăng nguy cơ HIRRT. |
Liệu pháp thay thế thận liên tục CRRT, điều trị thay thế thận RRT, chạy thận nhân tạo HD, SLED lọc thận chậm, mất ổn định huyết động liên quan đến RRT-HIRRT , tốc độ máu QB, tốc độ dịch lọc, bệnh thận giai đoạn cuối của ESKD.
Tần suất và tác động của ô nhiễm chất lỏng với CRRT là không rõ ràng. Một nghiên cứu trên 24 mạch dịch thay thế CVVH cho thấy các vi phạm về tính toàn vẹn của vi sinh vật có bằng chứng nuôi cấy dịch thay thế dương tính và xét nghiệm nội độc tố, và hình thành các biofilm trong ống [79]. Các tác giả đề xuất rằng ô nhiễm mạch có thể đã xảy ra thông qua các kết nối không vô trùng của túi dịch thay thế. Ý nghĩa lâm sàng của ô nhiễm dịch thay thế không được đánh giá, nhưng nghiên cứu này vẫn nhấn mạnh sự cần thiết của các biện pháp kiểm soát nhiễm trùng nghiêm ngặt.
Các mode khuếch tán và đối lưu
Phương thức thanh thải chất hòa tan là một khía cạnh có thể sửa đổi của đơn thuốc RRT về mặt lý thuyết có thể ảnh hưởng đến trương lực mạch máu, đặc biệt ở bệnh nhân nhiễm trùng huyết: việc sử dụng các chế độ thanh thải đối lưu có thể cho phép loại bỏ tốt hơn các chất trung gian phân tử gây viêm/gây HIRRT . Không đủ bằng chứng để hỗ trợ bất kỳ khuyến cáo nào trong vấn đề này. Bằng chứng tồn tại được cung cấp chi tiết hơn trong Bảng 1.
Thanh thải thuốc vận mạch
Một nguyên nhân hiếm gặp của HIRRT liên quan đến thay đổi trương lực mạch máu đã được báo cáo xảy ra khi cổng tĩnh mạch của ống thông thẩm tách nằm trong cùng một tĩnh mạch và gần cổng của một ống thông tĩnh mạch trung tâm riêng biệt đang được sử dụng để điều trị thuốc vận mạch [80,81]. HIRRT được cho là xảy ra do thuốc vận mạch bị loại bỏ gần như ngay lập tức khỏi sự lưu thông của RRT, trước khi phát huy tác dụng toàn thân của chúng.
Tiếp cận đa phương thức để ngăn chặn HIRRT
Nghiên cứu hạn chế đã được thực hiện về việc ngăn ngừa HIRRT ở những bệnh nhân nguy kịch [9]. Các nghiên cứu hiện có được tóm tắt trong Bảng 2. Các hướng dẫn gần đây nhất trong lĩnh vực này, được công bố vào năm 2015, bởi các chuyên gia Pháp trong chăm sóc đặc biệt cho người lớn và trẻ em, gây mê và lọc máu cung cấp các khuyến cáo dựa trên ý kiến chuyên gia và các mức độ bằng chứng khác nhau để thực hiện RRT ở bệnh nhân bệnh nặng [66].
Những khuyến cáo này được hỗ trợ bởi một nghiên cứu đoàn hệ hồi cứu cũ hơn của Schortgen et al. so sánh dung nạp huyết động của HD ở bệnh nhân ICU với AKI trước và sau khi thực hiện các hướng dẫn thực hành HD dành riêng cho trung tâm, trong đó bao gồm các khuyến cáo về sử dụng có hệ thống và các khuyến cáo cho bệnh nhân không ổn định huyết động nhất của họ [5]. Các khuyến cáo có hệ thống bao gồm màng xenlulo biến đổi thay vì xenlulo không biến đổi (cuprophane), nồng độ natri dịch thẩm tách được đặt ở mức 145 mmol/L hoặc cao hơn, QB tối đa 150 ml/phút với thời gian phiên tối thiểu 4 giờ và nhiệt độ thẩm tách là 37°C hoặc thấp hơn . Đối với các bệnh nhân không ổn định hơn, họ khuyên nên bắt đầu phiên HD bằng thẩm tách và tiếp tục với UF một mình, hoặc bắt đầu phiên không có UF, sau đó điều chỉnh tỷ lệ UF theo đáp ứng huyết động. Họ cũng đề nghị tiếp tục hạ nhiệt độ xuống 35 ° C và ngừng sử dụng bất kỳ liệu pháp giãn mạch nào [5]. Dân số được điều trị theo hướng dẫn thực hành của họ đã cải thiện khả năng chịu đựng huyết động so với các biện pháp kiểm soát lịch sử, được xác định bằng cách hạ huyết áp ít hơn khi bắt đầu phiên và trong phần còn lại của phiên. Hơn nữa, giảm 10% HIRRT (được xác định là giảm SBP trên 10% so với ban đầu hoặc cần can thiệp điều trị) giữa hai nhóm (71% so với 61%) [5].
Xem xét nghiên cứu của Schortgen và cộng sự [5] ngoài các bằng chứng gần đây hơn [9], các đề xuất giới hạn và quản lý HIRRT ở bệnh nhân bị bệnh nặng được tóm tắt trong Bảng 3.
Kết luận
HIRRT là phổ biến ở những bệnh nhân bị bệnh nặng được điều trị bằng RRT. Nó có liên quan đến tăng tỷ lệ tử vong và có thể làm giảm sự phục hồi thận. UF quá mức là một nguyên nhân quan trọng của HIRRT nhưng nó có thể không phải là cơ chế chiếm ưu thế trong nhiều trường hợp. Nhiều cơ chế liên quan đến RRT khác có thể dẫn đến giảm cung lượng tim, giảm sức cản ngoại biên hoặc cả hai. Điều này cho thấy rằng phản ứng thích hợp đối với HIRRT có thể không phải lúc nào cũng là chấm dứt UF, đặc biệt là trong bối cảnh quá tải dịch đáng kể. Tuy nhiên, theo hiểu biết của chúng tôi, không có nghiên cứu nào trực tiếp tìm cách xác định phản ứng tối ưu cho HIRRT đối với các mục tiêu của UF.
Ngoài việc xem xét các cơ chế liên quan đến RRT đối với HIRRT, chúng tôi đã xem xét các can thiệp tiềm năng để giảm thiểu HIRRT và bằng chứng cho việc sử dụng chúng (phần nào bị hạn chế do xuất phát từ các nghiên cứu về bệnh nhân mắc ESKD trên HD ngắt quản). Nhìn chung, vẫn còn một lượng nhỏ bằng chứng trong nhóm bệnh nhân AKI bị bệnh nặng cho các can thiệp liên quan đến RRT để hạn chế sự xuất hiện của HIRRT. Hiểu rõ hơn và đánh giá cao cả các yếu tố liên quan đến bệnh nhân và RRT đóng góp vào HIRRT ở bệnh nhân bị bệnh nghiêm trọng với AKI là điều cần thiết để phát triển các nghiên cứu lâm sàng và thực hiện các chiến lược mới để phòng ngừa và điều trị.
Bài viết được tác giả dịch tại Springer link nguồn ở đây.
Đăng tải bởi: Heal Central (Health Education Assets Library)

![[ VẠCH TRẦN ] Cao Dây thìa canh chuẩn hóa Mamigo có tốt không? Sự thật ít ai chia sẻ. Cao Dây thìa canh chuẩn hóa Mamigo](https://www.healcentral.org/wp-content/uploads/2022/03/anh-ava-di-bao-2-218x150.jpg)
![[CHIA SẺ] Cách bấm huyệt chữa trĩ tại nhà an toàn – đơn giản – hiệu quả Bấm huyệt chữa trĩ](https://www.healcentral.org/wp-content/uploads/2020/10/bam_huyet_chua_tri-218x150.jpg)