Bài viết Quản lý tối ưu khoảng chết của thiết bị ở trẻ em gây mê được BS. Đặng Thanh Tuấn dịch từ bài viết gốc: Optimal management of apparatus dead space in the anesthetized infant
1. Tóm lược
Thông khí cơ học của trẻ em gây mê cần chú ý cẩn thận đến thiết bị và cài đặt thông khí để đảm bảo trao đổi khí tối ưu và giảm thiểu nguy cơ chấn thương phổi. Khoảng chết của thiết bị,được xácđịnh là khoảng chết do các thiết bị đặt giữa ống nội khí quản và đoạn nối Y (Y-piece) của bộ dây máy thở (breathing circuit), là nguồn khoảng chết chính do bác sĩ kiểm soát.
Do thể tích khí lưu thông nhỏ mà trẻ nhũ nhi và trẻ sơ sinh yêu cầu, nên dễ dàng tạo ra khoảng chết của thiết bị tăng quá mức, dẫn đến tăng CO2 không chủ ý, hoặc tăng thông khí phút trong nỗ lực đạt được PCO 2 mong muốn.
Mục tiêu của tổng quan này là đánh giá các thiết bị thường được bổ sung vào bộ dây máy thở trong khi gây mê và phát triển các khuyến nghị để hướng dẫn bác sĩ lựa chọn thiết bị phù hợp nhất với mục tiêu lâm sàng và kích thước của bệnh nhân.
Chúng tôi bao gồm các khuyến nghị cụ thể cho máy thở/máy gây mê phù hợp nhất với các bệnh nhân nhi khoa có kích thước khác nhau, tập trung đặc biệt vào bệnh nhân < 5 kg.
2. Mở đầu
Giống như tất cả các khía cạnh của chăm sóc trẻ em, thông khí cơ học của trẻ em gây mê cần chú ý cẩn thận đến các chi tiết. Những thay đổi nhỏ trong thể tích khí lưu thông đã cung cấp có thể là một tỷ lệ phần trăm đáng kể của thể tích khí lưu thông mục tiêu và dẫn đến hậu quả không mong muốn của suy giảm oxy hóa, tăng hoặc giảm CO2 máu, giảm cung lượng tim và/hoặc tổn thương phổi.
Đối với trẻ nhỏ có chức năng phổi bình thường, các biến thiên nhỏ của thể tích khí lưu thông có thể dung nạp tốt nhưng có thể dễ dàng xảy ra giảm thông khí hoặc tăng thông khí không mong muốn.
Đối với những trẻ sơ sinh mắc bệnh phổi non tháng, hội chứng suy hô hấp (RDS), hoặc các tình trạng khác như tăng áp động mạch phổi, thông khí chính xác là quan trọng để đảm bảo kết quả tốt nhất. Để đảm
bảo thông khí tối ưu, bác sĩ gây mê cho trẻ em phải chọn thiết bị của họ một cách cẩn thận, điều chỉnh cài đặt máy thở theo nhu cầu của từng bệnh nhân và theo dõi sự tương tác giữa máy thở và bệnh nhân. [1]
Bác sĩ gây mê nhi được dạy ngay từ đầu đào tạo của họ để chọn kích thước và loại ống nội khí quản thích hợp và cách quản lý các cài đặt máy thở. Khoảng chết, đặc biệt là áp đặt bằng cách thêm thiết bị vào bộ dây máy thở, có thể có tác động tiêu cực đến hiệu quả của thông khí cơ học, nhưng có thể không được đánh giá cao.
Trong tổng quan này, các tùy chọn cho khoảng chết của thiết bị được thảo luận với mục tiêu cung cấp hướng dẫn lựa chọn hợp lý các thành phần bộ dây máy thở sẽ giảm thiểu tác động của khoảng chết trên bệnh nhi.
3. Sinh lý về khoảng chết
Sách giáo khoa sinh lý học đường thở xác định khoảng chết sinh lý tổng là sự kết hợp của khoảng chết đường thở (Vdaw) và khoảng chết phế nang (Vdalv):
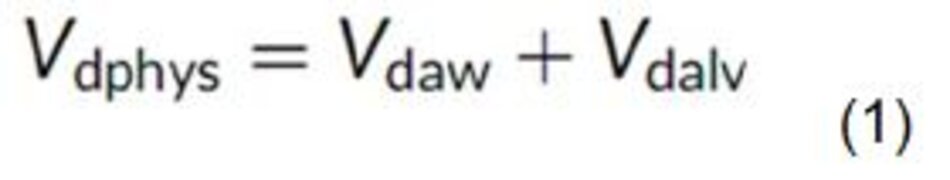
Khoảng chết đường thở là thể tích của các đường dẫn khí, là nơi không xảy ra trao đổi khí. Khoảng chết của phế nang là thể tích trong phế nang, nơi sự trao đổi khí không xảy ra vì có rất ít hoặc không có lưu lượng máu, được định nghĩa theo West là Zone 1. [2]
Đối với bệnh nhân không đặt nội khí quản, định nghĩa về khoảng chết này là đủ. Đối với bệnh nhân có đặt nội khí quản, định nghĩa này không bao gồm khoảng chết do thiết bị cần thiết để hỗ trợ thông khí cơ học, cụ thể là bộ dây máy thở và ống nối với bệnh nhân. Một định nghĩa hoàn chỉnh hơn về khoảng chết cho những bệnh nhân này sẽ là:
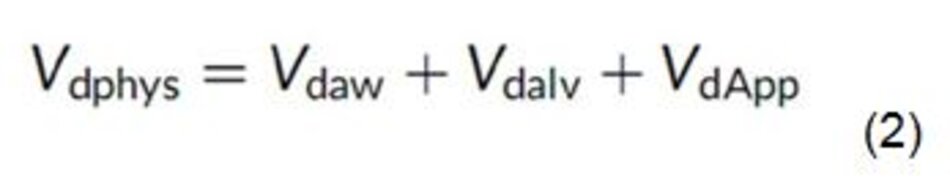
khi VdApp đại diện cho thể tích của thiết bị được thêm vào bộ dây máy thở góp phần vào khoảng chết.
Một định nghĩa thuận tiện của khoảng chết khi sử dụng một chu trình gây mê vòng tròn (circle anesthesia circuit) để cung cấp thông khí thông thường là bất kỳ phần nào của bộ dây máy thở hoặc phổi nơi có dòng khí hai chiều mà không có trao đổi khí.
Như vậy, khí di chuyển vào và ra khỏi khoảng chết là thông khí lãng phí, nghĩa là, công việc đang được thực hiện bởi máy thở mà không ảnh hưởng đến trao đổi khí. [3]
Ở trẻ sơ sinh khỏe mạnh, có đặt nội khí quản sử dụng hệ thống gây mê vòng tròn, tổng khoảng chết bao gồm thể tích trong phần xa bộ dây máy thở cho đến đoạn Y, phần xa của cây khí phế quản đến ống nội khí quản và bất kỳ phế nang nào trong Zone 1.
Một thể tích khoảng chết nhất định là bắt buộc, tức là, bệnh nhân cần có đường thở (ống nội khí quản hoặc đường thở trên thanh môn – supraglottic airway) và kết nối giữa bộ dây máy thở và đường thở. Các lựa chọn được thực hiện cho khoảng chết của thiết bị sẽ có tác động đến trao đổi khí và cần được xem xét cẩn thận.
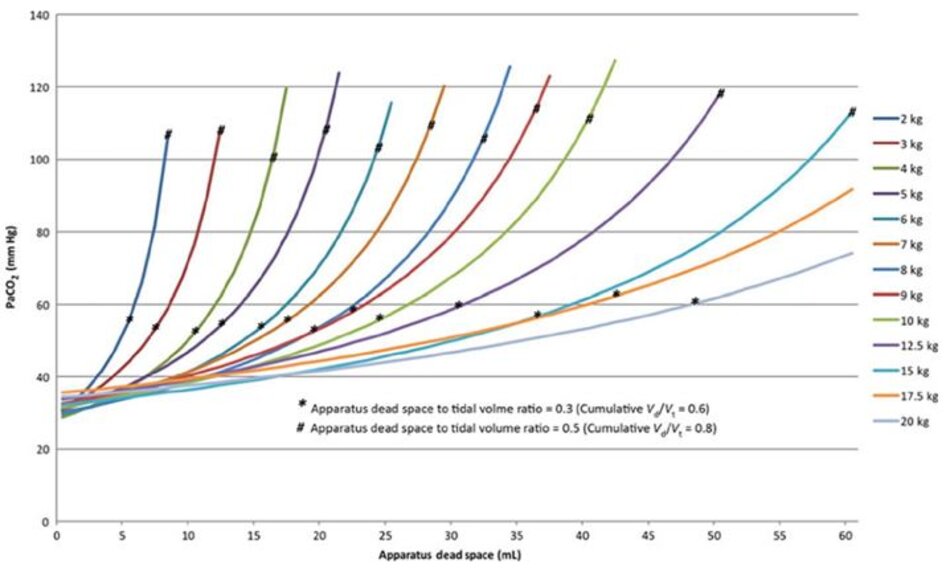
Bất kỳ sự gia tăng trong khoảng chết khi thể tích khí lưu thông và tần số hô hấp được giữ hằng định sẽ gây ra giảm thông khí hiệu quả và, do đó, tăng PaCO2. Mặc dù khoảng chết (Vd) quá mức làm giảm hiệu quả của thông khí cơ học ở tất cả các bệnh nhân, nhưng nó có ý nghĩa quan trọng ở trẻ sơ sinh vì thể tích khí lưu thông (Vt) nhỏ của chúng.
Bất kỳ sự gia tăng nào trong Vd cũng gây ra sự thay đổi đáng kể hơn trong phần thể tích khí lưu thông không tham gia trao đổi khí so với một bệnh nhân lớn hơn có thể tích khí lưu thông cao hơn.
Ý nghĩa lâm sàng của việc tăng tỷ lệ khoảng chết trên thể tích khí lưu thông (Vd/Vt) là sự gia tăng theo hàm mũ trong PaCO2 khi Vd/Vt tăng lên, hoặc sự gia tăng theo cấp số nhân trong thông khí phút cần thiết để duy trì một PaCO2 bình thường. Bệnh nhân càng nhỏ, tác động càng lớn thậm chí là sự gia tăng nhỏ trong khoảng chết của thiết bị [4,5] (Hình 1).
Tăng khoảng chết cũng làm tăng độ chênh lệch giữa các phép đo carbon dioxide end-tidal và PCO2 động mạch, như vậy việc giám sát end-tidal CO2 là một yếu tố dự báo ít chính xác của PaCO2 khi tăng khoảng chết. [6] Do đó, tăng CO2 máu có thể không được đánh giá đầy đủ khi sử dụng capnography để đánh giá tính hiệu quả của thông khí.
Trong khi thông khí không hiệu quả do sự gia tăng nhỏ trong khoảng chết có thể được khắc phục bằng cách tăng thông khí phút, sự can thiệp này có thể không mong muốn. Trẻ sinh non và trẻ sơ sinh có nguy cơ bị tổn thương phổi do máy thở (VILI) và chiến lược giảm nguy cơ đó tập trung vào việc giảm thiểu sự tiếp xúc của phổi với thông khí áp lực dương.
Nguy cơ VILI thậm chí còn lớn hơn đối với những trẻ bị các chứng bệnh như thoát vị cơ hoành bẩm sinh hoặc loạn sản phế quản phổi, khi sự trao đổi khí bị suy yếu ngay từ đầu và phổi thậm chí còn dễ bị tổn thương hơn.
Cuối cùng, trẻ sơ sinh bị bệnh tim bẩm sinh, khi kiểm soát lưu lượng máu phổi là điều quan trọng đòi hỏi sự kiểm soát đáng tin cậy của PaCO 2 và tăng thông khí áp lực dương có thể có tác dụng huyết động bất lợi.
Tần số hô hấp có thể được tăng lên để tránh tăng thể tích và áp lực nhưng với sự gia tăng theo cấp số nhân trong PaCO 2 có thể xảy ra do mức độ khoảng chết tăng bổ sung, nó có thể không thể đạt được trao đổi khí bình thường.
Vì phần lớn khoảng chết trong phổi là một thể tích cố định, cách thiết thực nhất để giảm thiểu tác động của khoảng chết trên bệnh nhân nhỏ là quản lý cẩn thận thể tích khoảng chết của thiết bị trong bộ dây máy thở. Vì vậy, mỗi thành phần được thêm vào một bộ dây máy thở trẻ sơ sinh phải được biện minh cho việc có thể gây tăng khoảng chết hay không.
4. Khoảng chết thiết bị
Khi sử dụng hệ thống thở vòng tròn, khoảng chết thiết bị bao gồm tất cả các thành phần được thêm vào mạch ở phía bệnh nhân của đoạn nối Y (Y-piece). Cần có đường thở – hoặc là ống nội khí quản hoặc đường thở trên thanh môn.
Tác động của đường thở nhân tạo trên khoảng chết không hoàn toàn bất lợi vì nó có thể nhỏ hơn khoảng chết do đường thở tự nhiên gây ra. Các đầu nối (connectors) giữa đường thở và đoạn nối Y cần chú ý cẩn thận. Các đầu nối này được sử dụng để thuận tiện cũng như tạo điều kiện giám sát nồng độ khí, đo áp suất và lưu lượng, lọc vi khuẩn và làm ẩm.
Các vật dụng phổ biến xen kẽ bao gồm khuỷu tay (elbows), bộ nối kết co giãn (flexible adapters), bộ trao đổi nhiệt và độ ẩm (heat and moisture exchangers), bộ lọc vi khuẩn (bacterial filters), lưu lượng kế (flowmeters), và các thiết bị lấy mẫu khí mạch chính (mainstream) hoặc mạch ngang (sidestream) (Hình 2).
Trong nhiều trường hợp, các thiết bị được thiết kế để hỗ trợ nhiều chức năng. Sau đây sẽ xem xét tác động đến khoảng chết của các đầu nối khác nhau với mục tiêu lựa chọn tối ưu các thành phần cho từng bệnh nhân.
4.1 Độ ẩm
Độ ẩm của khí hít vào là mong muốn trong việc chăm sóc trẻ em gây mê được đặt nội khí quản. Sự làm ẩm giúp duy trì chức năng tế bào trụ có lông chuyển bình thường, thanh thải chất tiết và giữ nhiệt độ bình thường.
[7-11] Làm ẩm khí hít vào trong khi gây mê bằng cách sử dụng thụ động, trao đổi nhiệt và độ ẩm (HME) hoặc các máy làm ẩm thụ động. Vì hiệu quả, chi phí thấp, dễ sử dụng, tính di động và khả năng lọc vi khuẩn của chúng, HME là các giải pháp tiện lợi hơn cho việc làm ẩm hơn so với các máy làm ẩm chủ động. [12]
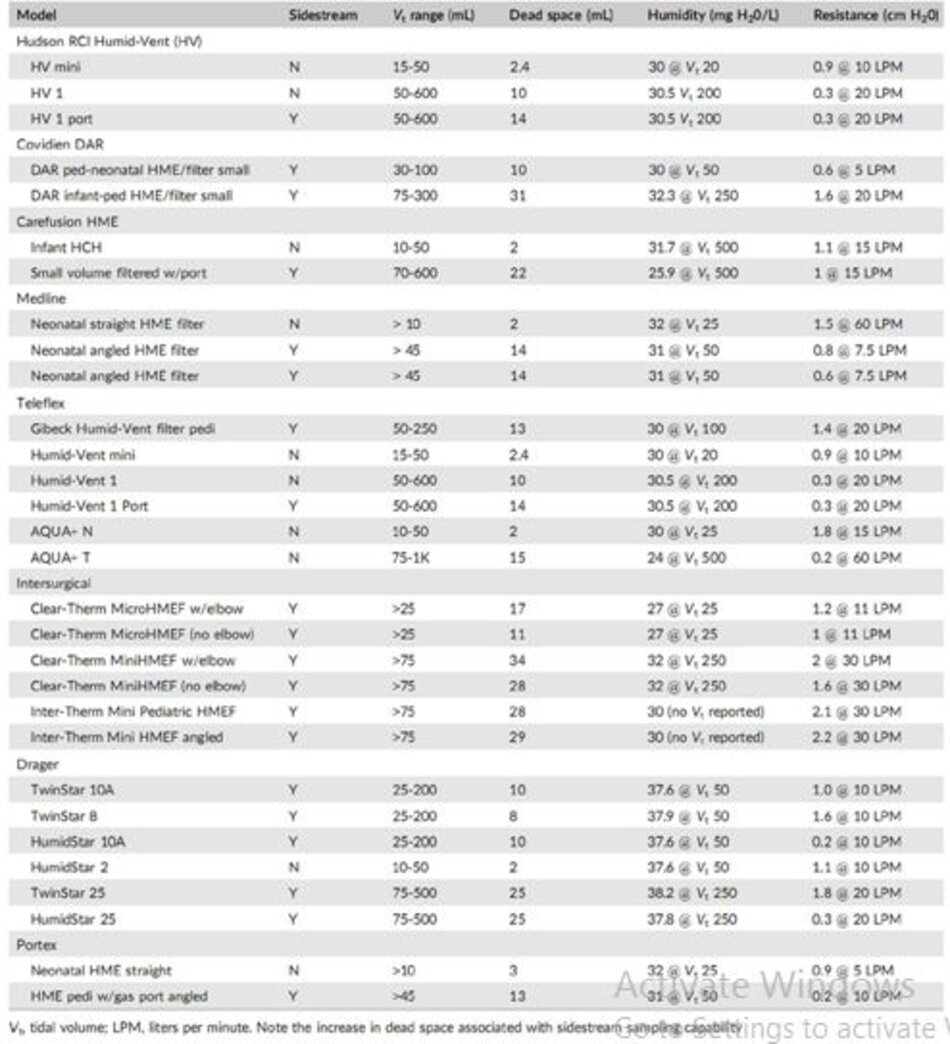
Trong khi hữu ích cho việc làm ẩm, việc bổ sung một HME vào đầu xa bộ dây máy thở làm tăng khoảng chết của thiết bị và tăng kháng lực đối với dòng khí. Theo nguyên tắc chung, các HME lớn hơn tăng thêm khoảng chết nhưng có ít kháng lực hơn so với các HME nhỏ hơn. HME có bán trên thị trường có phạm vi khí lưu thông (Vt) được đề nghị.
Sử dụng một HME trong phạm vi Vt khuyến cáo nên cung cấp thông khí đầy đủ và độ ẩm mà không có sự gia tăng bất lợi đối với bệnh nhân được thông khí cơ học. Khoảng chết có thể thấp tới 2 mL nếu HME không có khả năng lấy mẫu dòng bên cho capnography, hoặc thấp tới 8 mL nếu HME có cổng lấy mẫu khí tích hợp.
Việc xem xét các HME có sẵn cho thấy rằng việc bổ sung khả năng lấy mẫu khí vào một HME làm tăng đáng kể khoảng chết (Bảng 1).
Một giải pháp thay thế cho HME là các máy làm ẩm chủ động rất hiệu quả trong việc cung cấp nhiệt và độ ẩm cho đường thở. Các thiết bị này thường được đặt vào trong bộ dây máy thở ở nhánh hít vào và do đó không có bất kỳ gánh nặng của khoảng chết nào, cũng như chúng không ảnh hưởng đến sức cản của đường thở.
Tuy nhiên, các máy tạo độ ẩm chủ động không hỗ trợ lấy mẫu khí và một thiết bị bổ sung là cần thiết để hỗ trợ lấy mẫu khí sẽ làm tăng thêm khoảng chết. Máy tạo độ ẩm chủ động cũng sẽ làm tăng độ giãn nở tổng thể của bộ dây máy thở
Để đảm bảo việc phân phối và đo lưu lượng khí lưu thông chính xác, kiểm tra thất thoát và độ giãn nở phải được thực hiện sau khi máy tạo độ ẩm chủ động được thêm vào bộ dây. [13]
Máy thở gây mê không hỗ trợ bù trừ độ giãn nở, không được khuyến cáo cho trẻ sơ sinh và bệnh nhân nhỏ. Các nhược điểm khác của máy tạo độ ẩm chủ động bao gồm giảm tính di động, khả năng làm quá nóng đường thở, quá tải thể tích dịch do quá nhiều độ ẩm, nguy cơ hỏa hoạn hoặc điện giật, và tăng nguy cơ thất thoát qua bộ dây thở và báo động giả.
Schiffman đã nghiên cứu 40 trẻ sơ sinh và trẻ em trong ICU nhận độ ẩm xen kẽ bởi HME và máy tạo độ ẩm chủ động trong ba chu kỳ 6 giờ sử dụng cảm biến độ ẩm nhanh.
[14] Các dữ liệu về độ ẩm cho thấy sự khác biệt nhỏ về hiệu quả giữa hai phương thức. Các tác giả đã không cung cấp dữ liệu về tác động của khoảng chết.
4.2 Lấy mẫu khí
Lấy mẫu khí trong khi gây mê cung cấp thông tin giám sát cần thiết, cụ thể, lấy thì hít vào và thở ra về nồng độ oxy, carbon dioxide và thuốc gây mê hít. Các phương pháp cơ bản để lấy mẫu khí là máy phân tích dòng chính (mainstream) và phân tích dòng bên (sidestream).
Máy phân tích dòng chính đặt máy phân tích đo lường vào chính bộ dây máy thở. Máy phân tích dòng bên hút khí qua đường lấy mẫu tới máy phân tích nằm bên ngoài bộ dây máy thở. Việc lấy mẫu qua dòng bên là bắt buộc nếu cả tác nhân gây mê và giám sát CO2 đều được mong muốn và là phương pháp được sử dụng phổ biến nhất trong gây mê.
Như đã thảo luận ở trên, việc lấy mẫu bên ngoài có thể được kết hợp với HME vào một đơn vị duy nhất, mặc dù có tăng thêm khoảng chết. Nếu lấy mẫu khí không được kết hợp với một HME, cổng lấy mẫu khí phải được đặt xa để đơn vị HME cải thiện trị số đo đạc thống nhất hơn giữa các phép đo end-tidal và nồng độ khí qua máu động mạch.
Khi nghiên cứu độ chính xác của từng phương thức được so sánh với phép đo CO2 máu động mạch, một nghiên cứu đã chứng minh rằng ở tần số thở cao, ETCO 2 dòng chính tương quan với các phép đo CO 2 động mạch tốt hơn một chút so với ETCO2 dòng bên ở trẻ em, [15] mặc dù một nghiên cứu sau đó cho thấy rằng độ chính xác của các phép đo dòng bên cũng ngang bằng với số đo của dòng chính khi mẫu được đặt ở khoảng cách gần nhất trong mạch.
[16] Các máy phân tích dòng chính cần được kết nối trực tiếp với ống nội khí quản để có độ chính xác cao nhất, nhưng thêm trọng lượng và khả năng làm tuột ống nội khí quản nếu không được hỗ trợ cẩn thận.
Cả hai phương thức dòng chính và dòng bên đều làm tăng khoảng chết nhưng có thể được sử dụng kết hợp với các thành phần khác của bộ dây thở để làm tăng tối thiểu khoảng chết. Một đầu nối khuỷu tay (elbow connector) để phân tích dòng bên sẽ thêm 8 mL khoảng chết, trong khi các đầu nối thẳng có thể thêm tối đa 5 mL khoảng chết.
Đầu nối lấy mẫu dòng bên nhỏ nhất mà chúng tôi có thể tìm thấy thêm < 2 mL khoảng chết và có thể là kết nối duy nhất giữa ống nội khí quản và bộ dây máy thở (Mục # 1152, Y khoa Smith, Dublin, Ohio; Hình 3 phần D) khi kết hợp với máy tạo độ ẩm chủ động. Các bộ điều hợp (adapters) lấy mẫu dòng chính thường được kết hợp với máy thở chăm sóc tích cực sơ sinh (NICU) khá nhỏ gọn với khoảng chết trong phạm vi 0,5-1 mL.
Đo lường qua da là một lựa chọn để theo dõi CO2 liên tục (TCCO2) không ảnh hưởng đến khoảng chết. [17,18] Đo CO2 qua da không hỗ trợ từng nhịp thở để đo CO2 và do đó không thay thế cho capnography để có thể giúp nhanh chóng chẩn đoán tuột ống nội khí quản ngoài ý muốn, sút dây máy thở (circuit disconnection), gập ống hoặc nút nhầy gây tắc ống nội khí quản và các biến cố cấp tính khác.
4.3 Đo áp lực và lưu lượng
Máy thở gây mê mới hơn có bù trừ độ giãn nở có thể cung cấp chính xác thể tích khí lưu thông nhỏ cho trẻ sơ sinh. [13] Tuy nhiên, có một số tình huống mà máy thở NICU có thể được sử dụng trong phòng mổ. Ảnh hưởng của thiết bị bộ dây máy thở bổ sung lên khoảng chết là giống nhau khi sử dụng máy thở NICU làm máy gây mê. Thiết bị tạo độ ẩm và thiết bị lấy mẫu khí đều có khả năng tăng khoảng chết. Một đóng góp chung nữa cho khoảng chết khi sử dụng máy thở NICU là cảm biến lưu lượng đầu xa (distal flow sensor).
Máy thở NICU hiện đại được trang bị cảm biến lưu lượng đặt giữa bộ dây máy thở và ống nội khí quản. Cảm biến được sử dụng như là kích hoạt dòng chảy cho các chế độ thông khí hỗ trợ áp lực và là một thước đo chính xác về thể tích khí lưu thông thực được phân phối cho bệnh nhân ở cả hai chế độ được kiểm soát và hỗ trợ. [19]
Máy thở của NICU có thể cung cấp ít nhất 2 mL mỗi hơi thở, nhưng cảm biến lưu lượng xa phải được đặt để đạt được mức độ chính xác này. Cảm biến lưu lượng cho máy thở NICU có sẵn với một khoảng chết 0,9 mL và cung cấp các phép đo thể tích khí lưu thông chính xác là 0,5 mL cho thể tích khí lưu thông dưới 5 ml và 10% cho thể tích khí lưu thông trên 5 mL. [20] Ngay cả với thể tích khoảng chết nhỏ này, thể tích khí lưu thông cho mỗi kg yêu cầu để đạt được normocapnea ở trẻ rất nhẹ cân được tăng lên. [21]
4.4 Các kết nối (Connectors)
Do kích thước nhỏ của chúng, việc định vị trẻ sơ sinh để phẫu thuật thường rất khó khăn. Vùng mổ, các thiết bị, đường truyền tĩnh mạch, và ống dẫn khí đều cạnh tranh cho khu vực nhỏ xung quanh bệnh nhân.
Nếu không có kỹ thuật và cảnh giác cẩn thận, việc tuột ống nội khí quản tai biến, gập ống nội khí quản hoặc tổn thương áp lực lên da của trẻ sơ sinh đều trở nên có thể. Để tránh những biến chứng này, các đầu nối đường thở (airway connectors) như ống nối khuỷu tay (elbows) và bộ điều hợp co giãn (flexible adaptors) được sử dụng để cải thiện vị trí của thiết bị đường thở.
Các đầu nối thường được đặt giữa đầu nối Y (Y-piece) của bộ dây gây mê và ống nội khí quản để kéo dài khoảng cách giữa trường mổ và ống dây thở cồng kềnh.
Mặc dù hữu ích cho việc định vị, các đầu nối này có thể thêm khoảng chết đáng kể – 8 mL cho đầu nối góc (right angle connector) và 25 mL cho đầu nối co giãn mở rộng (extended flexible connector) trong một khảo sát [4] – với lợi thế chức năng tối thiểu.
Như vậy, các ống nối này nên tránh cho bệnh nhân nhỏ trừ khi hoàn toàn cần thiết để đảm bảo kết nối giữa bộ dây máy thở và ống nội khí quản.
4.5 Cân nhắc đường thở
Định nghĩa về khoảng chết được mô tả bởi phương trình 2 không hoàn toàn mô tả. Khoảng chết giải phẫu bao gồm hai thành phần – khoảng chết ngoài lồng ngực và trong lồng ngực. Khoảng chết trong lồng ngực là thể tích của đường dẫn khí từ thanh môn đến mức phế nang. Khoảng chết ngoài lồng ngực là thể tích của họng, mũi và khoang miệng. Trong giai đoạn trẻ nhỏ, tổng khoảng chết giải phẫu là khoảng 3,3 mL/kg, với thành phần tương đối cố định là 1 mL/kg đối với khoảng chết trong lồng ngực và một thành phần giảm dần theo tuổi là khoảng chết ngoài lồng ngực. [22]
Đặt một đường thở nhân tạo sẽ làm giảm khoảng chết ngoài lồng ngực đến mức mà một đường thở nhân tạo với một thể tích nhỏ hơn thay thế thể tích khoảng chết ngoài lồng ngực. Ở người lớn, người ta ước tính rằng đặt một đường thở nhân tạo làm giảm khoảng khoảng chết ngoài lồng ngực khoảng 50%. Việc giảm khoảng chết liên quan đến đường thở có thể dễ dàng bù đắp bằng việc bổ sung thiết bị vào bộ dây máy thở. Tổng thể tích của tất cả các thiết bị bao gồm đường thở nhân tạo và bất kỳ thiết bị và đầu nối nào khác giữa bệnh nhân và đầu nối Y đóng góp vào tổng khoảng chết của thiết bị. Việc giảm khoảng chết của bất kỳ thiết bị nào trong số này là một phần của chiến lược giảm thiểu tác động khoảng chết của thiết bị.
Một cách tiếp cận phổ biến để giảm thành phần của bộ phận khoảng chết do ống nội khí quản góp phần là giảm chiều dài bằng cách cắt một phần đầu nối của ống. Tác động của động tác này bị hạn chế bởi độ sâu yêu cầu của ống và cần phải để khoảng 3-4 cm dài hơn độ sâu mà ống được đặt vào để dán cố định ống. Tác động giảm khoảng chết của việc giảm chiều dài của ống nội khí quản có thể được tính toán dựa trên diện tích mặt cắt ngang của ống.
Thể tích này rất nhỏ đối với các ống được thiết kế cho trẻ sơ sinh — ví dụ, đối với ống đường kính trong 3,5 mm, mỗi centimet chiều dài được lấy ra khỏi ống dẫn đến giảm khoảng cách chỉ 0,1 mL. Một số ống nội khí quản được thiết kế với đầu nối đặc biệt để giảm khoảng chết hơn nữa.
Dữ liệu cho thấy rằng các đầu nối khoảng chết thấp này có thể làm tăng hiệu quả của thông khí cơ học. [23] Đối với những bệnh nhân sẽ được hưởng lợi từ việc giảm khoảng chết thiết bị chung, ống nội khí quản với các đầu nối khoảng chết thấp có thể mang lại lợi thế.
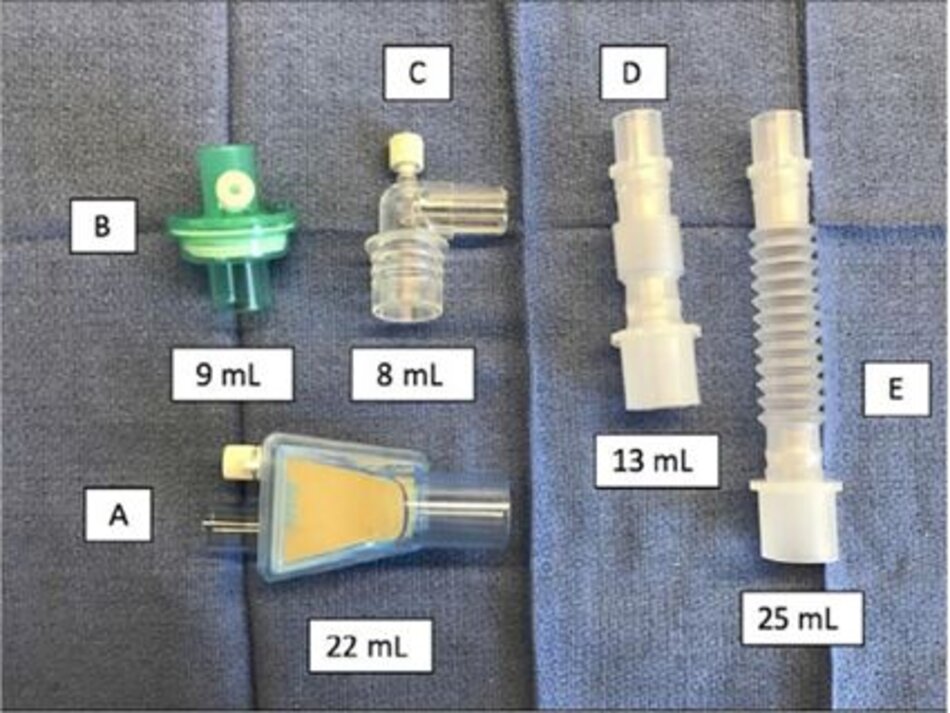
Một thiết kế ống nội khí quản thuận lợi khác kết hợp một lumen lấy mẫu ở đầu xa của ống để lấy mẫu khí để phân tích (Hình 3 phần A). Thiết kế này giúp loại bỏ khoảng chết được kết hợp với bộ điều hợp lấy mẫu dòng bên hoặc dòng chính. Những ống này đã được chứng minh là cung cấp một ước tính chính xác hơn so sánh với CO 2 động mạch so với các bộ điều hợp dòng bên được gắn riêng ở vị trí gần hơn. [24,25]

Tuy nhiên, tiện ích này bị giới hạn vì các cổng lấy mẫu xa có thể dễ dàng bị bịt kín do các chất tiết và ống Mallinckrodt không cung cấp tùy chọn có bóng chèn. Một tùy chọn khác là đầu nối Portex ISO 15 mm với sideport có thể được đặt vào đầu gần của ống nội khí quản để thay thế cho bộ đổi nguồn 15 mm được cung cấp.
Được thiết kế ban đầu cho quản lý thuốc dùng qua nội khí quản, nó cũng có thể hỗ trợ lấy mẫu khí bên trong (Hình 3 phần B). Mặc dù hiệu quả cao, nhược điểm của thiết bị này bao gồm sự cần thiết phải duy trì một hàng tồn kho cho mỗi kích thước của ống nội khí quản và tiềm năng cho một kết nối không an toàn với ống nội khí quản khi đầu nối được thay đổi.
4.6 Cách tiếp cận khác để quản lý khoảng chết
Do nhu cầu kết nối giữa bệnh nhân và máy thở trong khi thông khí cơ học, không thể tránh được một thể tích khoảng chết cụ thể. Những nỗ lực để giảm thiểu khoảng chết của thiết bị chắc chắn ảnh hưởng đến việc sử dụng thiết bị liên quan đến khí ẩm, theo dõi lưu lượng và/hoặc phân tích nồng độ khí. Bơm phụt khí quản liên tục (CGGI, Continuous tracheal gas insufflation) là một kỹ thuật đã được chứng minh là có hiệu quả trong việc loại bỏ tác động của khoảng chết mặc dù nó bị giới hạn bởi những thách thức kỹ thuật.
Kỹ thuật này liên quan đến việc thổi khí gas trực tiếp vào khí quản để rửa sạch CO2 trong các đường thở lớn trong khi thở ra. Kỹ thuật này ban đầu được sử dụng cho bệnh nhân người lớn bị COPD, những người bị ứ CO 2 mạn tính và được thực hiện thông qua một ống thông xuyên khí quản.
[26] Nó cũng đã được áp dụng với sự thành công ở trẻ sinh non, nơi khí tươi (fresh gas) được cung cấp thông qua một ống nội khí quản chuyên dụng với các kênh bên trong để cung cấp khí tươi. Một nghiên cứu ngẫu nhiên tiềm năng ở trẻ sinh non so sánh thông khí giới hạn áp lực không có và có CTGI cho thấy nhóm thứ hai có áp suất đỉnh và áp suất cao nguyên thấp hơn với cùng nồng độ CO2 và thời gian cần thở máy ít hơn. [27]
5. Khuyến cáo — Cách tiếp cận tối ưu cho khoảng chết của thiết bị là gì?
Tỷ lệ của khoảng chết chia cho tỷ lệ thể tích khí lưu thông Vd/Vt, là một hướng dẫn hữu ích cho việc lựa chọn thiết bị. Một mô hình đơn giản dự đoán rằng khi khoảng chết của thiết bị bằng 1/3 lượng khí lưu thông, CO2 động mạch sẽ bắt đầu tăng lên nhanh chóng với sự gia tăng thêm về khoảng chết máy thở. [4]
Giảm thiểu khoảng chết thiết bị sẽ giúp giảm thiểu sự thông khí tối thiểu cần thiết để đạt được trao đổi khí hiệu quả. Mục đích của tổng quan này là cung cấp thông tin cần thiết để đưa ra quyết định sáng suốt về phương pháp giảm thiểu khoảng chết của thiết bị trong quá trình gây mê. Tổng số khoảng chết có thể chấp nhận được không phải là một thể tích cố định nhưng sẽ tăng liên quan đến kích thước của bệnh nhân.
Vì sự tiện lợi của các tính năng kết hợp của thiết bị, giống như HME lấy mẫu khí, là điều mong muốn, các thiết bị này là một lựa chọn tốt cho những bệnh nhân có khả năng chịu đựng được khoảng chết liên quan.
Do đó chúng tôi đề nghị một phương pháp phân loại để bổ sung trong khoảng chết dựa trên kích thước bệnh nhân và hướng dẫn đã phân chia những bệnh nhân này thành các nhóm khoảng chết tối thiểu, thấp và bình thường (Bảng 2). Đối với tất cả các khuyến nghị, chúng tôi đã giả định rằng một chiến lược thông khí bảo vệ phổi giới hạn tổng thể tích khí lưu thông xuống 6 mL/kg là mục tiêu chính và đã đưa ra các khuyến nghị cho phù hợp (Bảng 2).
5.1 Khuyến cáo về khoảng chết tối thiểu (bệnh nhân < 5 kg, Vt 3-30 mL)
Phạm vi kích thước bệnh nhân này có những thách thức và rủi ro thông khí độc đáo. Các bệnh nhân dễ bị tổn thương nhất (ví dụ, trẻ sơ sinh cực kỳ nhẹ cân) đòi hỏi nỗ lực tối đa để giảm khoảng chết.
Một máy tạo độ ẩm chủ động rất hữu ích vì nó không thêm khoảng chết và loại bỏ sự cần thiết cho một HME. Phân tích khí bên trong vẫn có thể được thực hiện mà không tăng khoảng chết bằng cách sử dụng một ống nội khí quản với một cổng lấy mẫu xa hoặc một ống nội khí quản truyền thống được trang bị bộ điều hợp sidestream 15 mm (Hình 3 phần B).
Cách khác, bộ điều hợp lấy mẫu thẳng có khoảng chết thấp với bộ lọc chỉ thêm 2 mL khoảng chết nếu nó là kết nối duy nhất giữa ống nội khí quản và bộ dây máy thở.
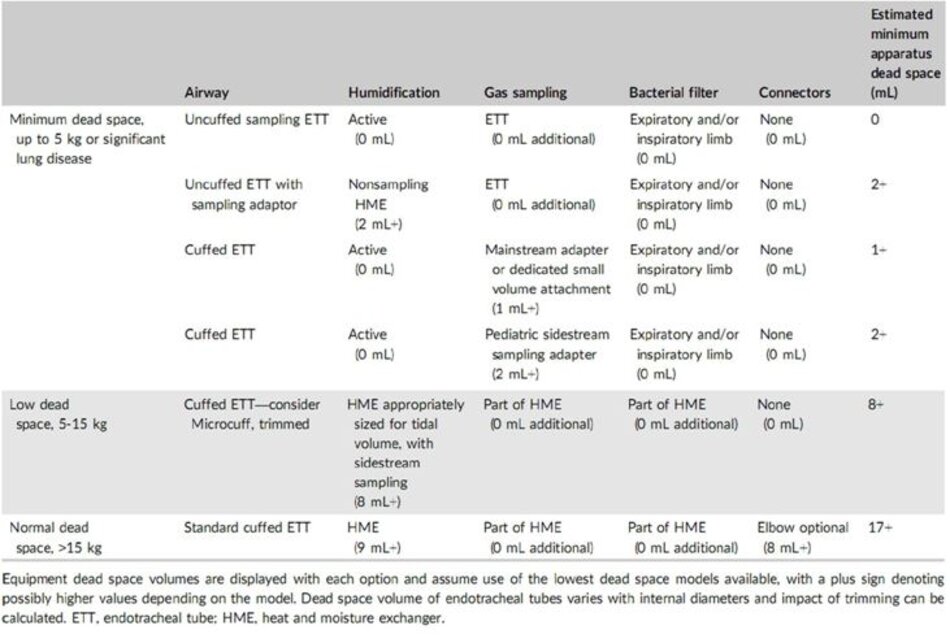
Capnography chính là một lựa chọn khác mặc dù nó thường sẽ yêu cầu một màn hình riêng biệt và giám sát tác nhân gây mê sẽ không có sẵn. Nếu sử dụng HME thay vì máy tạo độ ẩm hoạt động, chúng tôi khuyên bạn nên sử dụng HME mà không có khả năng lấy mẫu bên ngoài kết hợp với ống lấy mẫu đầu xa của nội khí quản hoặc ống được lắp với đầu nối 15 mm lấy mẫu. Với các biện pháp tối đa này, khoảng chết máy thở có thể nhỏ bằng chiều dài của ống nội khí quản và đầu nối Y trên bộ dây hoặc không quá 2 mL.
Đối với những bệnh nhân nhỏ nhất và dễ bị tổn thương nhất, máy thở NICU cũng có thể được xem xét để cung cấp lượng khí lưu thông đơn số chính xác trong phòng mổ. Nếu có máy thở gây mê hiện đại với bù trừ độ giãn nở, máy thở NICU không cần thiết trong hầu hết các trường hợp phải chú ý đến khoảng chết.
Nhược điểm của việc sử dụng máy thở NICU trong phòng mổ bao gồm việc cung cấp chất gây mê hít vào, sự lúng túng của vị trí thiết bị trong OR, không quen thuộc với các nhà cung cấp gây mê với chức năng của máy thở và sự bất tiện khi chuyển sang thông khí thủ công. Nếu một cảm biến lưu lượng xa được sử dụng, điều này sẽ giới thiệu một sự gia tăng nhỏ trong khoảng chết, khoảng 1 mL.
5.2 Các khuyến cáo về khoảng chết thấp (5-15 kg, Vt 30-90 mL)
Đối với những bệnh nhân không nhất thiết yêu cầu giảm khoảng chết tối đa nhưng yêu cầu về kích thước hoặc hô hấp của bạn sẽ được hưởng lợi từ các giới hạn khoảng chết, các biện pháp giảm khoảng chết không bị giới hạn.
Độ ẩm có thể đạt được với một HME được thiết kế cho các dải khí lưu thông thấp. Khoảng chết tối thiểu đối với loại HME này là 10 mL phù hợp với bệnh nhân 5 kg và kết hợp thể tích khí lưu thông 30 mL giả định không có các đầu nối khác được xen kẽ. Các thiết bị bổ sung như khuỷu tay hoặc ống mềm được thêm vào để thuận tiện nên tránh nếu có thể.
5.3 Các khuyến cáo về khoảng chết bình thường (> 15 kg, Vt > 90 mL)
Đối với những bệnh nhân lớn hơn, hoặc đối với những người mà thông khí bảo vệ phổi ít quan trọng hơn, điều đó không quan trọng để hạn chế khoảng chết của thiết bị. Chúng tôi vẫn khuyên bạn nên sử dụng một HME bao gồm lọc vi khuẩn và khả năng lấy mẫu bên ngoài là một đơn vị duy nhất sẽ cung cấp nhiều tính năng nhất với số lượng thiết bị ít khoảng chết nhất.
Nếu sử dụng khối khí lưu thông lớn hơn, HME nên được lựa chọn với thể tích khí lưu thông tối đa thích hợp. Các đầu nối có thể được sử dụng để cải thiện vị trí của dây máy thở hoặc để cung cấp một cổng lấy mẫu bên ngoài nếu không có trong HME.
Các tùy chọn thiết bị như vậy này sẽ dẫn đến ít nhất 10 mL khoảng chết, và tùy thuộc vào các đầu nối và HME được lựa chọn có thể dễ dàng tiếp cận 20 mL trở lên. Đối với trẻ nhỏ và trẻ em, yêu cầu thông khí có thể tăng nhẹ mà không có bất kỳ bất lợi lâm sàng nào.
6. Tóm tắt – kết luận
Ảnh hưởng của thiết bị bộ dây máy thở trên tổng thể tích khoảng chết được biết đến như là yêu cầu thông khí tăng lên. Các thiết bị làm tăng thêm khoảng chết nên được lựa chọn với việc xem xét thể tích khoảng chết được áp đặt và lợi ích lâm sàng được cung cấp bởi thiết bị. Đánh giá này nhằm làm nổi bật những cân nhắc liên quan đến việc lựa chọn thiết bị bộ dây máy thở và hướng dẫn lựa chọn tối ưu. Cuối cùng, rủi ro đối với từng bệnh nhân tăng khoảng chết và tác động liên quan đến các yêu cầu thông khí và CO2 động mạch cần phải được xem xét khi lựa chọn các thành phần bộ dây máy thở.
7. References
1. Feldman JM. Optimal ventilation of the anesthetized pediatric patient. Anesth Analg. 2015;120:165-175.
2. West JB, Dollery CT, Naimark A. Distribution of blood flow in isolated lung; relation to vascular and alveolar pressures. J Appl Physiol. 1964;19:713-724.
3. Sinha P, Flower O, Soni N. Deadspace ventilation: a waste of breath! Intensive Care Med. 2011;37:735-746.
BS. Đặng Thanh Tuấ 13
4. Pearsall MF, Feldman JM. When does apparatus dead space matter for the pediatric patient? Anesth Analg. 2014;118:776-780.
5. Chau A, Kobe J, Kalyanaraman R, Reichert C, Ansermino M. Beware the airway filter: deadspace effect in children under 2 years. Pediatric Anesthesia. 2006;16:932- 938.
6. McSwain SD, Hamel DS, Smith PB, et al. End-tidal and arterial carbon dioxide measurements correlate across all levels of physiologic dead space. Respir Care. 2010;55:288-293.
7. Williams R, Rankin N, Smith T, Galler D, Seakins P. Relationship between the humidity and temperature of inspired gas and the function of the airway mucosa. Crit Care Med. 1996;24:1920-1929.
8. Kilgour E, Rankin N, Ryan S, Pack R. Mucociliary function deteriorates in the clinical range of inspired air temperature and humidity. Intensive Care Med. 2004;30:1491- 1494.
9. Bissonnette B, Sessler DI. Passive or active inspired gas humidification increases thermal steady-state temperatures in anesthetized infants. Anesth Analg. 1989;69:783- 787.
10. Sottiaux TM. Consequences of under- and over-humidification. Respir Care Clin N Am. 2006;12:233-252.
11. Restrepo RD, Walsh BK. Humidification during invasive and noninvasive mechanical ventilation: 2012. Respir Care. 2012;57:782-788.
12. Kelly M, Gillies D, Todd DA, Lockwood C. Heated humidification versus heat and moisture exchangers for ventilated adults and children. Cochrane Database Syst Rev. 2010;4:CD004711.
13. Bachiller PR, McDonough JM, Feldman JM. Do new anesthesia ventilators deliver small tidal volumes accurately during volume-controlled ventilation? Anesth Analg. 2008;106:1392-1400.
14. Schiffmann H, Rethgeber J, Singer D, Harms K, Bolli A, Zuchner K. Airway humidification in mechanically ventilated neonates and infants: a comparative study of a heat and moisture exchanger vs. a heated humidifier using a new fast-response capacitive humidity sensor. Crit Care Med. 1997;25:1755-1760.
15. Pascucci RC, Schena JA, Thompson JE. Comparison of a sidestream and mainstream capnometer in infants. Crit Care Med. 1989;17:560-562.
16. McEvedy BA, McLeod ME, Kirpalani H, Volgyesi GA, Lerman J. End-tidal carbon dioxide measurements in critically ill neonates: a comparison of side-stream and mainstream capnometers. Can J Anaesth. 1990;37:322-326.
17. McEvedy BA, McLeod ME, Mulera M, Kirpalani H, Lerman J. End-tidal, transcutaneous, and arterial pCO2 measurements in critically ill neonates: a comparative study. Anesthesiology. 1988;69:112-116.
18. Urbano J, Cruzado V, L opez-Herce J, del Castillo J, Bell on JM, Carrillo A. Accuracy of three transcutaneous carbon dioxide monitors in critically ill children. Pediatr Pulmonol. 2010;45:481-486.
19. Brown MK, DiBlasi RM. Mechanical ventilation of the premature neonate. Respir Care. 2011;56:1298-1311.
20. Klingenberg C, Wheeler KI, Davis PG, Morley CJ. A practical guide to neonatal volume guarantee ventilation. J Perinatol. 2011;31:575-585.
21. Nassabeh-Montazami S, Abubakar KM, Keszler M. The impact of instrumental dead-space in volume-targeted ventilation of the extremely low birth weight (ELBW) infant. Pediatr Pulmonol. 2009;44:128-133.
22. Lumb AB. Nunn’s Applied Respiratory Physiology, 8th edn. Philadelphia, PA: Elsevier; 2017:121.
23. Ivanov VA. Reduction of endotracheal tube connector dead space improves ventilation. Respir Care. 2016;61:155-161.
24. Badgwell JM, McLeod ME, Lerman J, Creighton RE. End-tidal PCO2 measurements sampled at the distal and proximal ends of the endotracheal tube in infants and children. Anesth Analg. 1987;66:959-964.
25. Kugelman A, Zeiger-Aginsky D, Bader D, Shoris I, Riskin A. A novel method of distal end-tidal CO2 capnography in intubated infants: comparison with arterial CO2 and with proximal mainstream end-tidal CO2. Pediatrics. 2008;122:e1219-e1224.
26. Bergofsky EH, Hurewitz AN. Airway insufflation: physiologic effects on acute and chronic gas exchange in humans. Am Rev Respir Dis. 1989;140:885-890.
27. Dassieu G, Brochard L, Benani M, Avenel S, Danan C. Continuous tracheal gas insufflation in preterm infants with hyaline membrane disease. A prospective randomized trial. Am J Respir Crit Care Med. 2000;162(3 Pt 1):826-831.
Tham khảo thêm một số bài viết cùng chủ đề: