Giới thiệu chung về Kháng sinh nhóm Aminoside
Lịch sử ra đời
Aminoside (tên gọi khác: Aminoglycoside) là một nhóm kháng sinh mạnh, phổ rộng, có nguồn gốc tự nhiên hoặc bán tổng hợp. Đây là một trong những nhóm kháng sinh được đưa vào sử dụng sớm nhất trên lâm sàng. Cùng với sự phát triển của các loại kháng sinh mới theo thời gian, nhóm kháng sinh này đã dần bị thay thế bởi các nhóm kháng sinh khác như các Cephalosporin, Carbapenem hoặc Quinolone vào những năm 1980 do những nhóm kháng sinh này có phổ tác dụng rộng hơn cùng những tác dụng không mong muốn ít hơn. Tuy vậy, các Aminoside vẫn chưa từng mất đi vai trò quan trọng của chúng trong điều trị các bệnh lý nhiễm khuẩn, đặc biệt là nhiều loại nhiễm trùng nguy hiểm và đe dọa tính mạng do các loài vi khuẩn kháng thuốc gây ra.

Aminoside đầu tiên được phát hiện và sử dụng trên lâm sàng là Streptomycin. Nó được tìm thấy trong môi trường nuôi cấy chủng xạ khuẩn Streptomyces griseus bởi Sir Waksman (ông được trao giải Nobel về Sinh lý và Y khoa năm 1952). Streptomycin sau đó đã được đưa vào ứng dụng trên lâm sàng từ năm 1944. Một số kháng sinh đại diện khác cũng nằm cùng nhóm với Streptomycin bao gồm: Neomycin được phân lập từ S.fradiae năm 1949, Kanamycin được phân lập từ S.kanamyceticus năm 1957, Gentamicin được phân lập từ Micromonospora purpurea năm 1963, Netilmicin được bán tổng hợp từ Sisomicin năm 1967, Tobramycin được phân lập từ S.tenebrarius năm 1967, Amikacin được bán tổng hợp từ Kanamycin năm 1972.
Cấu trúc hóa học
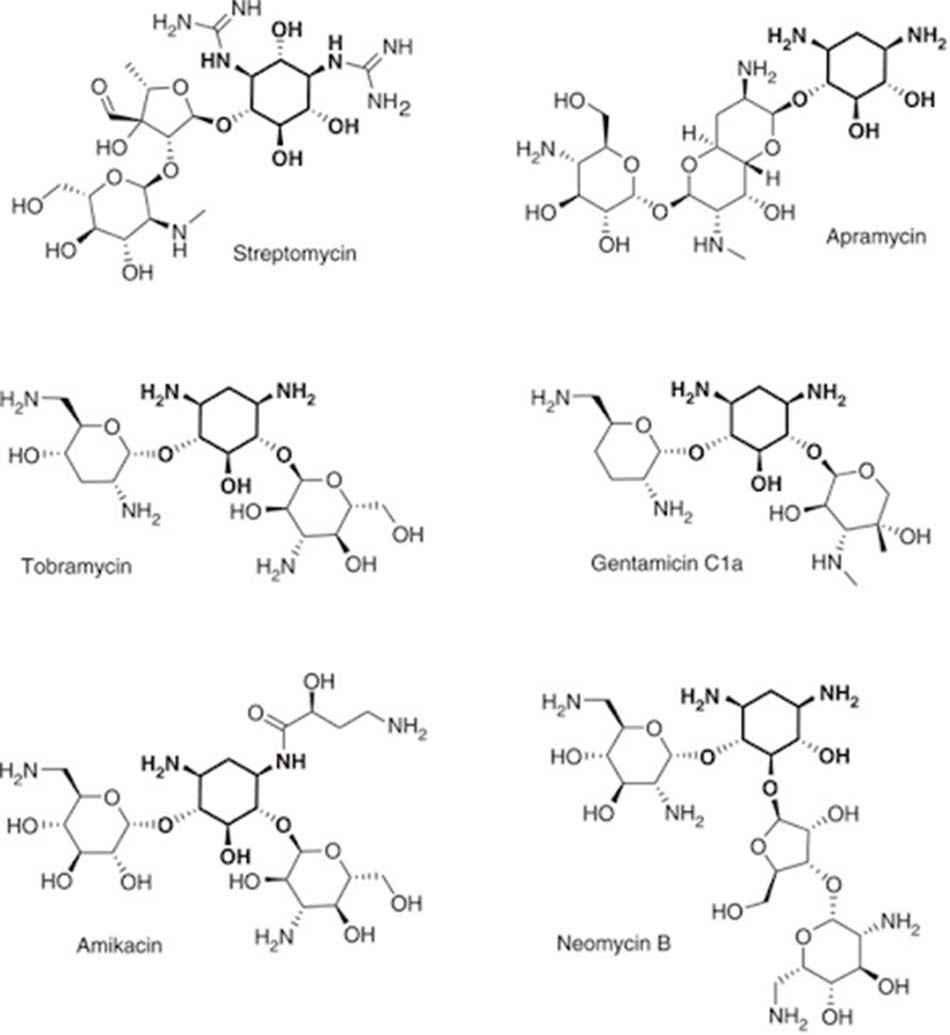
Các Aminoside đều có một cấu trúc lõi là đường amine (được bôi đậm ở hình dưới) liên kết với một dibasic aminocyclitol (loại phổ biến và thường gặp nhất là 2-deoxystreptamine) thông qua cầu nối glycoside. Dựa theo gốc aminocyclitol này, người ta có thể phân loại các kháng sinh nhóm Aminoside thành bốn nhóm nhỏ hơn:
- Non-deoxystreptamine (không có vòng 2-deoxystreptamine): Streptomycin (aminocyclitol của nó là streptidine).
- Deoxystreptamine thế một lần: Apramycin.
- Deoxystreptamine thế 4,5: Neomycin.
- Deoxystreptamine thế 4,6: Gentamicin, Amikacin và Tobramycin. Đây cũng là phân nhóm kháng sinh Aminoside quan trọng hơn cả và có ứng dụng trên lâm sàng nhiều nhất.
- Deoxystreptamine thế 4,5 có độc tính cao hơn so với deoxystreptamine thế 4,6.
Dược lực học
Cơ chế tác dụng
Các Aminoside là kháng sinh diệt khuẩn. Chúng ức chế tổng hợp protein của vi khuẩn thông qua ức chế tiểu đơn vị ribosome 30S. Cụ thể, các kháng sinh nhóm này liên kết mạnh với vị trí A của thành phần rARN 16S của tiểu đơn vị ribosome 30S. Sau khi đã liên kết với vị trí A, kháng sinh làm thay đổi cấu trúc của tiểu đơn vị 30S này, từ đó gây ra dịch sai mã khi tổng hợp chuỗi peptide do đọc sai các anticodon (bộ ba đối mã) trên tARN. Từ sự dịch mã sai này, vi khuẩn tổng hợp ra các chuỗi peptide bị sai về mặt cấu trúc và chức năng, dẫn đến thương tổn cho các thành phần khác của tế bào, đặc biệt là tổn thương màng tế bào làm cho các phân tử Aminoside khác xâm nhập vào tế bào vi khuẩn nhiều hơn. Ngoài cơ chế này, các Aminoside còn có cơ chế ức chế hình thành phức hợp khởi đầu hoặc ức chế sự kéo dài chuỗi peptide. Với nhiều cơ chế kết hợp như vậy, Aminoside liên kết và làm biến dạng tiểu đơn vị ribosome 30S không hồi phục, do vậy chúng có tác dụng diệt khuẩn nhanh chóng, điều này trái ngược với nhiều kháng sinh ức chế tổng hợp protein của vi khuẩn khác chủ yếu chỉ có tác dụng kìm khuẩn.
Các kháng sinh nhóm này cũng có một đặc trưng khá thú vị, đó là có tác dụng hậu kháng sinh (PAE: Post-Antibiotic Effect) kéo dài, điều này có nghĩa là chúng vẫn có khả năng ức chế vi khuẩn trong một thời gian dài ngay cả sau khi nồng độ kháng sinh đã xuống dưới ngưỡng nồng độ ức chế tối thiểu (MIC: Minimum Inhibitory Concentration).
Phổ tác dụng
Nói đến phổ tác dụng của các Aminoside là nói đến các vi khuẩn hiếu khí gram âm. Chúng đã biệt có hoạt tính tốt trên các chủng vi khuẩn thuộc họ Enterobacteriaceae như E.coli, Klebsiella pneumoniae, K.oxytoca, Enterobacter cloacae, E.aerogenes, Providencia spp., Proteus spp., Morganella spp. và Serratia spp. Phổ tác dụng của chúng cũng bao phủ trên Yersinia pestis và Francisella tularensis. Nhiều kháng sinh có tác dụng tốt trên Pseudomonas aeruginosa (trực khuẩn mủ xanh) và ở một mức độ nào đó là Acinetobacter baumannii. Trên vi khuẩn gram dương, hoạt tính của chúng yếu hơn và tập trung chủ yếu ở tụ cầu vàng Staphylococcus aureus, bao gồm cả một số chủng phân lập đã kháng Methicillin (MRSA) và Vancomycin (VRSA). Một số Aminoside có phổ tác dụng trên trực khuẩn lao Mycobacterium spp., bao gồm M.tuberculosis, M.fortuitum, M.chelonae và M.avium.
Các kháng sinh nhóm Aminoside không có tác dụng trên các vi khuẩn kị khí. Lý do là bởi các kháng sinh nhóm Aminoside để phát huy được tác dụng cần phải đi qua được màng tế bào vi khuẩn nhờ một cơ chế vận chuyển tích cực phụ thuộc oxy, mà vi khuẩn kỵ khí lại không có cơ chế vận chuyển này.
Các kháng sinh nhóm này cũng không có tác dụng trên các chủng Burkholderia spp., Stenotrophomonas spp., Streptococcus spp. và Enterococcus spp.
Cơ chế đề kháng
Các cơ chế đề kháng Aminoside đã được nghiên cứu chi tiết cho đến nay bao gồm:
– Thay đổi đích tác dụng của kháng sinh: Cơ chế kiểu này thường gặp nhất là methyl hóa rARN 16S thông qua các rARN 16S methyltransferases (RMTs). Điều này làm giảm ái lực gắn của phân tử kháng sinh với đích tác của nó. Nhìn chung có hai loại RMTs: Loại thứ nhất methyl hóa vị trí N7 của nucleotide G1405 gây ra đề kháng với các Aminoside thế 4,6; Loại thứ hai methyl hóa vị trí N1 của nucleotide A1408 gây ra đề kháng với cả Aminoside thế 4,6 và thế 4,5.
Một số trường hợp cụ thể đã được báo cáo về vấn đề này bao gồm: Loại thứ nhất là RmtA được mã hóa trên plasmid của một chủng trực khuẩn mủ xanh được phân lập ở Nhật Bản năm 2003, sau đó đã có thêm nhiều RMTs khác được phát hiện, được mã hóa bởi các gen như armA, các rmtB1, B2, C, D, D2, E, F, G và H; Loại thứ hai là NpmA cũng được mã hóa trên plasmid nhưng là của một chủng E.coli và cũng được phân lập ở Nhật Bản năm 2007.
– Sản xuất các enzyme biến đổi thuốc (AMEs: Aminoglycoside-Modifying Enzymes): Các AME này có khả năng biến đổi thuốc và từ đó làm mất hoạt tính kháng sinh. Chúng thường được quy định bởi các gen trên plasmid của vi khuẩn. Hiện nay, các nhà khoa học đã phát hiện được tới hơn 100 loại AMEs khác nhau. Chúng có khả năng acetyl hóa, phosphoryl hóa hoặc adenyl hóa phân tử kháng sinh. Hai nhóm hóa học chủ yếu của Aminoside bị tấn công là nhóm amino (-NH2) hoặc nhóm hydroxyl (-OH). Các AMEs này lần lượt có tên gọi như sau: AACs (Aminoglycoside N-acetyltransferases), ANTs (Aminoglycoside O-nucleotidyltransferases) và APHs (Aminoglycoside O-phosphotransferases).
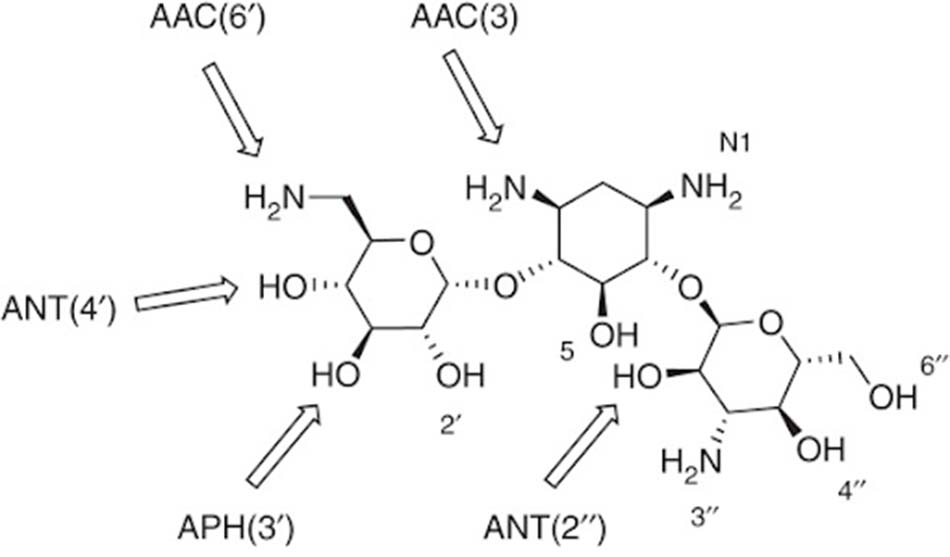
Trong các AMEs thì AACs là nhóm enzyme lớn nhất. Chúng acetyl hóa nhiều nhóm amino của phân tử kháng sinh. Nhóm acetyl thường được enzyme lấy từ acetyl-CoA. Trong khi đó, với các ANT và APH, nhóm adenyl và phosphoryl thường được lấy từ phân tử ATP. APH là nhóm enzyme biến đổi Aminoside lớn thứ hai, với cấu trúc và chức năng có sự tương đồng rất cao với các enzyme serine–threonine và tyrosine kinases ở tế bào nhân thực.

Hình thành bơm tống thuốc (Efflux Pump): Các bơm tống thuốc này có nhiệm vụ đẩy phân tử kháng sinh ra khỏi bào tương trước khi chúng kịp ức chế tiểu đơn vị ribosome 30S của vi khuẩn. Một vài thành viên thuộc họ bơm tống thuốc RND (Resistance-Nodulation-Division) cho thấy khả năng đề kháng Aminoside ở nhiều vi khuẩn khác nhau. Một số chủng trực khuẩn mủ xanh biểu hiện bơm tống đa thuốc (Mex: Multiple efflux) XY-OprM có khả năng đề kháng với không chỉ Aminoside mà còn kháng với cả Erythromycin và Tetracycline. Bơm tống thuốc AcrD ở E.coli cũng tham gia vào vận chuyển Aminoside. Ở A.baumannii là hệ thống bơm đẩy ABC và ở các chủng Mycobacteria spp. là MFS (major facilitator superfamily).
Giảm tính thấm màng tế bào: Cơ chế này thường liên quan đến tính đề kháng tự nhiên của các vi khuẩn kị khí với Aminoside đã được nói ở phần trước. Ngoài ra, không chỉ có các vi khuẩn kỵ khí, nhiều vi khuẩn hiếu khí gram âm không lên men khác, như trực khuẩn mủ xanh, cũng có cơ chế đề kháng với các kháng sinh nhóm Amnoside theo cách này. Cơ chế phân tử nhìn chung chưa rõ.
Cũng cần nói thêm là nhiều trực khuẩn hiếu khí gram âm có hiện tượng đề kháng thích nghi với Aminoside (ban đầu vi khuẩn nhạy cảm với kháng sinh, sau một thời gian dùng kháng sinh thì độ nhạy cảm giảm xuống).
Dược động học
Hấp thu: Các kháng sinh nhóm này là các phân tử tích điện dương, rất thân nước, vì vậy hầu như không thể hấp thu qua đường tiêu hóa. Các đường dùng phổ biến của nhóm kháng sinh này bao gồm đường tĩnh mạch, tiêm bắp, đường tại chỗ (da hoặc niêm mạc), đường hô hấp và đường tiêu hóa (cho nhiễm trùng đường tiêu hóa hoặc chủ đích tiêu diệt vi khuẩn trong hệ khuẩn chí đường ruột). Một số trường hợp đặc biệt hơn có thể dùng thuốc theo đường tiêm phúc mạc (màng bụng) hoặc tiêm trong não thất.
Phân bố: Vì cấu trúc thân nước nên các kháng sinh nhóm này phân bố chủ yếu trong máu và các dịch trong cơ thể, khả năng thấm vào mô khá kém. Thể tích phân bố thường nhỏ.
Chuyển hóa: Nhìn chung các kháng sinh nhóm này khó chuyển hóa khi dùng đường toàn thân, chúng thường được đào thải dưới dạng nguyên vẹn.
Thải trừ: Thải trừ chủ yếu qua nước tiểu (khi kháng sinh được dùng đường toàn thân). Thời gian bán thải thường nhỏ và tăng lên ở bệnh nhân suy giảm chức năng thận.
Tác dụng – Chỉ định
Kháng sinh nhóm này có tác dụng diệt khuẩn phụ thuộc nồng độ, điều này có nghĩa nồng độ kháng sinh càng cao thì số lượng vi khuẩn tiêu diệt được càng nhiều.
Các chỉ định của nhóm kháng sinh Aminoside bao gồm:
- Nhiễm trùng huyết.
- Viêm nội tâm mạc.
- Viêm phổi.
- Lao phổi.
- Nhiễm trùng đường tiết niệu – sinh dục, bao gồm lậu.
- Nhiễm trùng ổ bụng.
- Nhiễm trùng đường tiêu hóa (bao gồm cả nhiễm vi khuẩn hoặc ký sinh trùng).
- Bệnh Brucellosis.
- Bệnh Listeriosis.
- Dịch hạch.
- Xơ nang.
- Dự phòng trước phẫu thuật đường tiêu hóa.
Thông thường các kháng sinh nhóm này không được dùng đơn độc mà chủ yếu là được sử dụng kết hợp với các nhóm kháng sinh khác (thường là β-lactam) để tăng hiệu quả điều trị và hạn chế kháng thuốc.
Cách dùng – Liều dùng
Cách dùng các loại kháng sinh này còn phụ thuộc vào đường dùng thuốc, nhưng đường tiêm bắp và tĩnh mạch là được ứng dụng nhiều hơn cả.
Liều dùng cụ thể của một số loại kháng sinh thường gặp theo chỉ định:
Streptomycin
+ Lao phổi: Chỉ sử dụng trong giai đoạn tấn công, liều 15 mg/kg IM (tiêm bắp) 1 lần/ngày, liều tối đa 1 g/ngày hoặc 25-30 mg/kg IM 2 lần/tuần, liều tối đa 1.5 g/ngày.
+ Dịch hạch: 15 mg/kg IM mỗi 12 giờ trong tối thiểu 10 ngày.
+ Viêm nội tâm mạc do liên cầu (Streptococcus): 7 ngày đầu 1 g IM mỗi 12 giờ, 7 ngày tiếp theo 0.5 g IM mỗi 12 giờ. Sử dụng phối hợp với Penicillin.
+ Viêm nội tâm mạc do cầu khuẩn ruột (Enterococcus): 2 tuần đầu 1 g IM mỗi 12 giờ, 4 tuần tiếp theo 0.5 g IM mỗi 12 giờ. Sử dụng phối hợp với Penicillin.
+ Bệnh Brucellosis: 7 ngày đầu 1 g IM 1-2 lần/ngày, 7 ngày tiếp theo 1 g IM 1 lần/ngày. Sử dụng phối hợp với Tetracycline hoặc Doxycycline.
Neomycin
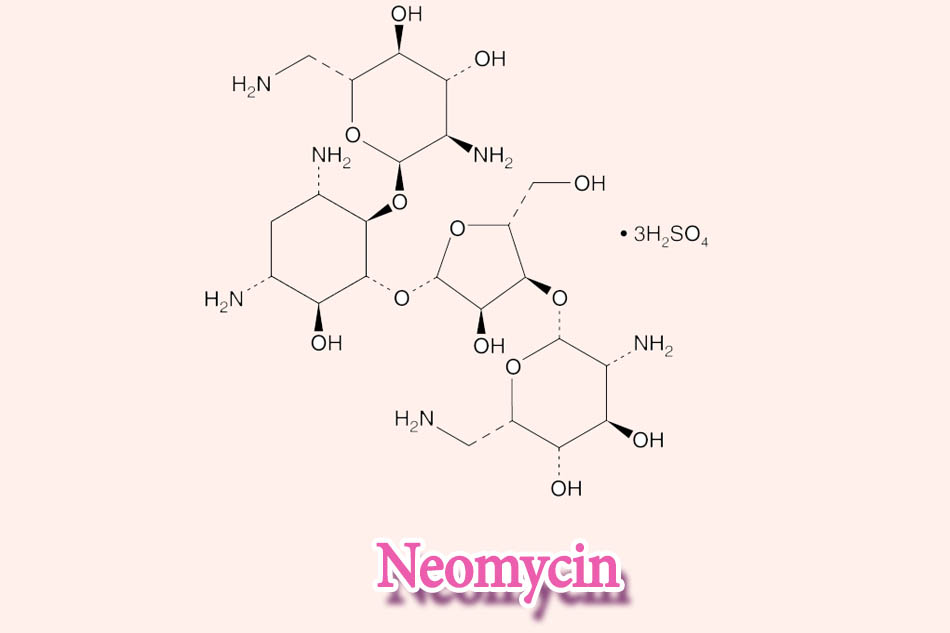
+ Nhiễm trùng tại chỗ.
+ Dự phòng trước phẫu thuật đường tiêu hóa: 1 g PO (uống) vào các thời điểm 19, 18 và 9 giờ trước phẫu thuật.
+ Hội chứng não gan: Cấp 1-3 g PO mỗi 6 giờ trong 5-6 ngày hoặc 0.75-1.5 g mỗi 6 giờ trong 1-2 tuần. Mạn tối đa 4 g/ngày PO.
+ Tiêu chảy do E.coli: 0.75 g/lần PO mỗi 6 giờ.
Gentamicin
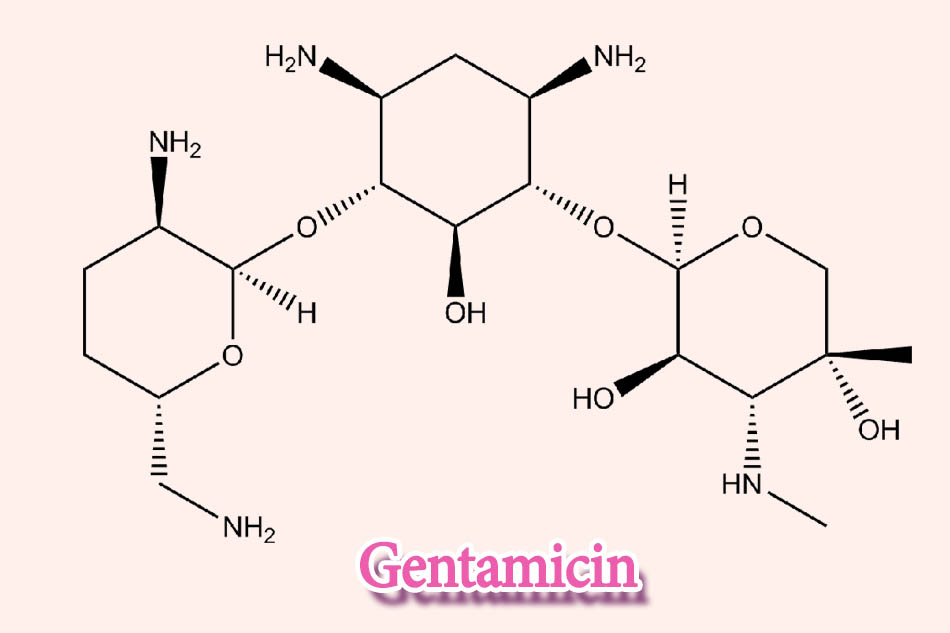
+ Nhiễm trùng toàn thân: 3-5 mg/kg/ngày IM/IV (tiêm bắp/tĩnh mạch) chia ra mỗi 8 giờ.
+ Nhiễm trùng đường tiết niệu: Như “Nhiễm trùng toàn thân” hoặc 160 mg 1 lần/ngày.
+ Viêm nội tâm mạc do cầu khuẩn ruột: 3 mg/kg/ngày IM/IV chia ra mỗi 8 giờ. Phối hợp với β-lactam trong 4-6 tuần hoặc Vancomycin trong 6 tuần.
+ Viêm nội tâm mạc do tụ cầu vàng (S.aureus): 3 mg/kg/ngày IM/IV chia ra mỗi 8-12 giờ. Sử dụng kết hợp với kháng sinh nhóm β-lactam hoặc Vancomycin tùy theo tụ cầu có kháng Methicillin hay không. Thời gian điều trị 3-5 ngày với nhiễm trùng van tự nhiên và 2 tuần với van giả.
+ Viêm nội tâm mạc do liên cầu: 3 mg/kg/ngày IM/IV 1 lần/ngày (ưu tiên hơn) hoặc chia ra mỗi 8 giờ. Thời gian điều trị có thể từ 2-6 tuần tùy theo mức độ kháng thuốc của vi khuẩn và nhiễm trùng là trên van tự nhiên hay van giả.
+ Xơ nang: 7.5-10.5 mg/kg/ngày IV/IM chia ra mỗi 8 giờ.
+ Bệnh viêm vùng chậu: Liều nạp 2 mg/kg IM/IV, liều duy trì 1.5 mg/kg IM/IV mỗi 8 giờ. Sử dụng phối hợp với Clindamycin.
Tobramycin
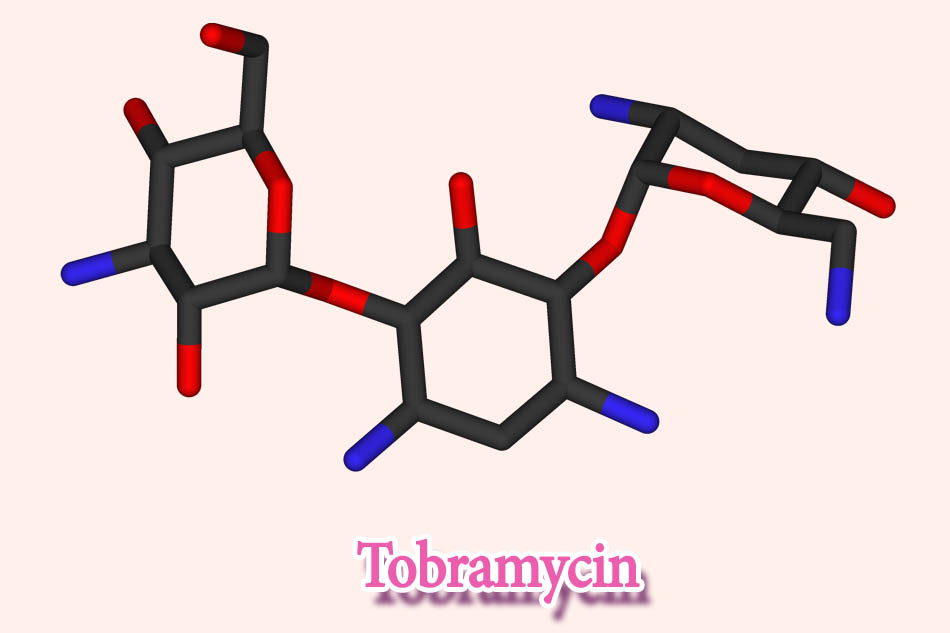
+ Nhiễm trùng trực khuẩn mủ xanh ở bệnh nhân xơ nang: Khí dung 300 mg 2 lần/ngày hoặc bột hít 4 viên nang (28 mg/viên) 2 lần/ngày. Sử dụng thuốc theo chu kỳ 28 ngày (28 ngày dùng thuốc – 28 ngày nghỉ – 28 ngày dùng thuốc – 28 ngày nghỉ).
+ Nhiễm trùng toàn thân: 1-2 mg/kg IM/IV mỗi 8 giờ hoặc 4-7 mg/kg IM/IV hàng ngày.
Amikacin
+ Bệnh phổi do phức hợp M.avium (MAC: M.avium Complex): Dùng Amikacin liposome dạng hít 590 mg/8.4 mL hàng ngày.
+ Nhiễm trùng đường tiết niệu: 250 mg IV/IM mỗi 12 giờ.
+ Viêm phổi bệnh viện: 20 mg/kg/ngày IV. Nên phối hợp với β-lactam chống trực khuẩn mủ xanh hoặc Carbapenem (trừ Ertapenem do không có tác dụng trên trực khuẩn mủ xanh).
Spectinomycin (họ hàng gần với Aminoside):
+ Lậu: 2-4 g IM 1 liều duy nhất.
Paromomycin
+ Lỵ amip tại ruột do Entamoeba histolytica: 25-35 mg/kg/ngày PO chia ra mỗi 6 giờ trong 5-10 ngày.
+ Hôn mê gan: 4 g/ngày PO trong 5-6 ngày.
+ Nhiễm ký sinh trùng Dientamoeba fragilis: 20-30 mg/kg/ngày PO chia ra mỗi 8 giờ.
+ Nhiễm sán dây do Taenia saginata (sán dây bò), T.solium (sán dây lợn), Diphyllobothrium latum (sán dải cá), Dipylidium caninum (sán dải chó mèo): 11 mg/kg PO chia ra mỗi 15 phút cho 4 liều.
+ Nhiễm sán dải lùn (Hymenolepis nana): 45 mg/kg PO hàng ngày trong 5-7 ngày.
Plazomicin
+ Nhiễm trùng đường tiết niệu biến chứng: 15 mg/kg IV mỗi 24 giờ, truyền trong 30 phút. Thời gian điều trị 4-7 ngày.
+ Nhiễm trùng huyết: Đang chờ FDA (Cơ quan Quản lý Thực phẩm và Dược phẩm) Hoa Kỳ phê duyệt.
Tác dụng không mong muốn
Các tác dụng không mong muốn điển hình dưới đây chỉ xét đến các Aminoside dùng đường toàn thân.
– Độc tính trên thận: Đây là độc tính điển hình của các kháng sinh nhóm này. Tuy nhiên, may mắn là độc tính này có hồi phục. Tỷ lệ bệnh nhân gặp phải tác dụng không mong muốn này là 10-25%. Vị trí cụ thể mà các kháng sinh nhóm này gây tổn thương cho thận là ống thận. Độc tính trên thận của kháng sinh tăng lên khi bệnh nhân có các yếu tố nguy cơ đi kèm như mất nước, mang thai, dùng thuốc khác độc với thận (Vancomycin, thuốc chống viêm không steroid [NSAIDs: Non-Steroidal Anti-Inflammatory Drugs], thuốc lợi tiểu…) hay bệnh nhân có bệnh nền suy thận…
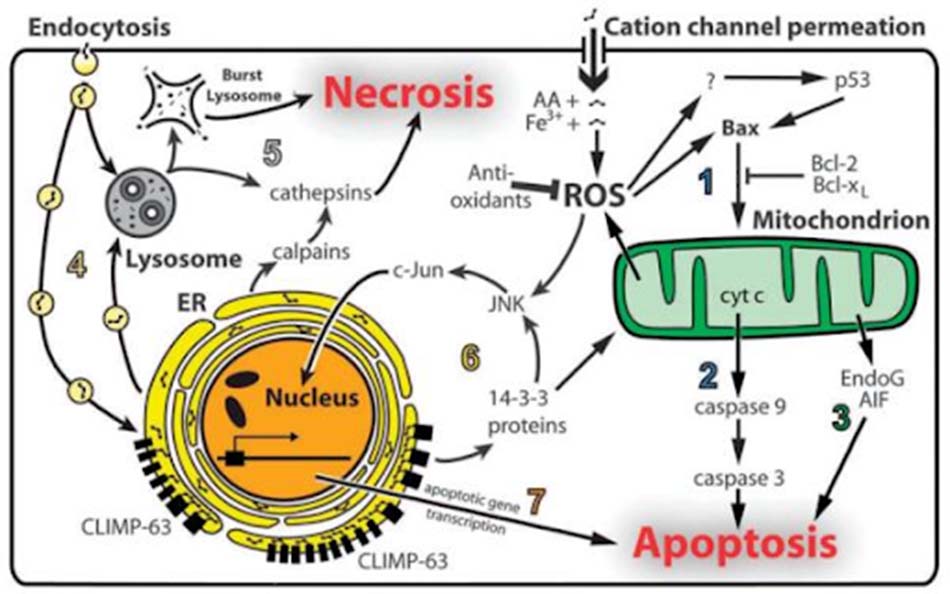
– Độc tính trên tai: Không giống như độc tính trên thận, độc tính trên tai là không hồi phục. Khoảng 2-45% bệnh nhân trưởng thành sẽ bị tổn thương tai vĩnh viễn. Tổn thương này có thể nằm ở tiền đình hoặc ốc tai, hoặc cả hai. Streptomycin, Tobramycin và Gentamicin gây độc cho tiền đình nhiều hơn, còn Kanamycin và Amikacin gây độc cho ốc tai nhiều hơn. Độc tính phụ thuộc liều.
– Ức chế dẫn truyền thần kinh – cơ: Độc tính này ít phổ biến hơn so với độc tính trên thận và tai. Nguy cơ gặp phải độc tính này cao hơn khi dùng cùng các thuốc khác cũng ức chế dẫn truyền thần kinh – cơ (thuốc chẹn kênh calci, thuốc giãn cơ nhóm cura).
Chống chỉ định sử dụng thuốc kháng sinh nhóm Aminoside
Quá mẫn cảm với bất cứ thành phần nào của thuốc.
Bệnh nhân nhược cơ.
Tương tác thuốc
Phối hợp với các kháng sinh ức chế tổng hợp vách tế bào như các β-lactam hoặc Vancomycin: Phối hợp này đem lại tác dụng hiệp đồng tăng mức (“1 + 1 > 2”). Đây là phối hợp kinh điển trên lâm sàng. Phối hợp này thường dùng trong điều trị các nhiễm trùng nặng như nhiễm trùng huyết, viêm phổi bệnh viện hoặc do vi khuẩn kháng thuốc gây ra. Cơ chế hiệp đồng của hai loại kháng sinh này được đề xuất như sau: Các kháng sinh nhóm β-lactam hoặc Vancomycin ức chế tổng hợp thành tế bào vi khuẩn, làm thành tế bào bị rò rỉ, tạo điều kiện cho các kháng sinh nhóm Aminoside thấm vào bên trong tế bào và ức chế tiểu đơn vị ribosome 30S. Khi tiểu đơn vị này bị ức chế, quá trình tổng hợp protein của vi khuẩn bị lỗi, tạo ra nhiều protein sai chức năng, làm thành và màng tế bào tiếp tục bị tổn thương nhiều hơn và cuối cùng dẫn đến vi khuẩn chết. Sự ức chế tổng hợp protein do các Aminoside gây ra cũng đồng thời ức chế sự sản xuất enzyme phá hủy kháng sinh β-lactamase của vi khuẩn. Điều này lại tạo thuận lợi cho các kháng sinh nhóm β-lactam. Như vậy, đó là sự hiệp đồng tác dụng về dược lực học.
Ứng dụng dược động học/dược lực học (PK/PD) trong tối ưu hóa chế độ liều: Khi phối hợp các kháng sinh nhóm β-lactam hoặc Vancomycin với Aminoside, nếu không có chỉ định gì đặc biệt, chế độ liều thường được áp dụng trên lâm sàng là sử dụng các β-lactam hoặc Vancomycin nhiều lần trong ngày, còn các Aminoside sử dụng 1 lần/ngày. Lý do cho sự phối hợp này là: Các kháng sinh nhóm β-lactam hoặc Vancomycin là kháng sinh diệt khuẩn phụ thuộc thời gian, điều này có nghĩa là chúng ta chỉ cần nồng độ kháng sinh trong máu cao hơn giá trị MIC của vi khuẩn, chứ không cần thiết nồng độ kháng sinh trong máu thật cao. Nồng độ kháng sinh nhóm này trong máu quá cao sẽ làm tăng nguy cơ gặp độc tính của thuốc, trong khi tác dụng diệt khuẩn không tăng lên. Ngược lại với các β-lactam hoặc Vancomycin, Aminoside là kháng sinh diệt khuẩn phụ thuộc nồng độ (nồng độ càng cao diệt khuẩn càng mạnh), vậy nên sử dụng thuốc 1 lần/ngày với liều tối đa sẽ tận dụng được các ưu điểm sau của kháng sinh: Tạo nồng độ kháng sinh cao tại ổ nhiễm khuẩn, tận dụng được PAE kéo dài, đồng thời làm giảm thiểu độc tính trên thận. Các kháng sinh nhóm β-lactam hoặc Vancomycin đạt hiệu quả cao nhất khi số lượng vi khuẩn trong ổ nhiễm khuẩn ít, còn các Aminoside lại đạt hiệu quả cao nhất khi số lượng vi khuẩn nhiều. Do vậy, các Aminoside có nhiệm vụ làm giảm nhanh số lượng vi khuẩn trong ổ nhiễm khuẩn, sau đó các β-lactam hoặc Vancomycin sẽ thể hiện tác dụng của mình.
Trong một số trường hợp, chế độ liều Aminoside 1 lần/ngày không chứng minh được hiệu quả hơn so với chế độ liều nhiều lần/ngày (ví dụ: viêm nội tâm mạc), do vậy chế độ liều dùng nhiều lần/ngày vẫn được áp dụng.
Phối hợp với các thuốc có độc tính trên thận: Tăng nguy cơ gặp phải độc tính trên thận. Cần theo dõi chức năng thận thường xuyên.
Phối hợp với các thuốc ức chế thần kinh – cơ : Tăng nguy cơ gặp phải độc tính trên thần kinh – cơ, nguy hiểm nhất là liệt cơ hô hấp. Nên tránh phối hợp này.
Lưu ý và thận trọng khi sử dụng thuốc kháng sinh nhóm Aminoside
Theo dõi chức năng thận của bệnh nhân trong quá trình dùng Aminoside (có thể dựa vào độ thanh thải creatinine). Nếu không có chỉ định gì đặc biệt, nên cắt thuốc càng sớm càng tốt (thường chỉ sử dụng trong 3-5 ngày).
Chóng mặt có thể là dấu hiệu cho sự tổn thương tiền đình.
Bệnh nhân có thể gặp viêm phổi quá mẫn, ho ra máu, co thắt phế quản.
Có thể sử dụng muối calci để đảo ngược tình trạng yếu cơ do Aminoside gây ra.
Sử dụng thuốc kháng sinh nhóm Aminoside trên đối tượng đặc biệt
Bệnh nhân suy giảm chức năng gan thận: Với chức năng thận suy giảm, nguy cơ gặp độc tính cao hơn, có thể cần hiệu chỉnh liều. Bệnh nhân suy giảm chức năng gan thường không chịu ảnh hưởng nhiều, nhưng nếu thể tích phân bố tăng cao, bệnh nhân có thể cần liều thuốc cao hơn bình thường.
Người già và trẻ em: Người già, trẻ đẻ non và trẻ sơ sinh có chức năng thận kém hơn người khỏe mạnh bình thường, nguy cơ gặp độc tính trên thận cao hơn. Có thể cần hiệu chỉnh liều.
Phụ nữ có thai và đang cho con bú: Nhìn chung không nên dùng thuốc cho phụ nữ có thai, trừ khi bắt buộc. Phân loại an toàn trong thai kỳ: D. Không rõ thuốc có vào được sữa mẹ hay không. Không khuyến khích dùng thuốc khi đang cho con bú.
Một số nghiên cứu và thử nghiệm lâm sàng
– Thử nghiệm lâm sàng pha III đối chứng ngẫu nhiên, mù đôi đánh giá hiệu quả của Amikacin dạng hít bổ trợ cho chế độ kháng sinh chăm sóc tiêu chuẩn đường tĩnh mạch ở bệnh nhân bị viêm phổi do vi khuẩn gram âm phải thở máy cơ học (INHALE) đưa ra kết luận: Không ủng hộ sử dụng Amikacin dạng hít bổ trợ cho những trường hợp bệnh nhân trong thử nghiệm.
– Thử nghiệm lâm sàng ngẫu nhiên so sánh Tobramycin với Colistin khí dung ở bệnh nhân xơ nang cho kết quả: Tobramycin khí dung cải thiện đáng kể chức năng phổi và làm giảm đáng kể mật độ trực khuẩn mủ xanh trong đờm ở những bệnh nhân xơ nang nhiễm trùng mạn tính. Colistin khí dung cũng làm giảm đáng kể mật độ trực khuẩn mủ xanh trong đờm, nhưng không cải thiện đáng kể chức năng phổi.
Tài liệu tham khảo
Krause, K. M., Serio, A. W., Kane, T. R., & Connolly, L. E. (2016). “Aminoglycosides: An Overview”. Cold Spring Harbor Perspectives in Medicine, 6(6), a027029.
Link: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4888811/
Niederman, M. S., Alder, J., Bassetti, M., Boateng, F., Cao, B., Corkery, K., … Chastre, J. (2019). “Inhaled amikacin adjunctive to intravenous standard-of-care antibiotics in mechanically ventilated patients with Gram-negative pneumonia (INHALE): a double-blind, randomised, placebo-controlled, phase 3, superiority trial”. The Lancet Infectious Diseases.
Link: https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(19)30574-2/fulltext
Hodson, M. E., Gallagher, C. G., & Govan, J. R. W. (2002). “A randomised clinical trial of nebulised tobramycin or colistin in cystic fibrosis”. European Respiratory Journal, 20(3), 658–664.
Link: https://pubmed.ncbi.nlm.nih.gov/12358344/
Tham khảo thêm: