Bài viết Đột quỵ không rõ nguồn gốc: Nguyên nhân, chẩn đoán và điều trị được dịch bởi Thạc sĩ – Bác sĩ Phạm Hoàng Thiên từ bài báo gốc UNDERSTANDING DIAGNOSIS AND TREATMENT OF CRYPTOGENIC STROKE .
Những điểm quan trọng
Đột quỵ không rõ nguồn gốc (CS: Cryptogenic Stroke) được định nghĩa là nhồi máu não không rõ ràng là do thuyên tắc từ tim, xơ vữa động mạch lớn hay bệnh động mạch nhỏ mặc dù đã kiểm tra tích cực.
Khoảng 1/4 đột quỵ thiếu máu cục bộ được phân loại là không rõ nguồn gốc (gần 175.000 case đột quỵ hàng năm ở Hoa Kỳ).
Khả năng xác định rõ hơn nguyên nhân của CS có ý nghĩa đối với việc điều trị tiếp theo và nguy cơ tái phát các biến cố. Hầu hết các bệnh nhân bị CS được điều trị bằng sự kết hợp giữa liệu pháp kháng tiểu cầu và giảm yếu tố nguy cơ đột quỵ – các phương pháp điều trị hiệu quả không cao trong việc ngăn ngừa đột quỵ có nguồn gốc tim mạch tái phát.
Chụp cộng hưởng từ (MRI) và chụp cắt lớp vi tính (CT) có độ nhạy tương tự đối với xuất huyết nội sọ cấp tính; tuy nhiên, MRI vượt trội so với CT trong việc phát hiện đột quỵ thiếu máu cục bộ.
Chụp hình ảnh mạch máu tiêu chuẩn có thể không phát hiện được trong các trường hợp đột quỵ do mảng bám bên trong lòng mạch mà không có hẹp đáng kể hoặc mảng bám dưới chỗ hẹp bị loét (ulcerated substenotic plaque).
Siêu âm tim qua thực quản (TEE) vượt trội hơn so với siêu âm tim qua thành ngực (TTE) trong việc loại trừ các nguồn gốc tim mạch gây đột quỵ.
Các nguyên nhân khác gây CS (ví dụ, tồn tại lỗ bầu dục [PFO], thrombophilia di truyền, mảng bám quai động mạch chủ, nhiễm trùng, tự miễn, tình trạng viêm…) nên được xem xét sau khi loại trừ các nguyên nhân phổ biến hơn.
Theo dõi tim dài hạn đối với rung nhĩ (AF) có thể có lợi ở những bệnh nhân bị CS và có khả năng thay đổi cách điều trị.
The American Stroke Association’s Cryptogenic Stroke Initiative, do Medtronic tài trợ, buộc các bên liên quan chính tăng cường nỗ lực xác định rõ nguyên nhân của CS, thúc đẩy trách nhiệm để cải thiện việc chăm sóc cho những bệnh nhân này và ngăn ngừa đột quỵ tái phát, từ đó giảm tỷ lệ tử vong và tàn tật do đột quỵ.
Giới thiệu: Đột quỵ không rõ nguồn gốc Cryptogenic Stroke
Đột quỵ là một cuộc khủng hoảng sức khỏe cộng đồng lớn ở Hoa Kỳ và trên toàn thế giới. Chỉ riêng tại Hoa Kỳ, ước tính khoảng 7 triệu người ≥ 20 tuổi đã bị đột quỵ (ngoại suy đến năm 2016 bằng cách sử dụng dữ liệu NHANES 2013-2016). [1] Mỗi năm, có khoảng 795.000 người trải qua một cơn đột quỵ mới hoặc tái phát, và hơn 142.000 người chết vì đột quỵ, khiến nó trở thành nguyên nhân gây tử vong đứng hàng thứ năm.[1] Đột quỵ là một nguồn đáng kể của khuyết tật dài hạn, với phần lớn bệnh nhân gặp phải ít nhất một số sự suy yếu còn dư lại sáu tháng sau biến cố. [1]
Đột quỵ là một thực thể không đồng nhất trên lâm sàng. Khoảng 87% đột quỵ là thiếu máu cục bộ, 10% là xuất huyết nội sọ và 3% là xuất huyết dưới nhện. [1] Đột quỵ thiếu máu cục bộ có một số loại phụ (Hình 1). Trong số đó, hai loại phổ biến nhất là đột quỵ do xơ vữa động mạch lớn (~ 30%) và có lẽ đáng ngạc nhiên là đột quỵ không rõ nguồn gốc, hay còn gọi là CS (~ 25%). Nhìn chung, đột quỵ có nguồn gốc tim mạch chiếm khoảng 20% đột quỵ do thiếu máu cục bộ. Mặc dù tỷ lệ chính xác của CS chưa được biết, nhưng ước tính có thể là khoảng 25%.[2] Ngoại suy từ thống kê tỷ lệ mắc hiện tại, điều này cho thấy rằng có gần 175.000 đột quỵ hàng năm mà không có nguyên nhân rõ ràng nào có thể được phân biệt.
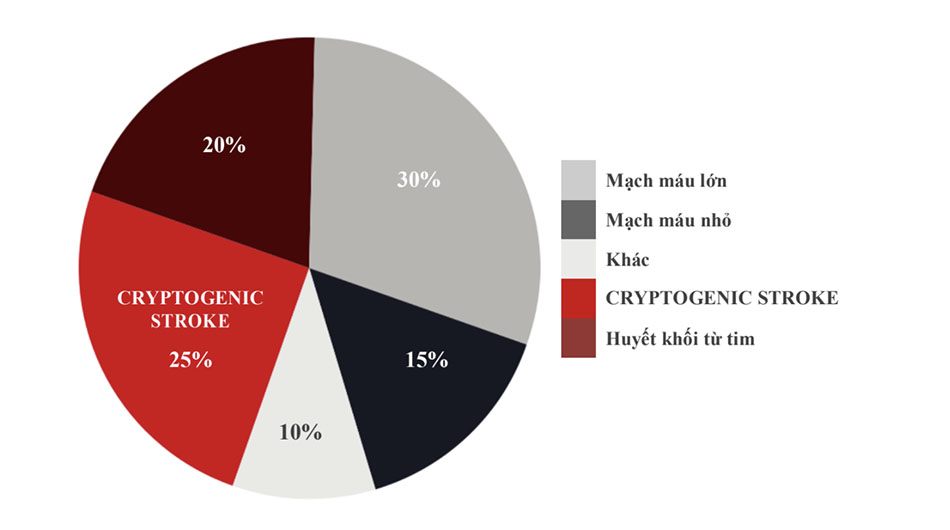
CS đặt ra một câu hỏi hóc búa lâm sàng đặc biệt ở chỗ, trong trường hợp không có nguyên nhân rõ ràng, các phương thức điều trị xuôi dòng (downstream treatment) thích hợp nhất được đề nghị là giáo dục ở mức tốt nhất. Làm phức tạp thêm cơ chế của nguyên nhân gây CS là bản chất không đồng nhất của phân nhóm này – ví dụ, nó có thể được gây ra bởi một số cơ chế chứ không phải là một cơ chế chính (ví dụ, xơ vữa động mạch lớn). Một số cơ chế tiềm ẩn cho CS đã được xác định. [3]
Khả năng xác định rõ hơn nguyên nhân của đột quỵ có ý nghĩa sâu sắc đối với việc điều trị tiếp theo và quan trọng hơn là nguy cơ tái phát các biến cố. Thuyên tắc từ tim thứ phát sau cơn rung nhĩ kịch phát khó nhận biết (AF) có thể là nguyên nhân phổ biến của giả CS. [3] Các cơ chế bổ sung bao gồm – nhưng không giới hạn – là tình trạng thuyên tắc nghịch lý thứ phát do PFO (tồn tại lỗ bầu dục) hoặc các bất thường vách liên nhĩ khác, [4,5] thrombophilia (bao gồm các tình trạng tăng đông như các tình trạng liên quan đến kháng thể kháng phospholipid hoặc tăng đông liên quan đến ung thư),[6] viêm nội tâm mạc không do vi khuẩn, và bệnh mạch máu não tiền lâm sàng hoặc cận lâm sàng.
Hiện nay, phần lớn bệnh nhân bị CS đều được điều trị kháng tiểu cầu để phòng ngừa đột quỵ thứ phát. [7] Do sự thiếu hiệu quả tương đối của các thuốc chống kết tập tiểu cầu trong điều trị đột quỵ do thuyên tắc từ tim, việc xác định cơn rung nhĩ kịch phát trong bối cảnh sau đột quỵ – và đưa ra liệu pháp chống đông máu thích hợp – là rất quan trọng.
Hướng dẫn này nhằm làm rõ định nghĩa về CS ở người trưởng thành và cung cấp hướng dẫn về các phương thức chẩn đoán nên được sử dụng trước khi tuyên bố một đột quỵ là “không rõ nguồn gốc”. Hơn nữa, hướng dẫn này khám phá những lợi ích lâm sàng của các khoảng thời gian theo dõi khác nhau sau đột quỵ để phát hiện rung nhĩ ở những bệnh nhân bị CS.
CRYPTOGENIC STROKE LÀ GÌ?
Phân loại CS được sử dụng lần đầu tiên trong NINDS (National Institute of Neurological Disorders and Stroke), [8,9] và sau đó được sửa đổi như một phần trong nỗ lực tinh chỉnh phân loại đột quỵ trong nghiên cứu TOAST (Trial of ORG 10172 in Acute Stroke Treatment).[10] Như được trình bày trong Bảng 1, TOAST [10] (là sơ đồ phân loại được sử dụng phổ biến nhất trong thực hành lâm sàng), định nghĩa CS (đột quỵ do nguyên nhân không xác định) là nhồi máu não không liên quan đến thuyên tắc từ tim, xơ vữa động mạch lớn hoặc xơ vữa động mạch lớn bệnh động mạch nhỏ mặc dù đã kiểm tra mạch máu, tim và huyết thanh tích cực. Lưu ý rằng phân loại TOAST bao gồm ≥ 2 nguyên nhân có vẻ hợp lý tương đương nhau thì được phân loại theo nguyên nhân không xác định. Sự thống nhất giữa các bên rất kém đối với các đột quỵ không rõ nguyên nhân sử dụng tiêu chí TOAST. [11]
| Bảng 1. TOAST Phân loại của đột quỵ thiếu máu não cục bộ cấp tính [10]
Xơ vữa động mạch lớn. Thuyên tắc từ tim. Tắc nghẽn mạch máu nhỏ *. Đột quỵ có nguyên nhân xác định khác *. Đột quỵ không có nguyên nhân xác định.
|
* Có thể hoặc có khả năng xảy ra tùy thuộc vào kết quả của các xét nghiệm hỗ trợ.
Mặc dù tiêu chí TOAST xác định rõ ràng rằng CS là một loại đột quỵ mà chưa biết nguyên nhân, nhưng họ không chỉ ra các phương thức chẩn đoán cụ thể cần phải âm tính để tuyên bố đột quỵ nào là CS. Các tiêu chí khác, chẳng hạn như Hệ thống phân loại nguyên nhân (CCS: Causative Classification System) yêu cầu chụp hình ảnh não, chụp mạch máu não và đánh giá chức năng tim.[12] Hệ thống phân loại này phân chia CS thành ―cryptogenic embolism‖ (thuyên tắc không rõ nguồn gốc) và ―other cryptogenic‖ (không rõ nguồn gốc khác) – đề cập đến một cơn đột quỵ có bằng chứng chụp mạch máu có hình ảnh cắt cụt phù hợp với cục máu đông, trong khi các động mạch nội sọ khác trông bình thường, bằng chứng hình ảnh của sự tái tạo hoàn toàn của động mạch bị tắc trước đó, hoặc sự hiện diện của nhiều nhồi máu cấp tính đã xảy ra gần đây có liên quan chặt chẽ về thời gian mà không phát hiện được bất thường trong các mạch máu tương ứng. Thuật ngữ ―other cryptogenic stroke‖ được dành riêng cho những đột quỵ không đáp ứng đầy đủ các tiêu chí của cryptogenic embolism.
Chẩn đoán Đột quỵ không rõ nguyên nhân
Kiểm tra tối thiểu
Theo guidelines, các đánh giá cơ bản ở mức tối thiểu nên bao gồm: [13]
- CT hoặc MRI não không thuốc.
- Glucose máu.
- Độ bão hòa oxy.
- Điện giải đồ/chức năng thận.
- Công thức máu, bao gồm cả số lượng tiểu cầu.
- Men tim.
- Prothrombin time/International Normalized Ratio (INR).
- APTT (Activated partial thromboplastin time).
- Điện tim.
Kiểm tra bổ sung
Khi nó là một chẩn đoán loại trừ, thì ước tính tỷ lệ đột quỵ được phân loại là không rõ nguyên nhân sẽ giảm. Rõ ràng là chẩn đoán đột CS có thể thay đổi tùy thuộc vào trung tâm, phương thức chẩn đoán có sẵn và kinh nghiệm của bác sĩ. Nghiên cứu CRYSTAL AF (The Cryptogenic Stroke and Underlying Atrial Fibrillation) đã sử dụng một phương pháp loại trừ nghiêm ngặt để xác định bệnh nhân CS. [14] Trong nghiên cứu này, đột quỵ chỉ được phân loại là CS sau khi xét nghiệm tích cực bao gồm ECG 12 đạo trình, monitoring ECG 24 giờ hoặc hơn, siêu âm tim qua thực quản, sàng lọc các tình trạng tăng đông/huyết khối (ở bệnh nhân < 55 tuổi) và chụp cộng hưởng từ mạch máu (MRA), chụp cắt lớp vi tính mạch máu (CTA), hoặc chụp động mạch ở đầu và cổ. Siêu âm động mạch cổ và siêu âm Doppler xuyên sọ của các mạch máu nội sọ, thay cho MRA hoặc CTA vùng đầu và cổ, được phép cho bệnh nhân trên 55 tuổi.
Việc phân loại một trường hợp đột quỵ riêng lẻ là ―cryptogenic‖ (không rõ nguồn gốc) có thể thay đổi tùy thuộc vào bối cảnh chăm sóc và các kỹ thuật sẵn có. Con đường chẩn đoán chuẩn xác được sử dụng trong CRYSTAL AF có thể không khả thi về mặt kỹ thuật trong các bệnh viện không phải là trung tâm học thuật lớn hoặc không phải trong một thử nghiệm lâm sàng.
Các dấu hiệu trên hình ảnh não
CT sọ não không thuốc là không tốn kém và hiệu quả cao để loại trừ xuất huyết nội sọ, tuy nhiên, [15] nó là kém nhất để xác định những ổ nhồi máu nhỏ. MRI có độ nhạy tương tự CT đối với xuất huyết nội sọ cấp tính, nhưng vượt trội hơn nhiều so với CT trong việc phát hiện đột quỵ thiếu máu cục bộ. Trong một nghiên cứu, MRI đã phát hiện đột quỵ thiếu máu cục bộ cấp tính ở 46% bệnh nhân, so với 10% ở CT.[16] Nói chung, khi thực hành lâm sàng, nếu có sẵn thì MRI nên được ưu tiên hơn CT cho hình ảnh ban đầu của bệnh nhân đột quỵ. Các dấu hiệu trên diffusion-weighted MRI cũng có thể giúp xác định cơ chế đột quỵ; ví dụ, nhiều tổn thương ở các vùng mạch máu khác nhau có thể gợi ý, nhưng không chứng minh được nguồn gốc là do tim mạch. Ngược lại, các tổn thương rải rác giới hạn trong vùng phân phối của một mạch máu duy nhất gợi ý, nhưng không chứng minh được là do xơ vữa động mạch lớn. [15,17] Một số tác giả cho rằng những bệnh nhân CS có bằng chứng lâm sàng và CT của một tổn thương do thiếu máu cục bộ có thể được hưởng lợi từ MRI đánh giá sau đó để phân định rõ hơn các nguyên nhân có thể.
MRI có độ nhạy tương tự như CT đối với xuất huyết nội sọ cấp tính, nhưng vượt trội hơn CT trong phát hiện đột quỵ thiếu máu cục bộ. [15]
Các dấu hiệu trên hình ảnh mạch máu
Hình ảnh mạch máu đặc biệt hữu ích để xác định bệnh nhân mắc bệnh xơ vữa động mạch lớn. [15] Một số phương thức có sẵn bao gồm siêu âm, MRA và CTA.[15] Trong khi chụp mạch qua catheter là tiêu chuẩn vàng để chẩn đoán bệnh lý xơ vữa động mạch nội sọ, vì là một thủ thuật xâm lấn có nguy cơ mang lại biến chứng thần kinh (2,5%) và đột quỵ tàn tật (0,1%), nên nó không được sử dụng thường quy. Xét nghiệm hình ảnh tiêu chuẩn có thể không phát hiện được trong các trường hợp đột quỵ do mảng bám trong lòng mạch mà không bị hẹp đáng kể hoặc mảng bám dưới chỗ hẹp bị loét, mặc dù ý nghĩa sau cùng là nguyên nhân gây đột quỵ vẫn được xác nhận. Những bất thường như vậy có thể được phát hiện bởi các chuỗi xung MRI tập trung vào thành mạch chứ không phải là lòng mạch. Chụp MRI cổ với các chuỗi xung xóa mỡ (fat-suppressed sequences) có thể hữu ích trong chẩn đoán bóc tách động mạch cổ, đặc biệt ở những bệnh nhân trẻ tuổi. [15]
Xét nghiệm tim mạch
Siêu âm tim qua thành ngực (TTE) và siêu âm tim qua thực quản (TEE) có lợi ích lâm sàng đáng kể ở những bệnh nhân bị CS, tuy nhiên, việc lựa chọn phương thức siêu âm tim phải tùy từng trường hợp cụ thể (Bảng 2).[18] Đáng chú ý là một nghiên cứu trên bệnh nhân đột quỵ thiếu máu cục bộ với nguyên nhân không rõ (trước khi làm siêu âm tim) đã đánh giá bệnh nhân với cả TTE và TEE.[19]
Khi nguyên nhân đột quỵ chưa được xác định bằng các biện pháp thông thường, cần xem xét TEE để giúp xác định nguyên nhân đột quỵ và hướng dẫn các chiến lược phòng ngừa đột quỵ. [15]
Trong nghiên cứu này, một nguồn gốc tim mạch có khả năng đã được xác định ở 55% bệnh nhân; trong số này, 16% được xác định trên cả TTE và TEE và 39% chỉ được xác định trên TEE.[19] Những dữ liệu này cho thấy TEE có thể vượt trội hơn TTE trong việc xác định hoặc loại trừ nguồn gốc tim mạch của đột quỵ; hơn nữa, họ đề nghị rằng khi chưa xác định được nguyên nhân đột quỵ bằng các biện pháp thông thường, cần xem xét TEE để giúp xác định nguyên nhân đột quỵ và hướng dẫn các chiến lược phòng ngừa đột quỵ.
| Bảng 2. Khi nào TTE hoặc TEE có thể được sử dụng làm xét nghiệm ban đầu? [18] | |
TTE LÀ XÉT NGHIỆN BAN ĐẦU:
|
TEE LÀ XÉT NGHIỆM BAN ĐẦU:
|
Xét nghiệm máu
Glucose máu thường tăng ở những bệnh nhân bị đột quỵ, vì tăng đường huyết có thể gây ra các dấu hiệu và triệu chứng khu trú bắt chước đột quỵ; hơn nữa, tăng đường huyết có liên quan đến các kết cục không thuận lợi.[20] Các nguyên nhân khác của đột quỵ – ví dụ như nhiễm trùng, tự miễn và viêm, là rất hiếm và chỉ nên được xem xét khi xét nghiệm ban đầu không xác định được nguyên nhân.[15] Hơn nữa, xét nghiệm bệnh thrombophilia di truyền ở bệnh nhân CS là rất tốn kém và có hiệu suất chẩn đoán cực kỳ thấp. [21]
Monitoring tim mạch
Các nghiên cứu cho thấy rằng có tới 30% bệnh nhân CS có thể đã có cơn rung nhĩ kịch phát không được phát hiện trước đó,[14] tuy nhiên, vẫn còn nhiều tranh cãi về phương pháp tối ưu để tìm kiếm khả năng rung nhĩ ở bệnh nhân CS. Việc xác định rung nhĩ là rất quan trọng vì rõ ràng là nó sẽ dẫn dắt mô hình quản lý sau đột quỵ.
Trước đây, theo dõi tại bệnh viện và chuỗi ECG là cách duy nhất để phát hiện AF sau đột quỵ. Công nghệ Holter và các công nghệ mới hơn khác sau đó đã cho phép các cuộc kiểm tra mở rộng hơn. Hiện tại, các guidelines khuyến nghị monitoring tim liên tục trong ít nhất 24 giờ đầu sau đột quỵ. [13] Đối với những bệnh nhân bị đột quỵ thiếu máu cục bộ cấp tính hoặc TIA không có nguyên nhân rõ ràng nào khác (ví dụ, đột quỵ không rõ nguồn gốc), guidelines AHA / ACC / HRS 2019 mới nhất về rung nhĩ cho thấy việc sử dụng một thiết bị theo dõi tim bên trong (insertable heart monitor) để đánh giá AF là hợp lý nếu kết quả từ thiết bị theo dõi tim bên ngoài không thuyết phục. [22]
Một phân tích đo tim di động từ xa (MCT: mobile cardiac telemetry) tối đa 30 ngày đã báo cáo rung nhĩ mới hoặc thầm lặng ở khoảng 30% bệnh nhân CS. [23] Nghiên cứu EMBRACE (The 30-Day Cardiac Event Monitor Belt for Recording Atrial Fibrillation After a Cerebral Ischemic Event) theo dõi biến cố tim mạch trong 30 ngày ở 572 bệnh nhân ≥ 55 tuổi bị đột quỵ không rõ nguồn gốc, nhưng không có rung nhĩ trước đó để theo dõi ECG lưu động không xâm lấn bằng một thiết bị ghi ghi lại các biến cố trong 30 ngày hoặc thiết bị theo dõi 24 giờ thông thường. Rung nhĩ kéo dài ≥ 30 giây được phát hiện ở 16,1% ở nhóm can thiệp, so với 3,2% của nhóm đối chứng. [24] Điều quan trọng là những phát hiện này có tác động lớn đến lựa chọn điều trị: Sau 90 ngày, liệu pháp chống đông bằng đường uống đã được chỉ định trong 18,6% ở nhóm can thiệp so với 11,1% ở nhóm đối chứng. [24]
Do tính chất thường không có triệu chứng và tính kịch phát của rung nhĩ, những bệnh nhân bị CS mà không phát hiện thấy rung nhĩ lúc ban đầu có thể cần phải theo dõi lâu dài hơn, điều này có thể không thực tế với các thiết bị mắc bên ngoài cơ thể. Thiết bị theo dõi tim bên trong (ICM : Insertable cardiac monitor) có thể có tiện ích lâm sàng ở những bệnh nhân như vậy. Những nghiên cứu nhỏ về thiết bị ICM ở bệnh nhân bị CS đã chứng minh hiệu suất phát hiện rung nhĩ từ 8,9% đến 33,7%.[24-28]
Thử nghiệm CRYSTAL AF đã đánh giá giá trị của thiết bị ICM trong một thử nghiệm ngẫu nhiên lớn hơn, được thiết kế phù hợp. [14] Nghiên cứu đã chọn ngẫu nhiên 441 bệnh nhân được chẩn đoán CS sau một protocol sàng lọc nghiêm ngặt với việc theo dõi bằng thiết bị ICM hoặc theo dõi thông thường. Sau sáu tháng, rung nhĩ được phát hiện với tỷ lệ 8,9% ở nhánh ICM, so với 1,4% ở nhóm đối chứng (hazard ratio 6,4; 95% CI 1,9 đến 21,7; P < 0,001). Sau 12 tháng, rung nhĩ được phát hiện với tỷ lệ 12,4% ở nhánh ICM so với 2,0% ở nhóm đối chứng (hazard ratio 7,3; 95% CI 2,6 đến 20,8; P < 0,001). Sau 36 tháng, tỷ lệ phát hiện lần lượt là 30,0% so với 3,0%. Ở thời điểm 12 tháng, 97,0% bệnh nhân ở nhánh ICM được phát hiện rung nhĩ đã và đang được dùng thuốc kháng đông đường uống. Những dữ liệu này cho thấy rằng rung nhĩ là phổ biến ở những bệnh nhân CS, và không có gì đáng ngạc nhiên – là một bệnh nhân được theo dõi càng lâu, thì càng có nhiều khả năng rung nhĩ sẽ được phát hiện. [14]
Phát hiện rung nhĩ ẩn giấu (OCCULT AF*)
Khoảng 10% bệnh nhân bị đột quỵ thiếu máu cục bộ cấp tính hoặc TIA sẽ được phát hiện rung nhĩ mới trong khi nằm viện; tuy nhiên, có thể phát hiện thêm 11% rung nhĩ nếu được kiểm tra trong vòng 30 ngày sau khi xuất viện bằng cách theo dõi điện tâm đồ liên tục. Các protocol giám sát dài hơn lên đến sáu tháng đã mang lại tỷ lệ phát hiện tương tự. Trong các bệnh nhân đột quỵ hoặc TIA có chỉ định đặt máy tạo nhịp tim, việc kiểm tra thiết bị này đã xác định tỷ lệ mắc rung nhĩ ẩn giấu là 28% trong một năm. Một tỷ lệ rung nhĩ ẩn giấu tương tự đã được báo cáo ở những bệnh nhân không đột quỵ có nguy cơ cao thông qua các thiết bị tạo nhịp tim được cấy ghép. Rung nhĩ ẩn giấu được phát hiện trong quá trình kiểm tra máy tạo nhịp ở bệnh nhân không bị đột quỵ hoặc dân số hỗn hợp có liên quan đến tăng nguy cơ đột quỵ. [29]
Đối với những bệnh nhân bị đột quỵ thiếu máu cục bộ cấp tính hoặc TIA mà không có nguyên nhân rõ ràng nào khác, việc theo dõi nhịp kéo dài (≈30 ngày) cho rung nhĩ là hợp lý trong vòng 6 tháng kể từ khi xảy ra biến cố (Class IIa; Level of Evidence C).[29] Khuyến cáo này phù hợp với các nghiên cứu được công bố, EMBRACE và CRYSTAL AF. Cả hai đều lưu ý rằng một tỷ lệ đáng kể bệnh nhân bị rung nhĩ ẩn giấu được phát hiện trong vòng 30 ngày theo dõi.
* Các guidelines gần đây của AHA/ACC/HRS khuyến cáo rằng, ở những bệnh nhân bị CS (ví dụ đột quỵ không rõ nguyên nhân) thì việc theo dõi bằng các thiết bị lưu động bên ngoài là không thuyết phục, việc cấy máy theo dõi nhịp tim (loop recorder) là hợp lý để tối ưu hóa việc phát hiện rung nhĩ thầm lặng (Class IIa; Level of Evidence B-R).[22]
Bảng 3 Phác thảo các chiến lược theo dõi có thể và tỷ lệ phần trăm trong việc phát hiện rung nhĩ của từng phương thức.
| Bảng 3. Loại theo dõi và phát hiện rung nhĩ ở những bệnh nhân CS 15 | ||||
| Loại theo dõi | Bối cảnh | Xâm lấn vs. không xâm lấn | Thời gian | Tỷ lệ phát hiện rung nhĩ (%) |
| Admission ECG | Nội trú | Không xâm lấn | N/A | 2.7 |
| Inpatient continuous telemetry | Nội trú | Không xâm lấn | 3–5 ngày | 5.5–7.6 |
| Holter monitor | Ngoại trú | Không xâm lấn | 24 h | 3.2–4.8 |
| 48 h | 6.4 | |||
| 7 ngày | 12.5 | |||
| Mobile continuous outpatient telemetry | Ngoại trú | Không xâm lấn | 21–30 ngày | 16–25 |
| Implantable loop recorders | Ngoại trú | Xâm lấn | 6 tháng | 9 |
| 36 tháng | 30 | |||
Yaghi S, Elkind MS. Cryptogenic stroke: A diagnostic challenge. Neurol Clin Pract. 2014;4:386-393.
Quy trình chẩn đoán sau đột quỵ
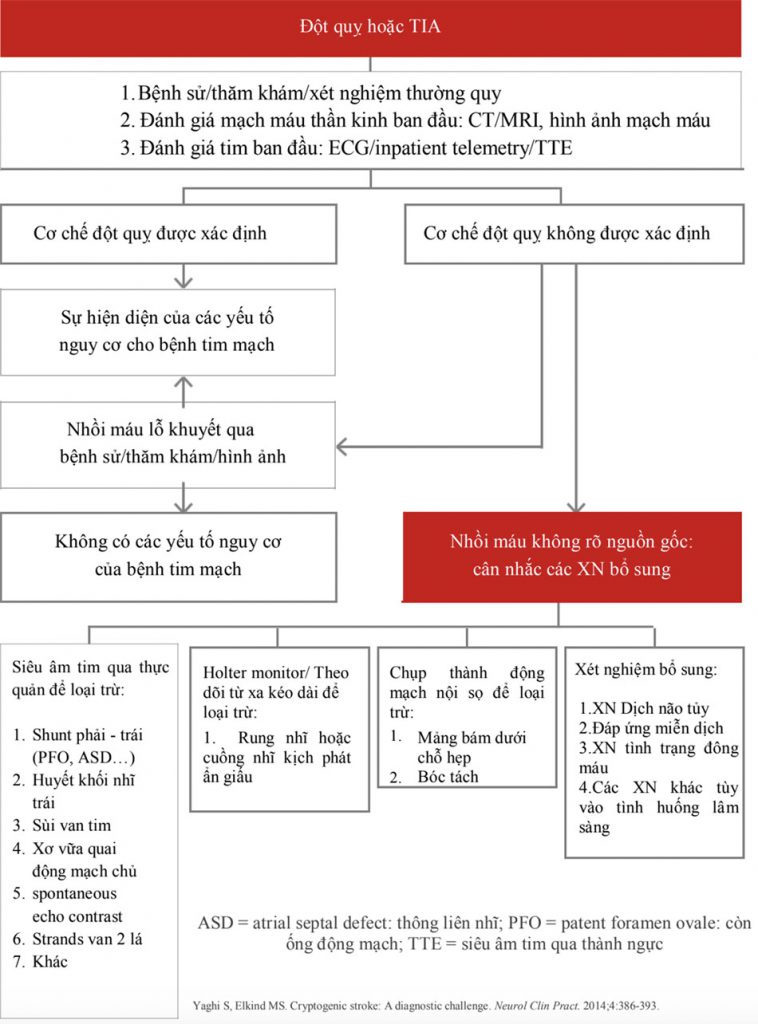
Sơ đồ hiển thị trong Hình 2 cung cấp một ví dụ về một lộ trình tiềm năng để theo dõi chẩn đoán sau đột quỵ. [15]
Những nguyên nhân có thể và khuyến cáo điều trị
Tổn tại lỗ bầu dục (PFO)
PFO được thấy ở 25% người trưởng thành,[2] có liên quan đến sự gia tăng nguy cơ đột quỵ thiếu máu cục bộ không rõ nguồn gốc. Một khiếm khuyết phôi thai, PFO được đặc trưng bởi một lỗ mở thông ở vách ngăn giữa 2 tâm nhĩ; lỗ mở này cung cấp một ống dẫn cho cục máu đông/bóng khí có nguồn gốc từ các tĩnh mạch sâu của chậu hoặc chân lên đến não.
Tỷ lệ mắc PFO đã được chứng minh là cao hơn ở những người trẻ tuổi bị đột quỵ không rõ nguồn gốc. Trong nhóm bệnh nhân này, PFO và huyết khối tĩnh mạch sâu (DVT) đều là những phát hiện đi kèm phổ biến. Hiện tại guidelines AHA/ASA về phòng ngừa đột quỵ hoặc TIA khuyến cáo những điều sau đây (sự thảo luận sâu hơn về tất cả các khuyến cáo trong dự phòng thứ phát có thể được tìm thấy ở Kernan et al [29]):
- Không đủ dữ liệu để xác định liệu thuốc kháng đông là tương đương hay vượt trội so với aspirin trong phòng ngừa đột quỵ thứ phát ở bệnh nhân mắc PFO (Class IIb; Mức độ Bằng chứng B).
- Đối với bệnh nhân bị đột quỵ do thiếu máu cục bộ hoặc TIA và PFO không sử dụng liệu pháp kháng đông, nên điều trị kháng tiểu cầu. (Class I, Mức độ bằng chứng B).
- Đối với bệnh nhân bị đột quỵ thiếu máu cục bộ hoặc TIA và có cả PFO và nguồn thuyên tắc tĩnh mạch, liệu pháp kháng đông được chỉ định, tùy thuộc vào đặc điểm đột quỵ (Class I; Mức độ Bằng chứng A). Khi có chống chỉ định dùng kháng đông, thì đặt bộ lọc tĩnh mạch chủ dưới là hợp lý (Class IIa; Mức độ bằng chứng C).
- Đối với bệnh nhân bị đột quỵ thiếu máu cục bộ hoặc TIA không rõ nguồn gốc và có PFO mà không có bằng chứng về DVT, dữ liệu hiện có không hỗ trợ lợi ích cho việc đóng PFO (Class III; Mức độ Bằng chứng A).
- Trong bối cảnh PFO và DVT, việc đóng PFO bằng thiết bị transcatheter có thể được xem xét, tùy thuộc vào nguy cơ tái phát DVT (Class IIb; Mức độ Bằng chứng C).
Rung nhĩ kịch phát ẩn dấu
Phát hiện rung nhĩ rất quan trọng trong quá trình kiểm tra CS để xác định những bệnh nhân có thể được hưởng lợi từ thuốc kháng đông máu hơn là liệu pháp kháng tiểu cầu. Rung nhĩ kịch phát thường là kịch phát và không có triệu chứng, do đó có thể không được phát hiện bằng theo dõi tim ngắn hạn hoặc trung hạn tiêu chuẩn. [30]
Một số kỹ thuật sẵn có để theo dõi tim mở rộng, bao gồm đo từ xa liên tục (continuous telemetry), điện tâm đồ lưu động, chuỗi ECG nối tiếp, transtelephonic ECG monitoring và thiết bị ICM. Một bài đánh giá đầy đủ về độ nhạy của các phương thức khác nhau để phát hiện rung nhĩ có thể được tìm thấy trong nghiên cứu Glotzer et al, 2015. [23]
Hiện tại, Guidelines AHA/ASA Stroke Prevention in Patients with Stroke or TIA [29] khuyến cáo những điều sau đây cho những bệnh nhân bị rung nhĩ đã biết (một cuộc thảo luận sâu hơn về tất cả các khuyến cáo về phòng ngừa đột quỵ thứ phát có thể được tìm thấy trong nghiên cứu Kernan et al [29]):
- Đối với những bệnh nhân bị đột quỵ thiếu máu cục bộ cấp tính hoặc TIA mà không có nguyên nhân rõ ràng nào khác, việc theo dõi nhịp tim kéo dài (≈30 ngày) cho rung nhĩ là hợp lý trong vòng sáu tháng kể từ khi xảy ra biến cố (Class IIa; Mức độ Bằng chứng C).
- Liệu pháp VKA (Class I; Mức độ Bằng chứng A), apixaban (Class I; Mức độ Bằng chứng A) và dabigatran (Class I; Mức độ Bằng chứng B) đều được chỉ định để phòng ngừa đột quỵ tái phát ở bệnh nhân rung nhĩ không do van tim, cho dù là kịch phát hay vĩnh viễn. Việc lựa chọn một thuốc chống huyết khối nên được cá thể hóa dựa trên các yếu tố nguy cơ, chi phí, khả năng dung nạp, sự ưa thích của bệnh nhân, khả năng tương tác thuốc và các đặc điểm lâm sàng khác, bao gồm chức năng thận và INR trong phạm vi điều trị nếu bệnh nhân đang sử dụng liệu pháp VKA .
- Rivaroxaban là hợp lý để phòng ngừa đột quỵ tái phát ở bệnh nhân rung nhĩ không do van (Class IIa; Mức độ Bằng chứng B).
- Đối với những bệnh nhân bị đột quỵ thiếu máu cục bộ hoặc TIA bị rung nhĩ kịch phát (từng đợt), hoặc rung nhĩ dai dẳng hay vĩnh viễn thì khi bắt đầu điều trị bằng VKA, nên sử dụng chỉ số INR mục tiêu là 2,5 (phạm vi 2.0 – 3.0) (Class I; Mức độ Bằng chứng A).
- Không nên kết hợp thuốc kháng đông đường uống (ví dụ warfarin hoặc một trong những thuốc mới hơn) với liệu pháp kháng tiểu cầu cho tất cả bệnh nhân sau đột quỵ thiếu máu cục bộ hoặc TIA nhưng sẽ là hợp lý ở những bệnh nhân mắc CAD rõ ràng trên lâm sàng, đặc biệt là hội chứng vành cấp hoặc đặt stent (Class IIb; Mức độ bằng chứng C).
- Đối với bệnh nhân đột quỵ thiếu máu cục bộ hoặc TIA kèm rung nhĩ mà không thể dùng thuốc kháng đông đường uống, chỉ nên dùng aspirin đơn độc được khuyến cáo (Class I; Mức độ Bằng chứng A). Việc bổ sung clopidogrel vào liệu pháp aspirin, so với chỉ điều trị bằng aspirin đơn độc, có thể là hợp lý (Class IIb; Mức độ bằng chứng B).
Ngoài ra, bản cập nhật rung nhĩ của AHA 2019 khuyến cáo những điều sau đây cho những người bị rung nhĩ đã biết: [22]
- Ở những bệnh nhân bị CS (ví dụ đột quỵ không rõ nguyên nhân) trong đó việc theo dõi nhịp tim lưu động bên ngoài là không thuyết phục, thì việc cấy máy theo dõi nhịp tim (loop recorder) là hợp lý để tối ưu hóa việc phát hiện rung nhĩ thầm lặng (Class IIa; Mức độ bằng chứng B-R).
- Edoxaban đã được thêm vào danh sách các thuốc kháng đông đường uống non- vitamin K, có thể được sử dụng để phòng ngừa đột quỵ (Class I, Mức độ bằng chứng B-R).
- Bít tiểu nhĩ trái (LAA) bằng dụng cụ có thể được xem xét ở những bệnh nhân bị rung nhĩ có nguy cơ đột quỵ cao, kèm chống chỉ định dùng kháng đông lâu dài (COR IIb, LOE B-NR).
Thrombophilia di truyền
Thrombophilia được định nghĩa là một bệnh có khuynh hướng hình thành cục máu đông không thích hợp, và được đặc trưng bởi sự thiếu hụt và đột biến trong kháng đông nội sinh.[22] Sự thiếu hụt như vậy có thể gây ra đột quỵ không rõ nguồn gốc; Trong số những bệnh nhân không tìm thấy nguyên nhân nào khác, việc sàng lọc bệnh thrombophilia di truyền có thể là đáng giá (xem Hình 2). Guidelines hiện tại của AHA/ASA về đột quỵ khuyến cáo những điều sau đây (thảo luận sâu hơn về tất cả các khuyến cáo trong phòng ngừa thứ phát có thể được tìm thấy trong Kernan et al [29]):
- Lợi ích của việc sàng lọc các tình trạng tăng đông/huyết khối ở bệnh nhân đột quỵ thiếu máu cục bộ hoặc TIA là không rõ (Class IIb; Cấp độ Bằng chứng C).
- Kháng máu có thể được xem xét ở những bệnh nhân được phát hiện có kết quả bất thường về xét nghiệm đông máu sau đột quỵ thiếu máu cục bộ hoặc TIA ban đầu, tùy thuộc vào sự bất thường và bối cảnh lâm sàng (Class IIb; Mức độ bằng chứng C).
- Liệu pháp kháng tiểu cầu được khuyến cáo cho những bệnh nhân được phát hiện có kết quả bất thường về xét nghiệm đông máu sau đột quỵ thiếu máu cục bộ hoặc TIA ban đầu nếu liệu pháp kháng động không được chỉ định (Class I; Mức độ Bằng chứng A).
- Kháng đông lâu dài có thể là hợp lý cho những bệnh nhân huyết khối xoang tĩnh mạch não tự phát hoặc đột quỵ thiếu máu cục bộ tái phát có nguồn gốc không xác định và thrombophilia di truyền (Class IIb; Mức độ bằng chứng C).
Xở vữa quai động mạch chủ
Một số bằng chứng từ các nghiên cứu hồi cứu cho thấy mối liên quan nhân quả giữa bệnh xơ vữa quai động mạch chủ (xơ vữa hoặc mảng bám) và tăng nguy cơ đột quỵ thiếu máu cục bộ. Mảng xơ vữa quai động mạch chủ đã được chứng minh là độc lập với sự gia tăng nguy cơ đột quỵ. Hiện tại guidelines dự phòng đột quỵ của AHA/ASA khuyến cáo những điều sau đây (thảo luận sâu hơn về tất cả các khuyến cao trong phòng ngừa thứ phát có thể được tìm thấy ở Kernan et al [29]):
- Đối với bệnh nhân đột quỵ thiếu máu cục bộ hoặc TIA và có bằng chứng xơ vữa quai động mạch chủ, liệu pháp kháng tiểu cầu được khuyến cáo (Class I; Mức độ bằng chứng A).
- Đối với bệnh nhân đột quỵ thiếu máu cục bộ hoặc TIA và có bằng chứng xơ vữa quai động mạch chủ, liệu pháp statin được khuyến cáo (Cấp I; Mức độ bằng chứng B).
- Đối với bệnh nhân đột quỵ thiếu máu cục bộ hoặc TIA và có bằng chứng xơ vữa quai động mạch chủ, hiệu quả của dùng kháng đông bằng warfarin, so với liệu pháp kháng tiểu cầu là chưa rõ ràng (Cấp IIb; Mức độ bằng chứng C).
- Phẫu thuật cắt bỏ nội mạc quai động mạch chủ cho mục đích phòng ngừa đột quỵ thứ phát không được khuyến cáo (Cấp III; Mức độ bằng chứng C).
Quản lý đột quỵ không rõ nguồn gốc
Điểm cốt lõi của các chiến lược phòng ngừa đột quỵ ở bệnh nhân CS là sự kết hợp giữa liệu pháp kháng tiểu cầu và điều chỉnh các yếu tố nguy cơ của đột quỵ. [31] Các nghiên cứu cho thấy warfarin có thể có lợi hơn aspirin ở một số nhóm nhỏ bệnh nhân CS; tuy nhiên, phát hiện này đã không được nhân rộng trong các thử nghiệm ngẫu nhiên, mù đôi được thiết kế thích hợp. [32] Vì vậy, việc xác định rung ở bệnh nhân CS là rất quan trọng, bởi vì trong quần thể bệnh nhân này, thuốc kháng đông rõ ràng được ưu tiên hơn so với liệu pháp kháng tiểu cầu.
Case studies
Case 1:
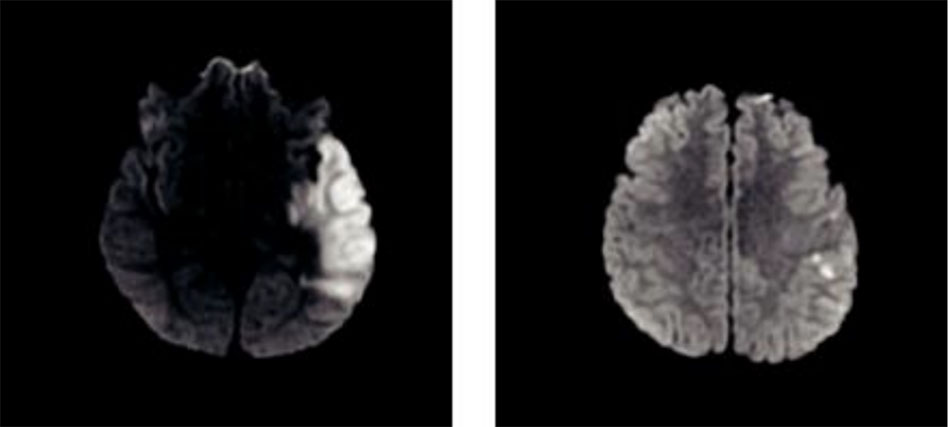
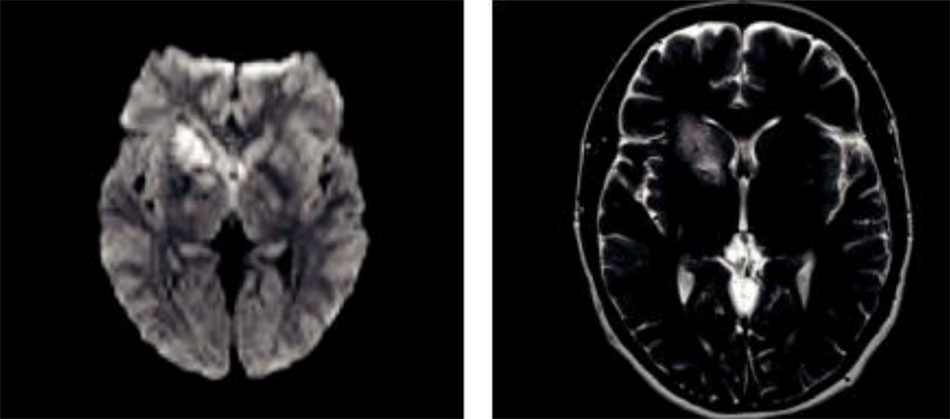
Nhồi máu thái dương trái do tình trạng tăng đông và viêm nội tâm mạc huyết khối không do vi khuẩn Bệnh nhân là một kỹ sư khỏe mạnh 32 tuổi, vào viện vì mất ngôn ngữ và không có khiếm khuyết vận động. Trước đó anh ấy bình thường. Anh bị nhồi máu vùng đỉnh thái dương trái, và thùy đảo (Hình 3). Đánh giá ban đầu, bao gồm siêu âm tim qua thành ngực, không có gì đáng chú ý. Sau khi chuyển đến bệnh viện chuyên khoa, anh ta đã được siêu âm tim qua thực quản, cho thấy một ổ sùi van nhỏ, và hội chứng kháng phospholipid (lupus anticoagulant dương tính, tăng PTT, giảm tiểu cầu, RPR dương tính). Anh đã được điều trị bằng fondaparinux cho tình trạng tăng đông trong bốn năm mà không bị tái phát, sau đó chuyển sang dùng aspirin. Anh không bị biến cố thần kinh cấp tính nào nữa, và trở lại làm việc tốt.
Case study courtesy of Mitchell S. V. Elkind, MD, MS, FAAN, FAHA.
CASE 2: Nhồi máu động mạch não sau bên trái và PFO
Một luật sư 51 tuổi thuận tay phải, trước đây khỏe mạnh, tập thể dục thường xuyên và không dùng thuốc gì. Anh trở về từ một kỳ nghỉ trượt tuyết với gia đình ở ngoại ô, đã lái xe nhiều giờ mà không dừng lại. Sau khi trở về nhà, anh ngồi trên giường cởi giày thì bất chợt cảm thấy lâng lâng và phải đặt tay lên tường để tự ổn định. Tay và chân phải của anh sau đó trở nên yếu, và anh gặp khó khăn khi nói. Anh cũng thấy đau đầu dữ dội và mất tầm nhìn bên phải. Vợ anh gọi 911 và họ đến phòng cấp cứu bệnh viện địa phương.
CT não bình thường. Anh được dùng Alteplase (r-tPA). Siêu âm tim qua thực quản cho thấy tồn tại một lỗ bầu dục nhỏ, còn lại không có gì đáng chú ý. Không có bằng chứng về huyết khối tĩnh mạch sâu, và phần còn lại của đánh giá không có gì đáng chú ý cho một nguồn gốc đột quỵ nào cả. Anh ấy đã hồi phục tốt và có thể trở lại làm việc mà không gặp khó khăn gì.

CASE 3: Đột quỵ không giải thích được với rung nhĩ ẩn giấu mới khởi phát
Một người đàn ông 79 tuổi thuận tay phải đã nghỉ hưu, đã đi chơi golf và sau đó đến phòng xông hơi tại câu lạc bộ sức khỏe của mình. Sau khi rời phòng xông hơi, ông cảm thấy mất định hướng và gặp khó khăn khi mặc quần áo, và sau đó có vẻ hơi lú lẫn với vợ. Ông không bị đau đầu, buồn nôn, rối loạn thị giác, nói khó hay có triệu chứng vận động hoặc cảm giác khu trú nào.
Ông ấy đã có thể đi bộ, và tự lái xe về nhà. Ông ấy đi ăn tối với bạn bè tối hôm đó và có vẻ bình thường. Tuy nhiên, ông chú ý thấy có một số khó khăn với số học, đó là điều bất thường đối với ông. Ông cũng mắc một vài lỗi paraphasic (loạn dùng từ ngữ) theo nghĩa đen (từ ―that hole‖ thay vì ―steam room‖ và ―ring‖ thay vì ―wing‖) Các triệu chứng đã được giải quyết hoàn toàn vào ngày hôm sau. Ông đến văn phòng bác sĩ của mình sau đó hai ngày. MRI cho thấy một nhồi máu cấp tính mới ở thùy thái dương sau bên trái. Siêu âm động mạch cảnh cho thấy động mạch cảnh trong trái hẹp 50-59% và động mạch cảnh trong phải hẹp < 40%. Ông có tiền sử bệnh mạch vành đã đặt stent vài năm trước đó; không có tiền sử rối loạn nhịp. Ông ấy đang dùng một viên aspirin hàng ngày.
Siêu âm tim qua thành ngực cho thấy tâm nhĩ trái giãn vừa phải (5,2 cm). Tâm thất trái phì đại nhẹ. Thử nghiệm saline contrast bubble study âm tính. Theo dõi Holter trong 72 giờ cho thấy không có rung nhĩ. Tuy nhiên, có ngoại tâm thu nhĩ và ngoại tâm thu thất thường xuyên. Thiết bị theo dõi tim mạch ngoại trú di động đã được chỉ định và ba tuần sau ông có một cơn rung nhĩ kéo dài mười phút. Thuốc kháng đông đã được bắt đầu.
CASE 4: Rung nhĩ kịch phát ẩn giấu
Một phụ nữ 51 tuổi có tiền sử tăng huyết áp, xuất hiện 1 đợt dáng đi không ổn định và chóng mặt kéo dài < 1 giờ. Khi nhập viện, huyết áp của bà là 140/86, mạch đều 68 lần/phút và không có khiếm khuyết về thần kinh. Sau khi chụp MRI khẩn cấp, bà được nhập vào ICU để đánh giá thêm. Kết quả ECG như hình Hình 5.
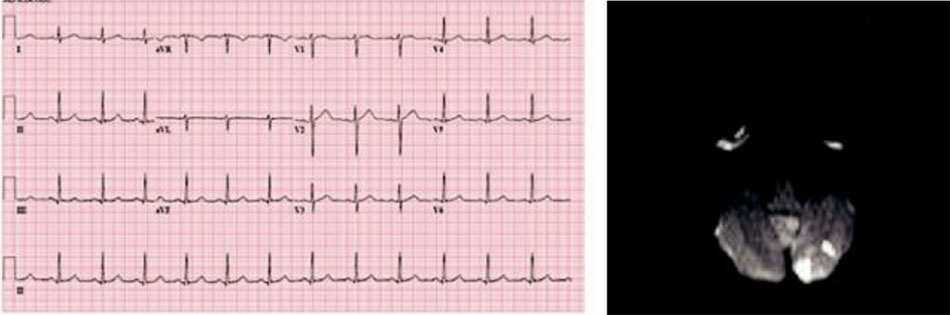
Hai vùng nhồi máu được xác định ở tiểu não trái. MRA đầu và cổ, cũng như X quang ngực, đều có kết quả bình thường. Tương tự, TTE cho thấy kích thước và chức năng LV bình thường. TEE sau đó đã xác nhận những kết quả này, và cũng cho thấy kích thước tâm nhĩ của bà ấy ở giới hạn trên của bình thường. Hơn nữa, TEE cho thấy rằng không có huyết khối và vận tốc (velocities) bình thường trong LAA, quai động mạch chủ bình thường và không có bằng chứng nào cho thấy có tồn tại lỗ bầu dục. Theo dõi từ xa trong 24 giờ không thấy rối loạn nhịp tim.
Bệnh nhân được xuất viện với clopidogrel 75 mg/ngày và được theo dõi thêm 14 ngày với thiết bị theo dõi tim di động từ xa. Không có rối loạn nhịp tim nào được xác định trong giai đoạn này.
Năm tuần sau lần đột quỵ ban đầu, tình trạng mất vững và chóng mặt của bà tái phát. Bà cũng bị đau đầu bên phải với buồn nôn và nôn mửa. Những triệu chứng này kéo dài hai giờ. Bệnh nhân được nhập ICU sau khi chụp MRI não khẩn cấp.
MRI thứ hai cho thấy một vùng nhồi máu mới ở thể vân (corpus striatum infarct) bên phải từ 3 đến 4 cm kèm xuất huyết bên trong. Có hiệu ứng khối nhẹ ở sừng trước của não thất bên bên phải.
Bệnh nhân được đánh giá mở rộng hơn, bao gồm cả kiểm tra về khả năng tăng đông, chúng âm tính. Sau đó, bà đã được cấy ghép ICM và được xuất viện với clopidogrel và aspirin. Sau hai tháng theo dõi, các cơn rung nhĩ kịch phát kéo dài 15 đến 90 phút đã được phát hiện. Các cơn này không có triệu chứng mặc dù nhịp thất trung bình vượt quá 120 lần/phút. Bệnh nhân sau đó đã được kê đơn thuốc kháng đông đường uống.
Kết luận
Như đã thảo luận ở đây, CS chỉ đơn giản là chẩn đoán loại trừ. Thể đột quỵ này hiện đang chiếm tỷ lệ nhiều như đột quỵ do xơ vữa mạch máu lớn, tỷ lệ này sẽ giảm dần theo thời gian khi các phương thức chẩn đoán tiên tiến trở nên phổ biến hơn trong thực hành lâm sàng và khi các công nghệ mới ra đời.
Hiện nay, hầu hết bệnh nhân được dùng thuốc kháng tiểu cầu cùng với điều chỉnh yếu tố nguy cơ đột quỵ; tuy nhiên, rõ ràng từ các nghiên cứu theo dõi dài hạn ở những bệnh nhân CS cho thấy từ một phần năm đến một phần ba số bệnh nhân này bị rung nhĩ kịch phát và có nguy cơ bị đột quỵ do thuyên tắc từ tim, bất kể nguyên nhân của lần đột quỵ đầu tiên. Những bệnh nhân như vậy có thể sẽ được lợi nhiều hơn với điều trị bằng một thuốc kháng đông nào đó. Việc phân biệt rõ hơn các nguyên nhân của CS có ý nghĩa sâu sắc về mặt phòng ngừa đột quỵ thứ phát và kết cục của bệnh nhân.
Tài liệu tham khảo





![[Cảnh báo] Để cải thiện thiếu máu não nên ăn gì? Kiêng ăn gì? Thiếu máu não nên ăn gì?](https://www.healcentral.org/wp-content/uploads/2020/11/thieu_mau_nao_nen_an_gi1-218x150.jpg)

