Bài viết Đối mặt với COVID-19 trong ICU: rối loạn chức năng mạch máu, huyết khối và rối loạn điều hòa viêm nhiễm được dịch từ bài gốc Facing COVID-19 in the ICU: vascular dysfunction, thrombosis, and dysregulated inflammation bởi Thạc sĩ – Bác sĩ Hồ Hoàng Kim – ICU bệnh viện Nguyễn Tri Phương.
Các hướng dẫn quản lý hiện tại đối với COVID-19 phản ánh giả định rằng các bệnh nhân bị bệnh nghiêm trọng bị nhiễm SARS-CoV-2 phát triển hội chứng suy hô hấp cấp tính (ARDS). Tuy nhiên, dữ liệu mới nổi và các báo cáo lâm sàng ngày càng cho thấy một quan điểm khác rằng COVID-19 nghiêm trọng phản ánh sự hợp lưu của rối loạn chức năng mạch máu, huyết khối và rối loạn điều hòa viêm nhiễm.
COVID ‐ 19 nặng khác biệt với ARDS và hội chứng giải phóng cytokine
Dữ liệu được công bố [1, 2], quan sát giai thoại và thảo luận với các đồng nghiệp trên toàn thế giới chỉ ra rằng kiểu hình hô hấp COVID khác biệt với ARDS điển hình theo nhiều cách [2]. Bệnh nhân COVID-19 bị thiếu oxy máu nặng nề trong giai đoạn bệnh sớm. Tuy nhiên, rối loạn chức năng hô hấp quá mức ở những giai đoạn đầu này là bất thường. Sự tuân thủ -compliance phổi ở bệnh nhân COVID19 đặt nội khí quản dường như chỉ giảm ở mức độ vừa phải, và do đó bệnh nhân tương đối dễ thở [1]. Gattinoni et al. [1] mô tả hiện tượng tăng tưới máu của phổi thông khí kém, có lẽ do giãn mạch và mất khả năng co mạch máu do thiếu oxy. Mặc dù lợi ích từ mức PEEP trung bình thấp và thông khí nằm sấp đã được ghi nhận, các tác giả này cho rằng họ có kết quả nhiều hơn từ các hiệu ứng huyết động học so với huy động phổi [1]. Giai đoạn sau đó trong quá trình COVID-19, một số bệnh nhân phát triển kiểu hình phù hợp hơn với ARDS [1, 2].
Đáp ứng viêm được báo cáo trong COVID19 cũng không phù hợp với ARDS hoặc hội chứng giải phóng cytokine điển hình (CRS) hoặc cơn bão cytokine. Qin và cộng sự. [3] báo cáo mức trung bình interleukin-6 là 25 (SD: 10 – 55) pg / mL (phạm vi bình thường: 7 pg / mL). Các báo cáo COVID-19 nhỏ hơn khác đã cho thấy dao động từ 7 đến 125 pg / mL. Những phát hiện này tương phản với nồng độ cao interleukin-6 được thấy trong ARDS điển hình và trong CRS. Sinha et al. báo cáo trung bình mức interleukin-6 là 282 (111 – 600) pg / mL trong ARDS có “đáp ứng viêm thấp” [9] và 1618 (517 – 3205) pg / mL trong ARDS “đáp ứng viêm cao” [4], cao gấp 10 đến 60 lần so với báo cáo trong dữ liệu Vũ Hán. Trong số các bệnh nhân CRS, nồng độ interleukin-6 trung bình thường cao tới 10.000 pg / mL [5]. Các cytokine gây viêm khác (ví dụ, interleukin-8, interleukin-1β) thể hiện các mẫu tương tự. Tóm lại, COVID- 19 chỉ liên quan đến việc tăng cytokine gây viêm nhẹ và chứng minh sinh lý và miễn dịch khó thuyết phục với ARDS hoặc CRS. Do đó, một cơ chế thay thế cho bệnh dường như có khả năng.
Bệnh lý mạch máu và rối loạn điều hòa viêm trong COVID ‐ 19
Sự kết hợp giữa sinh lý học quan sát và các bằng chứng bệnh lý mới nổi đối với quá trình bệnh mạch máu là yếu tố góp phần trong sinh bệnh học COVID-19. Nối tắt trong phổi với giãn mạch mạnh và rối loạn chức năng nội mô nặng nề. Quan sát cho thấy 89% bệnh nhân nhập viện ở Rome cho thấy sự mở rộng mạch máu dưới da khi chụp cắt lớp vi tính lúc nhập viện ủng hộ cho quan điểm này [6]. Các báo cáo về khoảng chết hô hấp tăng cho thấy huyết khối mạch máu phổi do bệnh lý vi mạch huyết khối hoặc tắc mạch phổi. Loại sau (tắc mạch phổi) gần đây đã được báo cáo ở 40% bệnh nhân COVID nhập viện [19]. Khám nghiệm tử thi trên những bệnh nhân tử vong sớm thực sự đáng chú ý vì sung huyết mạch máu phổi [8]. Bệnh mạch máu cũng có thể giải thích cho nồng độ cao D-dimer lớn, trong khi kháng thể kháng phospholipid gần đây cũng đã được báo cáo trong COVID-19 [9]. Một chòm sao có sự tham gia của nhiều cơ quan, mức độ đáp ứng viêm thấp, giảm bạch cầu dòng lympho, tăng đông máu và rối loạn chức năng vi mạch không đồng nhất là một mô tả kinh điển của nhiều bệnh mạch máu toàn thân, chẳng hạn như vasculitides (Bảng bổ trợ).
Các phát hiện được báo cáo chỉ ra rằng ức chế miễn dịch, kích hoạt nội mô và tổn thương mô trực tiếp qua trung gian virus, thay vì tổn thương do viêm, gây ra rối loạn chức năng cơ quan do COVID. Ví dụ, một nghiên cứu khám nghiệm tử thiết gần đây cho thấy không có viêm mạch máu thận hoặc viêm kẽ, nhưng lưu ý kích hoạt nội mô, hoại tử thường xuyên và virion đa dạng trong mô thận [10]. Nếu nhiễm trùng trực tiếp gây tổn thương, mô mạch máu được mong đợi sẽ khá nhạy cảm vì nó biểu hiện cao enzyme chuyển đổi angiotensin-2 (ACE-2), rất cần thiết cho sự hấp thu của coronavirus.
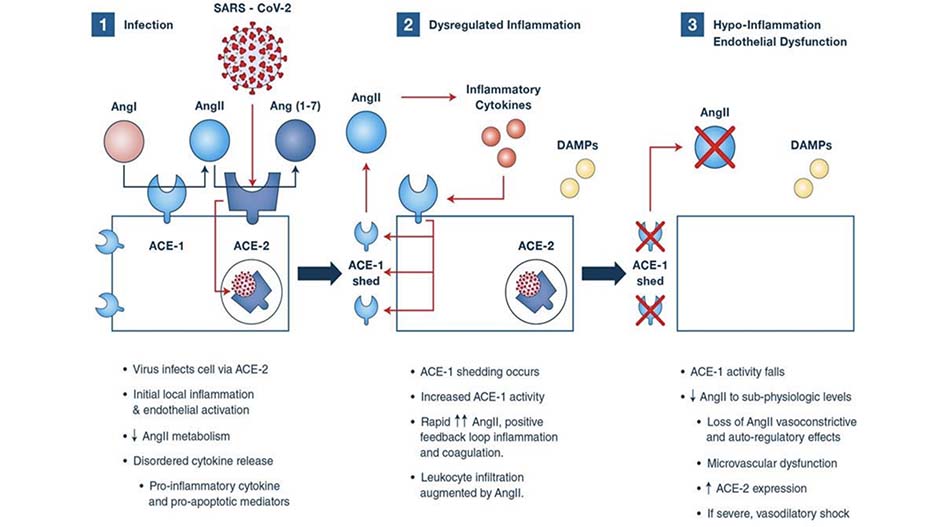
SARS-CoV-2 bắt đầu nhiễm trùng tế bào bằng cách gắn ACE-2 trên bề mặt tế bào người, bao gồm cả tế bào nội mô (Hình 1) [11]. Kết dính thúc đẩy tín hiệu paracrine cytokine rối loạn, bao gồm cả các phân tử tiền và chống viêm, và các chất trung gian tiền-chết theo chương trình [12]. Huy động tế bào lympho qua trung gian hóa hướng động và nhiễm trùng tế bào lympho sau đó, cũng biểu hiện ACE-2, có khả năng góp phần gây ra chết theo chương trình tế bào lympho, giết chết tự nhiên và ức chế tế bào B, và cạn kiệt tế bào T, như Qin et al đã nhận ra. [3]. Những phát hiện này phù hợp với giảm bạch cầu trên lâm sàng, tương quan với tỷ lệ tử vong [3]. Tổn thương do virus, giải phóng cytokine bị rối loạn và các kiểu hình phân tử liên quan đến tổn thương (DAMPs) gây ra viêm vi mạch máu cục bộ, gây ra kích hoạt nội mô, dẫn đến tình trạng giãn mạch và tiền huyết khối.
| Bảng bổ sung – So sánh COVID-19 với Bệnh mạch máu hệ thống | ||
| Đặc điểm | Các dấu chứng thường gặp bệnh mạch máu | CoViD-19 nặng |
| Yếu tố nhiễm trùng khỏi phát | Nhiều virus được biết: Hepatitis B/C, Varicella, HIV, Epstein-Barr Virus, Cytomegalovirus, SARS-CoV-1 | SARS-CoV-2 |
| Phổi | Viêm mạch máu | Viêm phổi tổ chức hóa, thường viêm xung quanh mạch máu nhất |
| Các cơ quan được báo cáo | TM, thần kinh, tiêu hóa, thận, cơ xương khớp | Bệnh cơ tim, thận, dạ dày ruột.
Mất ngủ, sảng. |
| Các biến cố huyết khối | Bao gồm động mạch/tĩnh mạch. (Thay đổi bởi các bệnh đặc biệt). | Tăng rất cao D-dimer tương quan với tử vong.
DVT, thuyên tắc phổi, huyết khối catheter |
| Viêm hệ thống | Tăng nhẹ các cytokine viêm.
(IL-6 nhìn chung < 100). Chất phản ứng trong pha cấp: CRP cao, ESR, Ferritin. Albumin thấp. |
Tăng nhẹ các cytokine viêm.
(IL-6 nhìn chung < 100). Chất phản ứng trong pha cấp: CRP cao, ESR, Ferritin. Albumin, PCT thấp. |
Abbreviations: HIV – Human immunodeficiency virus; CRP – C-reactive protein; ESR – erythrocyte sedimentation rate; PCT – procalcitonin; ECMO – extra-corporeal membrane oxygenation; DVT – deep venous thrombosis.
Angiotensin-II (AngII) được chuyển hóa chủ yếu bởi ACE-2 nội mô thành peptide giãn mạch và kháng viêm angiotensin (1 – 7). Trong giai đoạn đầu của nhiễm trùng, tiêu thụ ACE- 2 bằng cách xâm nhập của virus sẽ được dự đoán sẽ làm tăng nồng độ AngII cục bộ. Trong số các tác dụng được biết đến của AngII là gây co mạch, kích hoạt nội mô và giải phóng cytokine tiền viêm. Kích hoạt tiểu cầu bởi AngII có thể tăng cường hơn nữa một môi trường tiền huyết khối. AngII cũng có tác dụng hóa học mạnh có thể đẩy nhanh quá trình huy động và ức chế tế bào lympho. Điều quan trọng là, nồng độ AngII lúc nhập viện ở bệnh nhân COVID-19 được báo cáo là gấp đôi so với mức bình thường [13]. Ngoài ra, viêm mạch máu phổi đặc biệt dẫn đến một hiện tượng được gọi là “ACE-1 shedding”, nơi mà ACE-1 liên kết bề mặt nội mô được giải phóng vào kẽ [14]. Hiện tượng này ban đầu tạo ra sự gia tăng mạnh ở AngII cục bộ, sau đó giảm dần cho đến khi nồng độ thấp hơn mức sinh lý [14]. Bởi vì AngII điều chỉnh xuống biểu hiện ACE-2, quá trình chuyển sang trạng thái thiếu AngII phù hợp với biểu hiện tăng ACE-2 được ghi nhận khi khám nghiệm tử thi [10]. Đáng chú ý, AngII báo cáo làm tăng tính thấm của vi mạch trong điều kiện cơ bản nhưng làm giảm tính thấm trong quá trình viêm, một tác động góp phần sự thay đổi gây ra do viêm từ biểu hiện thụ thể loại 1 sang loại 2 [15].
Ý nghĩa của việc trị liệu và nghiên cứu
Quy định rằng COVID-19 là một bệnh về mạch máu và “đáp ứng viêm thấp” có ý nghĩa quan trọng đối với nghiên cứu đang diễn ra. Tuy nhiên, cần có thêm bằng chứng để khám phá tổn thương mạch máu thông qua dấu ấn sinh học, hình ảnh và mô học. Nếu COVID-19 thực sự chủ yếu là một rối loạn mạch máu, thông khí cơ học xâm lấn sớm nên được bắt đầu thận trọng. Các cuộc điều tra nên xem xét tác động của các chiến lược thở máy xâm lấn tự do và hạn chế.
Chúng tôi xin nhắc lại rằng không có bằng chứng nào cho thấy bệnh nhân COVID-19 phát triển cơn bão cytokine. Phát hiện này cho thấy rằng việc sử dụng các tác nhân phong tỏa cytokine sẽ gặp phải sự hoài nghi trong trường hợp không có bằng chứng ngẫu nhiên. Tuy nhiên, thuốc chống đông máu nên là ưu tiên chính để điều tra. Tương tự, với vai trò giả định của thiếu AngII, một thử nghiệm ngẫu nhiên về điều trị angiotensin-II ở bệnh nhân COVID-19 đã tiến triển thành sốc cần được báo động. Tiến triển bệnh cũng có thể là một công cụ điều chỉnh hiệu ứng, với các lợi ích tiềm năng của việc chống viêm và phong tỏa angiotensin sớm hơn trong bệnh nặng và gây hại ở những thời điểm sau.
Kết luận
Suy hô hấp do COVID liên quan đến các kiểu hình sinh lý, lâm sàng và miễn dịch không phù hợp với các hội chứng ARDS hoặc hội chứng giải phóng cytokine. COVID-19 thay vào đó một phản ánh ức chế miễn dịch và các tính năng tương thích với bệnh mạch máu.
Tài liệu tham khảo






