Bài viết Đái tháo đường thai kỳ: Các vấn đề sản khoa và quản lý được biên dịch bởi Bs Vũ Tài từ sách “Đái tháo đường thai kỳ: Các vấn đề sản khoa và quản lý ” của tác giả Aaron B Caughey, MD, PhD.
1.GIỚI THIỆU
Các hướng dẫn đều khuyến cáo sàng lọc đái tháo đường thai kỳ cho thai phụ khi thai được 24 đến 28 tuần. Ngày càng có nhiều bệnh nhân được chẩn đoán mắc bệnh đái tháo đường thai kỳ (GDM), cùng với dịch bệnh béo phì. (See “Diabetes mellitus ìn pregnancy: Screening and diagnosis”.)
Bác sĩ lâm sàng chăm sóc thai phụ bị GDM phải hiểu biết về hậu quả của rối loạn này đối với mẹ và thai nhi (ví dụ, tăng nguy cơ tiền sản giật và thai to), quản lý tăng đường huyết, theo dõi thai kỳ, quản lý các biến chứng thai kỳ, chăm sóc hậu sản và theo dõi lâu dài. Chủ đề này sẽ thảo luận hầu hết các vấn đề này, nhưng kiểm soát đường huyết được xem xét chi tiết ở chủ đề riêng:
• (See “Gestational diabetes mellỉtus. Glycemic control and maternal prognosis”.)
• (See “Pregestational (preexisting) and gestational diabetes: Intrapartum and postpartum glycemic control”.)
2.HẬU QUẢ CỦA GDM
Ngoài các vấn đề thai kỳ thông thường, chăm sóc trước sinh các bệnh nhân bị GDM tập trung vào việc xác định và quản lý các tình trạng gia tăng ở thai phụ bị rối loạn glucose. Ngược lại với thai phụ bị đái tháo đường tiền thai kỳ, thai phụ bị GDM thực sự không gia tăng nguy cơ sinh con bị dị tật bẩm sinh vì khởi phát của rối loạn là sau quá trình hình thành cơ quan và họ không có biểu hiện bệnh mạch máu liên quan đến đái tháo đường do thời gian bị rối loạn ngắn. Tuy nhiên, điều quan trọng cần lưu ý là một số thai phụ được chẩn đoán GDM thực sự lại bị đái tháo đường không được phát hiện từ trước nếu họ không được sàng lọc trước hoặc sớm trong thai kỳ.
2.1.Hậu quả ngắn hạn
Các biến chứng của thai kỳ phổ biến hơn trong GDM bao gồm:
• Trẻ lớn so với tuổi thai (LGA) và thai to – LGA (thường được định nghĩa là cân nặng của thai nhi hoặc trẻ sơ sinh > bách phân vị thứ 95 so với tuổi thai) và thai to (thường được định nghĩa là cân nặng khi > 4500 gram) là những kết cục sơ sinh bất lợi phổ biến nhất liên quan đến GDM.
Cả GDM và béo phì đều có liên quan đến việc gia tăng nguy cơ LGA. Trong một báo cáo, tỷ lệ hiện mắc LGA ở thai phụ bị GDM có cân nặng bình thường so với béo phì lần lượt là 13,6 và 22,3%; những con số này cao hơn gần gấp đôi so với những thai phụ không bị GDM có cân nặng bình thường so với béo phì: lần lượt là 7,7% và 12,7% . Mặc dù mang tính minh họa, bởi còn có các yếu tố khác ngoài cân nặng của mẹ ảnh hưởng đến cân nặng khi sinh của trẻ. Các thử nghiệm ngẫu nhiên đều chứng minh rằng tăng đường huyết mẹ làm gia táng đáng kể khả năng sinh con LGA hoặc trẻ sơ sinh to và mẹ tăng cân quá mức khi mang thai (> 40 pound [18 kg]) làm tăng gấp đôi nguy cơ [ 6], Tăng đường huyết mẹ làm tăng nguy cơ LGA và trẻ to vì nó dẫn đến tăng vận chuyển glucose và các chất dinh dưỡng khác qua nhau thai, gây cường insulin ở thai nhi và do đó, gia tăng tốc độ tăng trưởng của thai nhi bất đối xứng (kích thước đầu bình thường nhưng vai rộng hơn và tăng đường kính ngực và bụng so với trẻ của các bà mẹ không bị đái tháo đường). Một nghiên cứu thuần tập tiến cứu quan sát thấy rằng gia tăng tốc độ tăng trưởng của thai nhi, có thể bắt đầu sớm nhất là 20 đến 28 tuần tuổi thai.
Thai to và bất đối xứng thân thai nhi có liên quan đến tăng nguy cơ sinh phẫu thuật (mổ lấy thai hoặc sinh ngả âm đạo dưới sự hỗ trợ của dụng cụ) và các kết cục bất lợi đối với trẻ sơ sinh, như đẻ khó do kẹt vai và các biến chứng liên quan của nó: tổn thương đám rối thần kinh cánh tay, gãy xương và trầm cảm ở trẻ sơ sinh [ 8-15 ]. (See “Fetal macrosomia” and “Shoulder dystocia: Risk factors and planning delivery of high-risk pregnancies” and “Large for gestational age newborn”.)
• Tiền sản giật và tăng huyết áp thai kỳ – Bệnh nhân bị GDM có nguy cơ phát triển tiền sản giật và tăng huyết áp thai kỳ cao hơn so với bệnh nhân không bị GDM. Kháng insulin là nguyên nhân gây GDM và dường như cũng có liên quan đến sự phát triển tiền sản giật và tăng huyết áp thai kỳ, nó có thể giải thích cho mối liên quan này. (See “Preeclampsia: Clinical features and diagnosis” and “Gestational hypertension”.)
• Đa ối – Đa ối phổ biến hơn ở bệnh nhân bị GDM. Cãn nguyên của GDM là không rõ ràng, mặc dù một phần đóng góp từ đa niệu thai nhi thứ phát do táng đường huyết thai nhi đã được đề xuất. Ảnh hưởng của nó trên thai kỳ bị GDM so với thai kỳ không bị GDM cũng không chắc chắn. Hai nghiên cứu báo cáo đa ối liên quan đến GDM không làm tăng đáng kể tỷ lệ bệnh tật hoặc tử vong chu sinh, trong khi một nghiên cứu thứ ba báo cáo nguy cơ thai chết lưu tăng rõ rệt ở tất cả các thai kỳ bất thường với đa ối, cho dù những thai kỳ này có bị phức tạp bởi GDM hay là không. (See “Polyhydramnios: Etiology, diagnosis, and management”.)
• Thai chết lưu – Bệnh nhân bị GDM và kiểm soát đường huyết dưới mức tối ưu dường như gia tăng nguy cơ thai chết lưu so với quần thể sản khoa nói chung. Nguy cơ thai chết lưu dường như không tăng ở những bệnh nhân kiểm soát đường huyết tốt, mặc dù việc xác định kiểm soát tốt có thể là một thách thức.
• Bệnh tật ở trẻ sơ sinh – Trẻ sơ sinh của những thai kỳ bị phức tạp bởi GDM đã được báo cáo là gia tăng nguy cơ mắc nhiều bệnh, thường thoáng qua, bao gồm hạ đường huyết, tăng bilirubin máu, hạ calci huyết, hạ magie máu, đa hồng cầu, suy hô hấp và / hoặc bệnh cơ tim. Những nguy cơ này phần lớn liên quan đến tình trạng tăng đường huyết của mẹ.
Trái ngược với các nghiên cứu lịch sử, một phân tích thứ cấp dữ liệu từ thử nghiệm Antenatal Late Preterm Steroids (ALPS) cho thấy GDM không liên quan đến sự khác biệt có ý nghĩa lâm sàng về kết cục hô hấp ở trẻ sơ sinh; tuy nhiên, không có thông tin về việc kiểm soát đường huyết và điều trị đái tháo đường của từng người tham gia. Kiểm soát đường huyết tốt có thể làm giảm nguy cơ mắc các vấn đề hô hấp ở trẻ sơ sinh của bệnh nhân bị GDM. Những khác biệt cơ bản giữa bệnh nhân bị GDM so với những người không bị GDM trong nghiên cứu này cũng có thể giải thích cho các phát hiện. (See “Infants of women with diabetes”.)
2.2.Hậu quả lâu dài
Các nguy cơ liên quan đến GDM kéo dài vượt ra ngoài thời kỳ mang thai và sơ sinh.
• GDM là một dấu ấn mạnh cho sự phát triển đái tháo đường type 2 ở mẹ, bao gồm cả bệnh mạch máu liên quan đến đái tháo đường. (See “Gestational diabetes mellitus: Glycemic control and maternal prognosis”, section on ‘Long-term risk’.)
• GDM làm tăng nguy cơ phát triển béo phì, rối loạn dung nạp glucose và bệnh đái tháo đường ở con cái. Bệnh đái tháo đường của mẹ được kiểm soát kém trong thai kỳ có thể ảnh hưởng đến kết cục phát triển thần kinh; tuy nhiên, bằng chứng chỉ mang tính suy diễn và có chất lượng kém. (See “Infants of women with diabetes”, section on ‘Long-term outcome’.)
3.QUẢN LÝ THAI KỲ
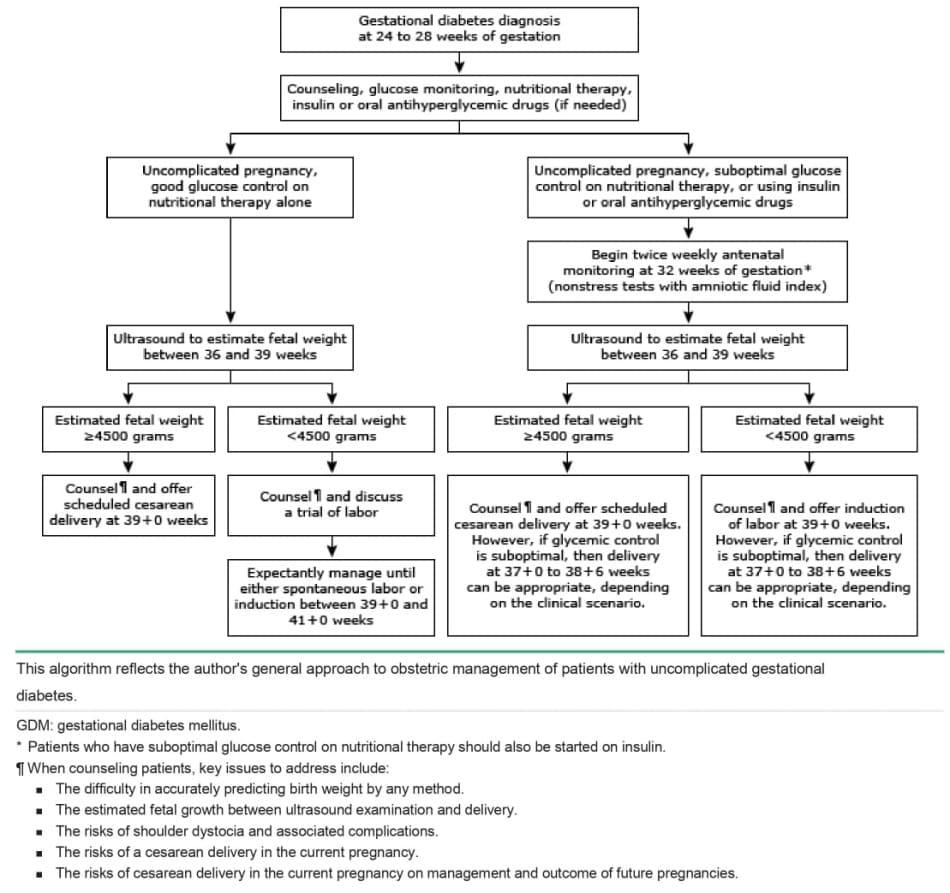
Duy trì kiểm soát đường huyết tốt là biện pháp can thiệp quan trọng để giảm tần suất và / hoặc mức độ nặng của các biến chứng liên quan đến GDM. Cách tiếp cận chung của tác giả để quản lý thai kỳ trong GDM được thể hiện trong lưu đồ (ife algorithm 1).
Theo dõi và kiểm soát glucose – Kiểm soát đường huyết là nền tảng quản lý bất kỳ thai kỳ đái tháo đường nào. Theo dõi đường huyết, liệu pháp dinh dưỡng y tế, tập luyện thể chất và sử dụng insulin và thuốc hạ đường huyết được thảo luận chi tiết ở chủ đề riêng. Tóm lại, mục tiêu đường huyết trước sinh là:
• Nồng độ đường huyết lúc đói: < 95 mg/dL (5,3 mmol/L)
• Nồng độ đường huyết sau ăn một giờ: <140 mg/dL (7,8 mmol/L)
• Nồng độ đường sau ăn hai giờ: <120 mg/dL (6,7 mmol/L)
Không có tiêu chuẩn mẫu để mô tả kiểm soát đường huyết dưới mức tối ưu và kém. Chúng tôi coi giá trị đường huyết cao hơn 20 đến 30% trong khoảng mục tiêu là dưới mức tối ưu. (See “Gestational diabetes mellitus: Glycemic control and maternal prognosis”.)
Giám sát thai nhi
A1 GDM với kiểm soát đường huyết tốt – Những thai phụ có đường huyết bình thường với liệu pháp dinh dưỡng đơn thuần (ví dụ, GDM loại A1) và không có biến chứng thai kỳ nào khác (ví dụ: không có thai to, tiền sản giật, chậm tăng trưởng, đa ối hoặc thiểu ối) dường như không làm tăng nguy cơ thai chết lưu [ 36 ]; do đó, bỏ qua việc giám sát thai nhi trước sinh (tests nonstress [NST] và chỉ số ối, trắc đồ sinh vật lý [BPP]) là một cách tiếp cận hợp lý cho những thai phụ này, nhưng các mô hình thực hành khác nhau tùy theo phạm vi dữ liệu hiện có về vấn đề này.
American College of Obstetricians and Gynecologists (ACOG) đã đề xuất đánh giá thai nhi trước sinh bắt đầu từ tuần thai thứ 32 đối với thai phụ bị GDM và kiểm soát đường huyết dưới mức tối ưu bằng liệu pháp dinh dưỡng. Không có khuyến cáo cụ thể nào được đưa ra để đánh giá thai nhi ở những bệnh nhân có mức đường huyết được kiểm soát tốt bằng liệu pháp dinh dưỡng, ngoại trừ đánh giá thể tích nước ối; quyết định này được để lại cho các mô hình thực hành tại chỗ.
Nếu bác sĩ lựa chọn chỉ định NST hoặc BPP, các test có thể được bắt đầu lúc thai gần đủ tháng hơn là 32 tuần (ví dụ: 36 tuần) vì không có sự gia tăng nguy cơ thai chết lưu nào được chứng minh trong quần thể này.
A2 GDM hoặc A1 GDM với kiểm soát đường huyết dưới mức tối ưu – Chúng tôi thực hiện NSTs hai lần mỗi tuần cộng với chỉ số ối bắt đầu từ tuần thứ 32 của thai kỳ ở những thai phụ cần insulin hoặc thuốc hạ đường huyết đường uống để đạt được trạng thái kiểm soát đường huyết tốt và ở tất cả thai phụ kiểm soát đường huyết dưới mức tối ưu (sfo algorithm 1). Lý tưởng nhất là những thai phụ kiểm soát đường huyết dưới mức tối ưu sẽ được kiểm soát tốt hơn bằng chế độ ăn uống và / hoặc thuốc. (See “Overview of antepartum fetal surveillance”.)
Bằng chứng ủng hộ test thai nhi trước sinh ở những thai kỳ bị phức tạp bởi GDM chủ yếu bao gồm dữ liệu từ các chuỗi quan sát báo cáo không có hoặc hiếm gặp trường hợp mất thai trong một nhóm thai kỳ được theo dõi bằng các phác đồ test trước sinh khác nhau [ 38,39 ]. Không có thử nghiệm ngẫu nhiên nào đánh giá việc quản lý sản khoa trước sinh ở thai phụ bị GDM, đặc biệt, và các phát hiện từ một số lượng nhỏ các nghiên cứu thuần tập và bệnh chứng không thể đưa ra kết luận.
Mô hình thực hành đã phát triển trong nhiều thập kỷ sử dụng test thai nhi dựa trên cơ sở (1) mức độ nặng của GDM (tức là liệu đã đạt được trạng thái đường huyết bình thường hay chưa và đạt được bằng liệu pháp dinh dưỡng hay liệu pháp dùng thuốc) và (2) sự hiện diện của các yếu tố nguy cơ khác đối với kết cục thai kỳ bất lợi (ví dụ tuổi mẹ cao, tiền sử thai chết lưu, có các bệnh đi kèm như tăng huyết áp mạn tính).
Thời điểm để bắt đầu test trong tam cá nguyệt thứ ba, tần suất test và các test được sử dụng (ví dụ: NST, BPP) thay đổi tùy theo bệnh viện và cơ sở thực hành.
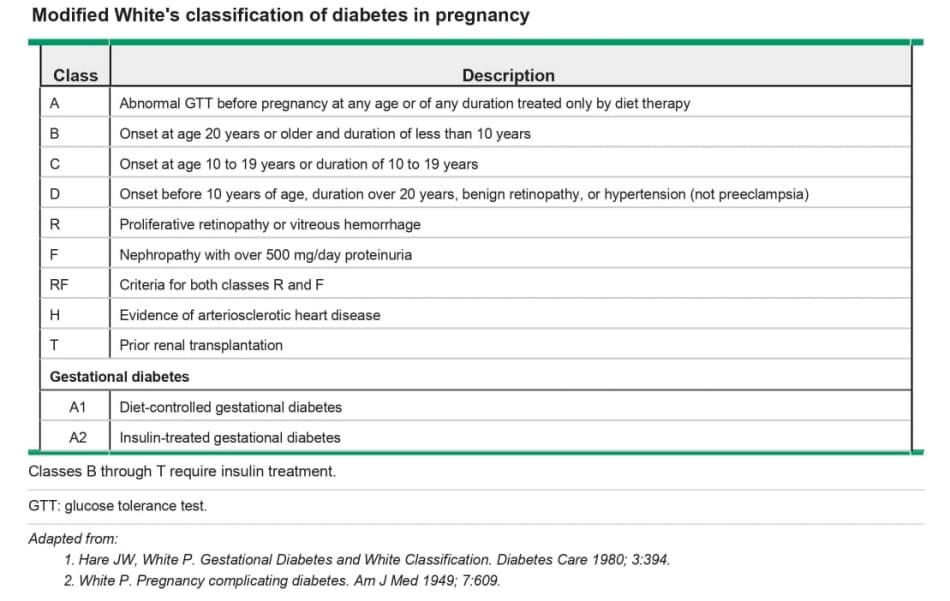
Như một số nghiên cứu đã báo cáo rằng thai phụ bị GDM có sự gia tăng nguy cơ thai chết lưu [ 40,41 ], chúng tôi đồng thuận với ý kiến chuyên gia, thường khuyến cáo rằng những thai phụ cần insulin hoặc thuốc hạ đường huyết đường uống (tức là GDM loại A2 (table 1)) để duy trì đường huyết bình thường hoặc những người có mức đường huyết được kiểm soát dưới mức tối ưu nên được quản lý theo cách tương tự như thai phụ mắc bệnh đái tháo đường tiền thai kỳ hoặc các tình trạng khác khiến thai kỳ tăng nguy cơ có kết cục bất lợi. Những thai phụ này thường được test trước sinh định kỳ, thường bắt đầu khi thai được khoảng 32 tuần. Mặc dù chúng tôi thực hiện NST cùng với chỉ số ối hai lần mỗi tuần, nhưng không có bằng chứng mạnh ủng hộ test hai lần một tuần hơn test hàng tuần hoặc bắt đầu test ở tuần thứ 32 so với tuổi thai muộn hơn. Ví dụ, một số trung tâm y tế bắt đầu NST hàng tuần lúc 32 tuần và táng lên hai lần mỗi tuần lúc 36 tuần.
Như đã thảo luận ở trên, ACOG đề xuất đánh giá thai nhi trước sinh bắt đầu từ tuần thứ 32 của thai kỳ đối với thai phụ được điều trị bằng insulin hoặc thuốc uống, ngay cả khi đạt được trạng thái kiểm soát đường huyết tốt với liệu pháp dùng thuốc và đối với thai phụ kiểm soát đường huyết dưới mức tối ưu bằng liệu pháp dinh dưỡng V tế .
Theo dõi sự tăng trưởng của thai nhi – Chúng tôi thực hiện một cuộc kiểm tra siêu âm ba tháng cuối duy nhất từ tuần thứ 36 đến 39 để ước tính trọng lượng thai nhi ở tất cả thai phụ bị GDM, bất kể mức độ kiểm soát chuyển hóa hoặc nhu cầu insulin hoặc thuốc hạ đường huyết. Xác định sự gia tăng tốc độ tăng trưởng của thai nhi trước sinh có thể hữu ích để xác định các cặp mẹ – thai có thể được hưởng lợi từ việc sinh mổ theo kế hoạch để tránh chấn thương vì đẻ khó do kẹt vai [ 42 ].
Bởi sự hạn chế của dữ liệu có sẵn được thảo luận dưới đây, một loạt các mô hình thực hành đã được phát triển. Một số bác sĩ lâm sàng cũng thực hiện khám siêu âm sớm trong ba tháng cuối để xác định sự gia táng tốc độ tăng trưởng của thai nhi vì đây dường như là một dấu hiệu của việc kiểm soát đường huyết dưới mức tối ưu [ 43 ]. Những người khác sử dụng thông tin để xác định các cặp mẹ-thai có thể được hưởng lợi từ việc khởi phát chuyển dạ trước khi thai tăng trưởng quá lớn. Còn những người khác thực hiện khám siêu âm nối tiếp mỗi bốn tuần từ lúc chẩn đoán cho đến khi sinh để xác định sự gia tăng tốc độ tăng trưởng của thai nhi; kiểm soát đường huyết chặt chẽ hơn ở những thai kỳ này có thể làm giảm nguy cơ thai to [ 44,45 ].
Tương tự như tình huống test trước sinh, một số bác sĩ không theo dõi sự tăng trưởng của thai nhi bằng siêu âm ở những thai phụ có đường huyết bình thường bị A1 GDM (liệu pháp dinh dưỡng y tế đơn thuần) vì lo ngại rằng kết quả dương tính giả sẽ dẫn đến các biến chứng do điều tri. Ví dụ, một nghiên cứu báo cáo gia tăng sinh mổ ở những thai phụ khám siêu âm ba tháng cuối, ngay cả khi đã kiểm soát được cân nặng lúc sinh [ 46 ].
Việc ước tính trọng lượng của thai nhi là một thách thức vì không có phương pháp đánh giá sự tăng trưởng của thai nhi nào thực hiện tốt; tất cả các phương pháp hiện tại đều không đủ độ nhạy và độ đặc hiệu, đặc biệt để xác định thai lớn so với tuổi thai (LGA) [ 47-49 ]. Một tổng quan về những thai phụ bị đái tháo đường được điều trị bằng insulin cho thấy trọng lượng thai nhi ước tính trên siêu âm phải > 4800 gam để có ít nhất 50% khả năng cân nặng lúc sinh của trẻ là 2: 4500 gam [ 50 ]. Các nghiên cứu ở thai kỳ không bị đái tháo đường cho kết quả tương tự [ 51 ]. Các nhà nghiên cứu đã thử tìm kiếm một phương thức ước tính trọng lượng thai nhi có độ nhạy cao hơn, nhưng có rất ít bằng chứng cho thấy những phương thức thử nghiệm này có thể cải thiện công nghệ siêu âm hai chiều hiện có [ 52-55 ]. Chẩn đoán LGA / thai to được thảo luận chi tiết ở chủ đề riêng. (See “Fetal macrosomia”, section on ‘Diagnosis’ and “Fetal macrosomia”, section on ‘Women with diabetes’.)
Quản lý một số các biến chứng trước sinh – Như đã thảo luận ở trên (see ‘Consequences of GDM’ above), các biến chứng trước sinh sau đây phổ biến hơn ở bệnh nhân bị GDM.
• Tiền sản giật và tăng huyết áp thai kỳ – Quản lý tiền sản giật và tăng huyết áp thai kỳ tương tự như ở bệnh nhân không bị GDM. Labetalol cỏ thể được sử dụng để quản lý tăng huyết áp nặng; các triệu chứng hạ đường huyết khó cỏ thể bị che giấu ở bệnh nhân GDM. (See “Preeclampsia: Management and prognosis” and “Gestational hypertension” and “Hypoglycemia in adults with diabetes mellitus”.)
Tuy nhiên, dùng corticosteroid trước khi sinh (ACS), nếu được chỉ định, có tác dụng tăng đường huyết, bắt đầu khoảng 12 giờ sau liều steroid đầu tiên và kéo dài khoảng năm ngày . Chúng tôi theo dõi nồng độ đường huyết mao mạch thường xuyên (ví dụ, ít nhất bốn lần mỗi ngày, nhưng có thể thường xuyên hơn tùy thuộc vào nồng độ đường huyết và khó khán trong việc kiểm soát đường huyết) bắt đầu 12 giờ sau liều betamethasone đầu tiên và tiếp tục trong 24 giờ sau liều thứ hai. Sau đó, chúng tôi giảm tần suất xuống bốn lần mỗi ngày nếu nồng độ đường huyết được kiểm soát tốt. Nếu nồng độ đường huyết lúc đói >100 mg/dL (5,5 mmol/L) hoặc sau ăn > 140 mg/mL (7,8 mmol/L), chúng tôi sẽ điều trị bằng insulin tiêm dưới da.
ACS thường không được khuyến cáo khi tuổi thai > 34 tuần ở bệnh nhân bị đái tháo đường. Trong khi thử nghiệm Antenatal Late Preterm Steroids (ALPS) cho thấy một lợi ích nhỏ ở những trường hợp sinh non muộn, đặc biệt thử nghiệm này đã loại những bệnh nhân bị đái tháo đường vì lo ngại ảnh hưởng đến việc kiểm soát đường huyết. (See “Antenatal corticosteroid therapy for reduction of neonatal respiratory morbidity and mortality from preterm delivery”.)
• Chuyển dạ sinh non – Quản lý chuyển dạ sinh non giống như những bệnh nhân không có GDM. Indomethacin và nifedipine là những thuốc đầu tay để giảm co, với sự lựa chọn phụ thuộc vào tuổi thai. Nếu chống chỉ định với các thuốc này, có thể dùng terbutaline, nhưng cần theo dõi nồng độ glucose của mẹ vì thuốc đồng vận beta có thể làm tăng nồng độ glucose. Đối với nồng độ đường huyết lúc đói >100 mg/dL (5,5 mmol/L) hoặc sau ăn > 140 mg/mL (7,8 mmol/L), chúng tôi điều trị bằng insulin tiêm dưới da. (See “Inhibition of acute preterm labor”.)
Sử dụng đồng thời ACS làm nổi bật tình trạng táng nồng độ glucose. Tuổi thai để sử dụng (tức là < 34 tuần), theo dõi và điều trị được mô tả ở trên cho bệnh nhân bị tiền sản giật hoặc tăng huyết áp thai kỳ.
• Thai to và dự đoán / phòng ngừa đẻ khó do kẹt vai – Thai to được chẩn đoán bằng siêu âm và thường kèm theo đa ối. Một mối lo ngại chính trong quá trình sinh thai to là xuất hiện đẻ khó do kẹt vai. Các vấn đề liên quan đến việc khởi phát chuyển dạ thai nhi < 4500 gam so với quản lý theo dõi được xem xét ở chủ đề riêng. (See “Shoulder dystocia: Risk factors and planning delivery of high-risk pregnancies”, section on Women with diabetes’.)
Sinh mổ theo kế hoạch thường được áp dụng cho những thai phụ bị GDM và trọng lượng thai ước tính > 4500 gram để ngăn ngừa đẻ khó do kẹt vai. (See ‘Scheduled cesarean delivery for fetal weight >4500 grams’ below.)
Thời điểm sinh – Một trong những vấn đề quan trọng của việc quản lý thai phụ bị GDM là có nên khởi phát chuyển dạ hay không và nếu có thì khi nào. Các lợi ích tiềm năng chính của khởi phát chuyển dạ là tránh thai chết lưu muộn và tránh các biến chứng liên quan đến sinh đẻ khi thai nhi tiếp tục tăng trưởng, như đẻ khó do kẹt vai hoặc mổ lấy thai vì cổ tử cung không tiến triển. Những bất lợi tiềm ẩn là nguy cơ khởi phát (ví dụ: chuyển dạ lâu hơn, xu hướng can thiệp gia tăng) và tăng tỷ lệ bệnh tật sơ sinh nếu khởi phát chuyển dạ trước 39 tuần. Ngày càng có nhiều bằng chứng cho thấy rằng khởi phát chuyển dạ ở thai phụ bị GDM không dẫn đến tỷ lệ sinh mổ cao hơn so với quản lý theo dõi [ 58-60 ].
Thời điểm sinh tối ưu trong GDM chưa được đánh giá trong các thử nghiệm được thiết kế tốt. Dữ liệu hiện có không đủ để đưa ra khuyến cáo dựa trên bằng chứng mạnh; do đó, thực hành chung hơi khác nhau trên toàn thế giới [ 45,671.
A1 GDM với kiểm soát đường huyết tốt – Cách tiếp cận của chúng tôi và mô hình thực hành đã phát triển ở nhiều cơ sở, là quản lý thai kỳ của những thai phụ vẫn giữ được đường huyết bình thường với liệu pháp dinh dưỡng và tập luyện thể chất đơn thuần (A1 GDM) bằng cách bắt đầu thảo luận về khả năng khởi phát chuyển dạ và cân bằng giữa khởi phát chuyển dạ so với quản lý theo dõi khi thai đạt 39 + 0 tuần tuổi, và lên lịch khởi phát từ 39 + 0 đến 41+0 tuần tuổi thai; khởi phát làm giảm các nguy cơ liên quan đến thai đủ tháng muộn (41 + 0 đến 41 + 6) và thai già tháng (> 42 + 0). (See “Postterm pregnancy”.)
Cách tiếp cận gần như không can thiệp này dựa trên những kết cục thuận lợi được báo cáo trong một loạt trường hợp không đối chứng kinh điển gồm 196 thai phụ mắc đái tháo đường loại A được quản lý theo cách này. Mặc dù thực hành lâm sàng khác nhau giữa các cơ sở y tế, nhưng nhìn chung có sự đồng thuận rằng những bệnh nhân này không nên sinh chủ động trước 39 + 0 tuần tuổi thai. Thời điểm khởi phát từ 39 + 0 đến 41+0 tuần tuổi thai còn nhiều tranh cãi.
Trong khi một nghiên cứu sử dụng phân tích quyết định cho thấy tỷ lệ tử vong thai nhi và trẻ sơ sinh có thể được giảm thiểu khi sinh ở 38 tuần tuổi thai, chỉ riêng mô hình toán học này là không đủ để thay đổi thực hành lâm sàng của chúng ta. ACOG cho rằng không nên lên kế hoạch sinh trước 39 + 0 tuần tuổi thai, trừ khi có chỉ định khác và quản lý theo dõi lên đến 40 + 6 tuần thường thích hợp với test trước sinh.
A2 GDM và A1 GDM với kiểm soát glucose dưới mức tối ưu – Đối với thai phụ bị GDM có nồng độ glucose được điều trị nội khoa bằng insulin hoặc thuốc uống (A2 GDM) và thai phụ bị A1 GDM với kiểm soát glucose dưới mức tối ưu, chúng tôi đề nghị khởi phát chuyển dạ ở 39 + 0 tuần tuổi thai dựa trên dữ liệu từ một nghiên cứu thuần tập hồi cứu về những thai phụ bị GDM cho thấy tỷ lệ tử vong trẻ sơ sinh ở 39 + 0 tuần (8,7 /10.000) thấp hơn có ý nghĩa thống kê so với nguy cơ thai chết lưu cộng với tỷ lệ tử vong trẻ sơ sinh với quản lý theo dõi thêm một tuần nữa (15,2/10.000) [ 40 1. Ngoài ra, khởi phát chuyển dạ có thể làm giảm nguy cơ đẻ khó do kẹt vai so với sinh muộn hơn vì cân nặng lúc sinh sẽ thấp hơn khi không có sự tăng trưởng tiếp tục trong tử cung [ 61,62 ].
Sinh đủ tháng sớm (37 + 0 đến 38 + 6 tuần) không được chỉ định trong A2 GDM không biến chứng với các mức đường huyết được kiểm soát tốt vì nguy cơ thai chết lưu thấp trong khi tỷ lệ bệnh tật sơ sinh tăng ở tuổi thai này; tuy nhiên, nếu có một tình trạng bệnh lý đồng thời (ví dụ, tăng huyết áp) hoặc kiểm soát đường huyết dưới mức tối ưu bằng liệu pháp dùng thuốc, nên thực hiện sinh thai theo chỉ định lâm sàng trước 39 + 0 tuần tuổi thai. Cân nặng của thai nhi cũng cần được xem xét. (See ‘Scheduled cesarean delivery for fetal weight >4500 grams’ below.)
ACOG đề nghị chấm dứt thai kỳ ở 39 + 0 đến 39 + 6 tuần tuổi thai đối với thai phụ bị A2 GDM được kiểm soát tốt bằng thuốc . Tuy nhiên, hướng dẫn cho những thai phụ có kiểm soát đường huyết dưới mức tối ưu bằng liệu pháp dùng thuốc thì ít chính xác hơn. Họ đề nghị chấm dứt thai kỳ ở 37 + 0 đến 38 + 6 tuần tuổi thai có thể là hợp lý, nhưng chỉ nên chấm dứt thai kỳ trước 37 + 0 tuần khi những nỗ lực tích cực hơn để kiểm soát đường máu, như nhập viện đã thất bại.
Sinh mổ theo kế hoạch với cân nặng thai nhi > 4500 gam – Sinh mổ theo kế hoạch để tránh chấn thương khi sinh thường được áp dụng cho những thai phụ ở 39 + 0 tuần với GDM và cân nặng ước tính của thai nhi 4500 gam. Ngưỡng cân nặng của thai nhi mà tại đó nên thực hiện mổ lấy thai theo kế hoạch để làm giảm nguy cơ chấn thương khi sinh bởi đẻ khó do kẹt vai còn nhiều tranh cãi. Người ta ước tính rằng ở những thai kỳ đái tháo đường có trọng lượng thai nhi ước tính >4500 gam, cần thực hiện 443 ca mổ lấy thai để ngăn ngừa một ca tổn thương đám rối thần kinh cánh tay vĩnh viễn [ 42]. Liệu sự đánh đổi này có thể biện minh cho việc gia tăng nguy cơ khi sinh mổ hay không vẫn chưa rõ ràng. Thông cáo thực hành ACOG về GDM khuyến cáo thảo luận về nguy cơ và lợi ích của sinh mổ theo kế hoạch với thai phụ bị GDM và cân nặng ước tính của thai nhi ằ 4500 gram.
Theo dõi đường huyết trong quá trình chuyền dạ và sinh – Nhu cầu insulin thường giảm trong quá trình chuyển dạ vì lượng calo nhập vào qua đường miệng thường giảm và công chuyển dạ, đặc biệt là cơn co tử cung, cần thêm năng lượng. Thai phụ bị GDM có đường huyết bình thường khi không sử dụng insulin hoặc thuốc uống hạ đường huyết trong thai kỳ thường không bị tăng đường huyết trong quá trình chuyển dạ và sinh và do đó không cần kiểm tra nồng độ đường huyết của họ. Tuy nhiên, vì lo ngại về giá trị của các đánh giá đường huyết ban đầu ở phòng khám ngoại trú, một số bác sĩ và trung tâm lựa chọn đánh giá mức đường huyết trong khi chuyển dạ.
Những thai phụ bị GDM đã sử dụng insulin hoặc thuốc uống hạ đường huyết để duy trì đường huyết bình thường trước sinh có thể cần insulin trong quá trình chuyển dạ và sinh để duy trì đường huyết bình thường. Đánh giá định kỳ nồng độ đường huyết của mẹ trong quá trình chuyển dạ và điều trị tăng đường huyết là điều cần thận trọng, mặc dù tình trạng tăng đường huyết ở mẹ trong khi sinh dẫn đến kết cục sơ sinh bất lợi không thường gặp.
Mục tiêu điều trị là giảm nguy cơ hạ đường huyết ở trẻ sơ sinh. Mặc dù hạ đường huyết ở trẻ sơ sinh kéo dài chủ yếu là do thai nhi phơi nhiễm với tình trạng tăng đường huyết mạn tính trong thai kỳ và hậu quả là tăng sản tuyến tụy của thai nhi, hạ đường huyết thoáng qua có thể do tăng đường huyết ở mẹ trong khi sinh, gây tăng insulin thai nhi cấp tính.
Theo dõi và quản lý đường huyết trong khi sinh bằng insulin và thuốc uống hạ đường huyết trong khi chuyển dạ tự nhiên, trước khi khởi phát và trước khi sinh mổ theo kế hoạch được thảo luận chi tiết ở chủ đề riêng. (See “Progestational (preexisting) and gestational diabetes: Intrapartum and postpartum glycemic control”.)
Quản lý chuyển dạ với cân nặng thai nhi > 4500 gam – Nếu thai phụ có cân nặng thai nhi ước tính > 4500 gam, quyết định thực hiện thử nghiệm chuyển dạ, chúng tôi theo dõi chặt chẽ diễn biến chuyển dạ và chỉ thực hiện sinh ngả âm đạo với sự hỗ trợ của dụng cụ nếu thai xuống giai đoạn hai bình thường vì sinh bằng dụng cụ có liên quan đến nguy cơ đẻ khó do kẹt vai và tổn thương đám rối thần kinh cánh tay cao hơn, với nguy cơ thậm chí còn cao hơn khi sử dụng giác hút so với forceps. (See “Shoulder dystocia: Risk factors and planning delivery of high-risk pregnancies”, section on ‘Planning delivery in high-risk pregnancies’.)
4.QUẢN LÝ SAU SINH VÀ THEO DÕI
Sản phụ bị GDM có thể tiếp tục chế độ ăn uống bình thường sau khi sinh. Sau khi sinh, tác dụng tăng đường huyết của các hormone nhau thai sẽ biến mất nhanh chóng. Do đó, hầu hết sản phụ trở lại trạng thái đường huyết trước khi mang thai của họ ngay sau sinh, dao động từ gần như ngay lập tức đến một tuần sau sinh. Theo dõi và điều trị glucose sau sinh, nếu được chỉ định, được xem xét ở chủ đề riêng. (See “Progestational (preexisting) and gestational diabetes: Intrapartum and postpartum glycemic control”, section on Women with gestational diabetes’.)
Cho con bú – Nên khuyến khích cho con bú sữa mẹ vì nó có lợi cho cả mẹ và con. (See “Maternal and economic benefits of breastfeeding” and “Infant benefits of breastfeeding”.)
Nuôi con bằng sữa mẹ giúp cải thiện chuyển hóa glucose của mẹ và do đó có thể làm giảm mức glucose thu được trong khi thực hiện nghiệm pháp dung nạp glucose sau sinh (GTT) [ 79- 81 ], đặc biệt nếu sản phụ cho con bú trong khi làm nghiệm pháp [ 82 ]. về mặt lý thuyết, điều này có thể dẫn đến một kết quả giả tạo.
Một số nghiên cứu tiến cứu đã báo cáo rằng cho con bú làm giảm tỷ lệ mắc mới bệnh đái tháo đường type 2 trong thời gian dài sau khi được chẩn đoán GDM so với không cho con bú [ 83-86 ]. Cường độ tiết sữa cao hơn và thời gian dài hơn có mối liên quan nghịch với nguy cơ, không phụ thuộc vào việc giảm cân và sau khi điều chỉnh các yếu tố nguy cơ đối với bệnh đái tháo đường type 2 (đặc điểm nhân chủng- xã hội học, tình trạng chuyển hóa trước sinh và diễn tiến, kết cục chu sinh, hành vi lối sống).
Tránh thai – Mặc dù bất kỳ biện pháp tránh thai nào cũng đều được chấp nhận miễn là không có các chống chỉ định y tế thông thường, chúng tôi khuyến cáo nên sử dụng biên pháp tránh thai lâu dài có thể đáo nqươc (ví dụ: dụng cụ trong tử cung [IUD], que cấy tránh thai) vì nguy cơ mang thai ngoài ý muốn với các biện pháp này là rất thấp. Không có bằng chứng thuyết phục nào cho thấy thuốc tránh thai nội tiết tố (estrogen-progestin hoặc chỉ chứa progestin) làm tăng nguy cơ phát triển bệnh đái tháo đường của người dùng. về lý thuyết, nên lựa chọn thuốc tránh thai có nồng độ hormone toàn thân thấp hơn để giảm thiểu bất kỳ sự thay đổi nào trong các thông số chuyển hóa. Nếu bệnh nhân lo lắng về các vấn đề nội tiết tố, dụng cụ trong tử cung giải phóng đồng là một giải pháp thay thế tốt.
Tầm soát bệnh đái tháo đường thực sự – Vì một số thai phụ bị GDM có thể đã mắc bệnh đái tháo đường type 2 chưa được phát hiện trước đó, chúng tôi đồng thuận với khuyến cáo của Endocrine Society là kiểm tra nồng độ glucose trong 24 đến 72 giờ sau khi sinh để loại trừ tình trạng tăng đường huyết đang diễn ra [ 89 ]. Nếu nồng độ đường huyết lúc đói gợi ý bệnh đái tháo đường thực sự (đường huyết lúc đói >126 mg/dL [7 mmol/L] hoặc đường huyết sau ăn > 200 mg/dL [11,1 mmol/L]), cho phép điều trị táng đường huyết; loại điều trị (chế độ ăn uống, tập luyện thể chất, giảm cân, dùng thuốc) nên được quyết định dựa vào từng trường hợp cụ thể, thường có sự tư vấn của bác sĩ chuyên khoa đái tháo đường.
Những sản phụ có nồng độ đường huyết lúc đói <126 mg/dL (7 mmol/L) sau khi sinh nên làm GTT đường uống 75 gram hai giờ, 4 đến 12 tuần sau khi sinh để kiểm tra bệnh đái tháo đường hoặc tiền đái tháo đường. (See “Gestational diabetes mellitus: Glycemic control and maternal prognosis”, section on ‘Follow-Up and prevention of type 2 diabetes’.)
Phụ nữ mắc bệnh đái tháo đường được quản lý phù hợp về mặt y tế. (Xem “Xử trí ban đầu tăng đường huyết ở người lớn mác bênh đái tháo đường týp 2”.)
Sản phụ có GTT bình thường được tư vấn về nguy cơ phát triển bệnh đái tháo đường type 2 và bệnh tim mạch trong tương lai, được khuyến khích áp dụng các thay đổi lối sống để giảm nguy cơ (ví dụ: chế độ ăn uống lành mạnh, giảm cân, tập luyện thể chất) và được thông báo về tầm quan trọng của việc theo dõi chặt chẽ với bác sĩ chăm sóc chính của họ và sàng lọc lại vào các khoảng thời gian thích hợp. Những vấn đề này được thảo luận chi tiết ở chủ đề riêng. (See “Gestational diabetes mellitus: Glycemic control and maternal prognosis”, section on ‘Follow-up and prevention of type 2 diabetes’ and “Screening for type 2 diabetes mellitus”.)
Sàng lọc trầm cảm – Mặc dù sàng lọc trầm cảm được chỉ định cho tất cả sản phụ sau sinh, nhưng các bác sĩ lâm sàng cần lưu ý rằng trầm cảm sau sinh thường gặp hơn ở sản phụ mắc bệnh đái tháo đường (tiền thai kỳ hoặc thai kỳ) so với sản phụ không bị đái tháo đường [ 90 1. (See “Postpartum unipolar major depression: Epidemiology, clinical features, assessment, and diagnosis”, section on ‘Screening’.)
5.TÓM TẮT VÀ KHUYẾN CÁO
• Đối với những thai phụ bị đái tháo đường thai kỳ loại A1 (GDM) được kiểm soát tốt bằng liệu pháp y tế dinh dưỡng đơn thuần, chúng tôi đề nghị không test thai nhi trước sinh (Grade 2C) (see ‘Fetal surveillance’ above). Chúng tôi quản lý theo dõi những bệnh nhân này cho đến khi thai được 41+0 tuần. Chúng tôi thực hiện khởi phát ở 39 + 0 tuần tuổi thai và khuyến nghị khởi phát ở 41 + 0 tuần tuổi thai (Grade 1C). (See ‘Timing of delivery’ above.)
• Đối với thai phụ bị A2 GDM (tức là đang điều trị bằng thuốc) hoặc A1 GDM với kiểm soát đường huyết dưới mức tối ưu, chúng tôi đề xuất hình thức test thai nhi trước sinh tiêu chuẩn (Grade 2C). Phác đồ test tối ưu vẫn chưa được thiết lập từ các nghiên cứu chặt chẽ. Chúng tôi chỉ định test trước sinh hai lần mỗi tuần, sử dụng test nonstress với chỉ số ối, bắt đầu từ tuần thứ 32 của thai kỳ. Lý tưởng nhất là những thai phụ với kiểm soát đường huyết dưới mức tối ưu sẽ được kiểm soát tốt hơn bằng chế độ ăn uống và / hoặc thuốc. (See ‘Fetal surveillance’ above.)
• Đối với thai phụ bị A2 GDM và thai phụ bị A1 GDM với kiểm soát đường huyết dưới mức tối ưu, chúng tôi đề nghị khởi phát chuyển dạ ở 39 + 0 đến 41+0 tuần tuổi thai (Grade 2C). Các lợi ích tiềm năng bao gồm tỷ lệ thai to và trẻ lớn so với tuổi thai thấp hơn, tỷ lệ đẻ khó do kẹt vai thấp hơn và tỷ lệ sinh mổ thấp hơn. Nếu có một tình trạng y tế đồng thời (ví dụ, tăng huyết áp) hoặc kiểm soát đường huyết dưới mức tối ưu khi điều trị bằng thuốc, thì việc sinh đẻ nên được thực hiện theo chỉ định lâm sàng trước 39 + 0 tuần tuổi thai. (See ‘Timing of delivery’ above.)
• Chúng tôi đề nghị siêu âm ba tháng cuối thai kỳ duy nhất lúc 36 đến 39 tuần để tầm soát thai to. (See ‘Monitoring fetal growth’ above.)
Sinh mổ theo kế hoạch để tránh chấn thương trong khi sinh thường được thực hiện ở 39 + tuần cho thai phụ bị GDM và cân nặng thai nhi ước tính > 4500 gam. Những thai phụ như vậy nên được tư vấn về khả năng dự đoán kém của siêu âm trong việc ước tính cân nặng thai nhi và những nguy cơ và lợi ích của sinh mổ ở thai kỳ hiện tại và tương lai. (See ‘Scheduled cesarean delivery for fetal weight >4500 grams’ above.)
• Tất cả sản phụ bị GDM nên làm nghiệm pháp dung nạp glucose đường uống 75 gram hai giờ, từ 4 đến 12 tuần sau sinh. Những người có kết quả xét nghiệm bình thường cần được thông báo về nguy cơ mắc bệnh đái tháo đường và bệnh tim mạch trong tương lai, tư vấn về các biện pháp phòng ngừa mà họ có thể áp dụng và thông báo về sự cần thiết phải sàng lọc lại định kỳ. Sản phụ mắc bệnh đái tháo đường được quản lý phù hợp về mặt y tế. (See ‘Postpartum management and follow-up’ above.)
• Tất cả sản phụ nên được khuyến khích cho con bú. Một lợi ích tiềm năng của việc cho con bú đối với một số sản phụ là nó cải thiện sự chuyển hóa glucose trong thời gian ngắn. (See ‘Breastfeeding’ above.)
• Mặc dù bất kỳ biện pháp tránh thai nào cũng đều được chấp nhận miễn là không có các chống chỉ định y tế thông thường, chúng tôi khuyến cáo nên sử dụng biện pháp tránh thai lâu dài có thể đảo ngược để giảm thiểu nguy cơ mang thai ngoài ý muốn. (See ‘Contraception’ above.)
6.THAM KHẢO
1. Black MH, Sacks DA, Xiang AH, Lawrence JM. The relative contribution of prepregnancy overweight and obesity, gestational weight gain, and lADPSG-defined gestational diabetes mellitus to fetal overgrowth. Diabetes Care 2013; 36:56,
2. HAPO Study Cooperative Research Group, Metzger BE, Lowe LP, et al. Hyperglycemia and adverse pregnancy outcomes. N Engl J Med 2008; 358:1991.
3. Crowther CA, Hiller JE, Moss JR, et al. Effect of treatment of gestational diabetes mellitus on pregnancy outcomes. N Engl J Med 2005; 352:2477.
4. Kwik M, Seeho SK, Smith c, et al. Outcomes of pregnancies affected by impaired glucose tolerance. Diabetes Res Clin Pract 2007; 77:263.
5. Garner p, Okun N, Keely E, et al. A randomized controlled trial of strict glycemic control
and tertiary level obstetric care versus routine obstetric care in the management of gestational diabetes: a pilot study. Am J Obstet Gynecol 1997; 177:190.
6. Hillier TA, Pedula KL, Vesco KK, et al. Excess gestational weight gain: modifying fetal macrosomia risk associated with maternal glucose. Obstet Gynecol 2008; 112:1007.
7. Sovio u, Murphy HR, Smith GC. Accelerated Fetal Growth Prior to Diagnosis of Gestational Diabetes Mellitus: A Prospective Cohort study of Nulliparous Women. Diabetes Care 2016; 39:982.
8. Dooley SL, Metzger BE, Cho NH. Gestational diabetes mellitus. Influence of race on disease prevalence and perinatal outcome in a U.S, population. Diabetes 1991; 40 Suppl 2:25.
9. Lipscomb KR, Gregory K, Shaw K. The outcome of macrosomic infants weighing at least 4500 grams: Los Angeles County + University of Southern California experience. Obstet Gynecol 1995; 85:558.
10. Lazer s, Biale Y, Mazor M, et al. Complications associated with the macrosomic fetus. J Reprod Med 1986; 31:501.
11. Rouse DJ, Owen J. Prophylactic cesarean delivery for fetal macrosomia diagnosed by means of ultrasonography–A Faustian bargain? Am J Obstet Gynecol 1999; 181:332.
12. Berard J, Dufour p, Vinatier D, et al. Fetal macrosomia: risk factors and outcome. A study of the outcome concerning 100 cases >4500 g, Eur J Obstet Gynecol Reprod Biol 1998; 77:51.
13. stotland NE, Caughey AB, Breed EM, Escobar GJ. Risk factors and obstetric complications associated with macrosomia. Int J Gynaecol Obstet 2004; 87:220.
14. Cohen BF, Penning s, Ansley D, et al. The incidence and severity of shoulder dystocia correlates with a sonographic measurement of asymmetry in patients with diabetes. Am J Perinatol 1999; 16:197.
15. Nesbitt TS, Gilbert WM, Herrchen B. Shoulder dystocia and associated risk factors with macrosomic infants born in California. Am J Obstet Gynecol 1998; 179:476.
16. Casey BM, Lucas MJ, Mcintire DP, Leveno KJ. Pregnancy outcomes in women with gestational diabetes compared with the general obstetric population. Obstet Gynecol 1997; 90:869.
17. Yogev Y, Xenakis EM, Langer o. The association between preeclampsia and the severity of gestational diabetes: the impact of glycemic control. Am J Obstet Gynecol 2004; 191:1655.
18. Innes KE, Wimsatt JH, McDuffie R. Relative glucose tolerance and subseguent development of hypertension in pregnancy. Obstet Gynecol 2001; 97:905.
19. Joffe GM, Esterlitz JR, Levine RJ, et al. The relationship between abnormal glucose tolerance and hypertensive disorders of pregnancy in healthy nulliparous women. Calcium for Preeclampsia Prevention (CPEP) study Group. Am J Obstet Gynecol 1998; 179:1032.
20. Carpenter MW. Gestational diabetes, pregnancy hypertension, and late vascular disease. Diabetes Care 2007; 30 Suppl 2:S246.
21. Yogev, Chen, Hod, et al. Hyperglycemia and Adverse Pregnancy Outcome (HAPO) study: preeclampsia. Am J Obstet Gynecol 2010; 202:255.e1.
22. Parretti E, Lapolla A, Dalfra M, et al. Preeclampsia in lean normotensive normotolerant pregnant women can be predicted by simple insulin sensitivity indexes. Hypertension 2006; 47:449.
23. Sierra-Laguado J, García RG, Celedon J, et al. Determination of insulin resistance using the homeostatic model assessment (HOMA) and its relation with the risk of developing pregnancy-induced hypertension. Am J Hypertens 2007; 20:437.
24. Hauth JC, Clifton RG, Roberts JM, et al. Maternal insulin resistance and preeclampsia. Am J Obstet Gynecol 2011; 204:327.e1.
25. Bryson CL, loannou GN, Rulyak SJ, Critchlow c. Association between gestational diabetes and pregnancy-induced hypertension. Am J Epidemiol 2003; 158:1148.
26. Shoham I, Wiznitzer A, Silberstein T, et al. Gestational diabetes complicated by hydramnios was not associated with increased risk of perinatal morbidity and mortality. Eur J Qbstet Gynecol Reprod Biol 2001; 100:46.
27. Biggio JR Jr, Wenstrom KD, Dubard MB, Oliver SP. Hydramnios prediction of adverse perinatal outcome. Obstet Gynecol 1999; 94:773.
28. Pilliod RA, Page JM, Burwick RM, et al. The risk of fetal death in nonanomalous pregnancies affected by polyhydramnios. Am J Obstet Gynecol 2015; 213:410.e1.
29. Girz BA, Divon MY, Merkatz IR. Sudden fetal death in women with well-controlled, intensively monitored gestational diabetes. J Perinatal 1992; 12:229.
30. Aberg A, Rydhstrõm H, Kãllén B, Kãllén K. Impaired glucose tolerance during pregnancy is associated with increased fetal mortality in preceding sibs. Acta Qbstet Gynecol Scand 1997; 76:212.
31. Dudley DJ. Diabetic-associated stillbirth: incidence, pathophysiology, and prevention. Obstet Gynecol Clin North Am 2007: 34:293.
32. Langer o, Rodriquez DA, Xenakis EM, et al. Intensified versus conventional management of gestational diabetes. Am J Obstet Gynecol 1994; 170:1036.
33. Blank A, Grave GD, Metzger BE, Effects of gestational diabetes on perinatal morbidity reassessed. Report of the International Workshop on Adverse Perinatal Outcomes of Gestational Diabetes Mellitus, December 3-4, 1992. Diabetes Care 1995; 18:127.
34. Hod M, Merlob p, Friedman s, et al. Gestational diabetes mellitus, A survey of perinatal complications in the 1980s. Diabetes 1991; 40 Suppl 2:74,
35. Werner EF, Romano ME, Rouse DJ, et al. Association of Gestational Diabetes Mellitus With Neonatal Respiratory Morbidity. Obstet Gynecol 2019; 133:349.
36. Gabbe SG, Mestman JG, Freeman RK, et al. Management and outcome of class A diabetes mellitus. Am J Obstet Gynecol 1977; 127:465.
37. Committee on Practice Bulletins—Obstetrics. ACOG Practice Bulletin No. 190: Gestational Diabetes Mellitus. Obstet Gynecol 2018; 131:e49. Reaffirmed 2019,
38. Kios SL, Leung A, Henry OA, et al. Antepartum surveillance in diabetic pregnancies: predictors of fetal distress in labor. Am J Obstet Gynecol 1995; 173:1532.
39. Landon MB, Gabbe SG. Antepartum fetal surveillance in gestational diabetes mellitus. Diabetes 1985; 34 Suppl 2:50,
40. Rosenstein MG, Cheng YW, Snowden JM, et al. The risk of stillbirth and infant death stratified by gestational age in women with gestational diabetes. Am J Obstet Gynecol 2012; 206:309.e1.
41. Cheng YW, Chung JH, Block-Kurbisch I, et al. Treatment of gestational diabetes mellitus: glyburide compared to subcutaneous insulin therapy and associated perinatal outcomes. J Matern Fetal Neonatal Med 2012; 25:379.
42. Rouse DJ, Owen J, Goldenberg RL, Cliver SP. The effectiveness and costs of elective cesarean delivery for fetal macrosomia diagnosed by ultrasound. JAMA 1996; 276:1480.
43. Kjos SL, Schaefer-Graf UM. Modified therapy for gestational diabetes using high-risk and low-risk fetal abdominal circumference growth to select strict versus relaxed maternal glycemic targets. Diabetes Care 2007; 30 Suppl 2:S200.
44. Ben-Haroush A, Chen R, Hadar E, et al. Accuracy of a single fetal weight estimation at 29-
34 weeks in diabetic pregnancies: can it predict large-for-gestational-age infants at term? Am J Obstet Gynecol 2007; 197:497.e1.
45. Hod M, Kapur A, Sacks DA, et al. The International Federation of Gynecology and Obstetrics (FIGO) Initiative on gestational diabetes mellitus: A pragmatic guide for diagnosis, management, and care. Int J Gynaecol Obstet 2015; 131 Suppl 3:S173.
46. Little SE, Edlow AG, Thomas AM, Smith NA. Estimated fetal weight by ultrasound: a modifiable risk factor for cesarean delivery? Am J Obstet Gynecol 2012; 207:309.e1 ■
47. Engstrom JL, Work BA Jr. Prenatal prediction of small- and large-for-gestational age neonates. J Obstet Gynecol Neonatal Nurs 1992; 21:486.
48. Humphries J, Reynolds D, Bell-Scarbrough L, et al. Sonographic estimate of birth weight: relative accuracy of sonographers versus maternal-fetal medicine specialists. J Matern Fetal Neonatal Med 2002; 11:108.
49. Johnstone FD, Prescott RJ, steel JM, et al. Clinical and ultrasound prediction of macrosomia in diabetic pregnancy. Br J Obstet Gynaecol 1996; 103:747.
50. McLaren RA, Puckett JL, Chauhan SP. Estimators of birth weight in pregnant women reguiring insulin: a comparison of seven sonographic models. Obstet Gynecol 1995; 85:565.
51. Smith GC, Smith MF, McNay MB, Fleming JE. The relation between fetal abdominal circumference and birthweight: findings in 3512 pregnancies. Br J Obstet Gynaecol 1997; 104:186.
52. Hackmon R, Bornstein E, Ferber A, et al. Combined analysis with amniotic fluid index and estimated fetal weight for prediction of severe macrosomia at birth. Am J Obstet Gynecol 2007; 196;333.e1.
53. Scioscia M, Scioscia F, Vimercati A, et al. Estimation of fetal weight by measurement of fetal thigh soft-tissue thickness in the late third trimester. Ultrasound Obstet Gynecol 2008; 31:314.
54. Cromi A, Ghezzi F, Di Naro E, et al. Large cross-sectional area of the umbilical cord as a predictor of fetal macrosomia. Ultrasound Obstet Gynecol 2007; 30:861.
55. Higgins MF, Russell NM, Mulcahy CH, et al. Fetal anterior abdominal wall thickness in diabetic pregnancy. Eur J Obstet Gynecol Reprod Biol 2008; 140:43,
56. Mathiesen ER, Christensen AB, Hellmuth E, et al. Insulin dose during glucocorticoid treatment for fetal lung maturation in diabetic pregnancy: test of an algorithm [correction of analgoritml. Acta Obstet Gynecol Scand 2002; 81:835.
57. Refuerzo JS, Garg A, Rech B, et al. Continuous glucose monitoring in diabetic women following antenatal corticosteroid therapy: a pilot study. Am J Perinatol 2012; 29:335.
58. Feghali MN, Caritis SN, Catov JM, Scifres CM. Timing of delivery and pregnancy outcomes in women with gestational diabetes. Am J Obstet Gynecol 2016; 215:243.e1.
59. Alberico s, Businelli c, Wiesenfeld u, et al. Gestational diabetes and fetal growth acceleration: induction of labour versus expectant management. Minerva Ginecol 2010; 62:533.
60. Sutton AL, Mele L, Landon MB, et al. Delivery timing and cesarean delivery risk in women with mild gestational diabetes mellitus. Am J Qbstet Gynecol 2014; 211:244.e1.
61. Kjos SL, Henry QA, Montoro M, et al. Insulin-reguiring diabetes in pregnancy: a randomized trial of active induction of labor and expectant management. Am J Obstet Gynecol 1993; 169:611,
62. Lurie s, Insler V, Hagay ZJ. Induction of labor at 38 to 39 weeks of gestation reduces the incidence of shoulder dystocia in gestational diabetic patients class A2. Am J Perinatol 1996; 13:293.
63. Conway DL, Langer Q. Elective delivery of infants with macrosomia in diabetic women: reduced shoulder dystocia versus increased cesarean deliveries. Am J Obstet Gynecol 1998; 178:922.
64. Lurie s, Matzkel A, Weissman A, et al. Outcome of pregnancy in class A1 and A2 gestational diabetic patients delivered beyond 40 weeks’ gestation. Am J Perinatol 1992; 9:484.
65. Peled Y, Perri T, Chen R, et al. Gestational diabetes mellitus-implications of different treatment protocols. J Pediatr Endocrinol Metab 2004; 17:847.
66. Alberico s, Erenbourq A, Hod M, et al. Immediate delivery or expectant management in gestational diabetes at term: the GINEXMAL randomised controlled trial. BJQG 2017: 124:669.
67. Biestv LM, Egan AM, Dunne F, et al. Planned birth at or near term for improving health outcomes for pregnant women with gestational diabetes and their infants. Cochrane Database Syst Rev 2018; 1:CD012910.
68. Spong CY, Mercer BM, D’alton M, et al. Timing of indicated late-preterm and early-term birth. Obstet Gynecol 2011; 118:323.
69. Niu B, Lee VR, Cheng YW, et al. What is the optimal gestational age for women with gestational diabetes type A1 to deliver? Am J Obstet Gynecol 2014; 211:418,e1.
70. ACOG Committee Opinion No. 764: Medically Indicated Late-Preterm and Early-Term Deliveries. Obstet Gynecol 2019; 133:e151.
71. Ryan EA, Al-Agha R. Glucose control during labor and delivery. Curr Diab Rep 2014; 14:450.
72. Flores-le Roux JA, Sagarra E, Benaiges D, et al. A prospective evaluation of neonatal hypoglycaemia in infants of women with gestational diabetes mellitus. Diabetes Res Clin Pract2012; 97:217.
73. Barrett HL, Morris J, McElduff A. Watchful waiting: a management protocol for maternal glycaemia in the peripartum period. Aust N z J Obstet Gynaecol 2009; 49:162.
74. Andersen o, Hertel J, Schmolker L, Kuhl c. Influence of the maternal plasma glucose concentration at delivery on the risk of hypoglycaemia in infants of insulin-dependent diabetic mothers. Acta Paediatr Scand 1985; 74:268,
75. Kenepp NB, Kumar s, Shelley wc, et al. Fetal and neonatal hazards of maternal hydration with 5% dextrose before caesarean section. Lancet 1982; 1:1150.
76. Jovanovic L. Glucose and insulin requirements during labor and delivery: the case for normoglycemia in pregnancies complicated by diabetes. Endocr Pract 2004; 10 Suppl 2:40.
77. Caughey AB, Sandberg PL, Zlatnik MG, et al. Forceps compared with vacuum: rates of neonatal and maternal morbidity. Obstet Gynecol 2005; 106:908,
78. Demissie K, Rhoads GG, Smulian JC, et al. Operative vaginal delivery and neonatal and infant adverse outcomes: population based retrospective analysis. BMJ 2004; 329:24.
79. Tigas s, Sunehag A, Haymond MW. Metabolic adaptation to feeding and fasting during lactation in humans. J Clin Endocrinol Metab 2002; 87:302.
80. Lenz s, Kuhl c, Hornnes PJ, Hagen c. Influence of lactation on oral glucose tolerance in the puerperium. Acta Endocrinol (Copenh) 1981; 98:428.
81. Kịos SL, Henry o, Lee RM, et al. The effect of lactation on glucose and lipid metabolism in women with recent gestational diabetes. Obstet Gynecol 1993; 82:451,
82. Gunderson EP, Crites Y, Chiang V, et al. Influence of breastfeeding during the postpartum oral glucose tolerance test on plasma glucose and insulin. Obstet Gynecol 2012; 120:136.
83. Gunderson EP, Hurston SR, Ning X, et al. Lactation and Progression to Type 2 Diabetes Mellitus After Gestational Diabetes Mellitus: A Prospective Cohort Study. Ann Intern Med 2015; 163:889,
84. Ziegler AG, Wallner M, Kaiser I, et al. Long-term protective effect of lactation on the development of type 2 diabetes in women with recent gestational diabetes mellitus. Diabetes 2012:61:3167.
85. Lev SH, Chavarro JE, Li M, et al. Lactation Duration and Long-term Risk for Incident Type 2 Diabetes in Women With a History of Gestational Diabetes Mellitus. Diabetes Care 2020; 43:793.
86. Gunderson EP, Lewis CE, Lin Y, et al. Lactation Duration and Progression to Diabetes in Women Across the Childbearing Years: The 30-Year CARDIA study. JAMA Intern Med 2018; 178:328.
87. Curtis KM, Tepper NK, Jatlaoui TC, et al. U.S. Medical Eligibility Criteria for Contraceptive Use, 2016. MMWR Recomm Rep 2016; 65:1.
88. Lopez LM, Grimes DA, Schulz KF. steroidal contraceptives: effect on carbohydrate metabolism in women without diabetes mellitus. Cochrane Database Syst Rev 2014: :CD006133.
89. Blumer I, Hadar E, Hadden DR, et al. Diabetes and pregnancy: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2013; 98:4227.
90. Kozhimannil KB, Pereira MA, Harlow BL. Association between diabetes and perinatal depression among low-income mothers. JAMA 2009; 301:842.