Bài viết Chống đông máu trong COVID-19: các khái niệm và tranh cãi hiện tại được biên dịch bởi Bs. Đặng Thanh Tuấn – BV Nhi Đồng 1.
1. Tóm tắt
Tỷ lệ tăng huyết khối tắc mạch thứ phát sau COVID-19 đã trở thành mối quan tâm toàn cầu, với một số cuộc khảo sát báo cáo tỷ lệ tử vong gia tăng. Khả năng gây huyết khối của virus SARS-CoV-2 đã được giả thuyết là bắt nguồn từ khả năng tạo ra phản ứng viêm quá mức dẫn đến rối loạn chức năng nội mô. Thuốc chống đông máu vẫn là phương thức chính trong điều trị huyết khối tắc mạch trong nhiều thập kỷ. Tuy nhiên, không có sự nhất trí chung về thời gian, liều lượng và thời gian kháng đông trong COVID-19 cũng như nhu cầu điều trị dự phòng sau xuất viện. Bài báo này tìm cách xem xét các hướng dẫn và khuyến nghị hiện tại cũng như các thử nghiệm đang diễn ra về việc sử dụng thuốc chống đông máu trong COVID-19, xác định sự khác biệt giữa tất cả các thuốc này và đưa ra một chiến lược toàn diện về việc sử dụng các thuốc này trong đại dịch hiện nay.
2. Giới thiệu
Virus beta-coronavirus mới, được Ủy ban phân loại virus quốc tế đặt tên thích hợp là SARS-CoV-2, thuộc họ virus RNA sợi đơn, các thành viên của chúng đã được công nhận là tác nhân gây bệnh SARS-CoV và Hội chứng hô hấp do coronavirus Trung Đông bùng phát lần lượt vào năm 2002 và 2012.1,2 Hiện tại, COVID-19 gây ra một cuộc khủng hoảng sức khỏe toàn cầu lớn, đã được WHO tuyên bố là đại dịch vào ngày 11 tháng 3 năm 2020.
Trong vài tháng qua, một số lượng lớn tài liệu cho thấy nguy cơ gia tăng các biểu hiện huyết khối tắc mạch liên quan đến COVID-19.2 Một số giả thuyết đã được đưa ra để hiểu về sinh lý bệnh cơ bản đằng sau sự phát triển của trạng thái huyết khối trong COVID-19, chẳng hạn như phản ứng viêm quá mức dẫn đến kích hoạt dòng chảy đông máu và tổn thương nội mô.3,4 Việc sử dụng thuốc chống đông máu trong COVID-19 vẫn còn là một lĩnh vực phỏng đoán mà không có hướng dẫn xác định nào được công bố cho đến nay nêu rõ thời gian, liều lượng và thời gian dùng thuốc chống đông máu cũng như loại thuốc được lựa chọn. Hầu hết các hướng dẫn được công bố quốc tế, dựa trên các tuyên bố đồng thuận và ý kiến chuyên gia, khuyến cáo liều điều trị của heparin chỉ ở những bệnh nhân được chẩn đoán hoặc nghi ngờ cao về bệnh thuyên tắc huyết khối lớn như thuyên tắc phổi (PE, pulmonary embolism) hoặc huyết khối tĩnh mạch sâu (DVT, deep vein thrombosis). Tuy nhiên, những hướng dẫn này bao gồm cả những hướng dẫn của CHEST, hiếm khi đề cập đến yêu cầu điều trị dự phòng huyết khối sau xuất viện.
3. Các loại và sử dụng thuốc chống đông máu
Thuốc chống đông máu là phương pháp chính trong việc phòng ngừa và điều trị huyết khối trong nhiều thập kỷ.6 Dựa trên cơ chế hoạt động, chúng được phân thành nhiều loại.
Heparin là thuốc chống đông thực sự đầu tiên. Heparin tinh khiết, bao gồm heparin không phân đoạn (UFH, unfractionated heparin) và heparin trọng lượng phân tử thấp (LMWH, low-molecular weight heparin), hoạt động bằng cách thúc đẩy sự hình thành phức hợp protease-heparin-antithrombin trung gian, tạo điều kiện ức chế thrombin và yếu tố hoạt hóa X. Nó được sử dụng để phòng ngừa và điều trị của thuyên tắc huyết khối như DVT và PE, ở những bệnh nhân đang lọc máu, tuần hoàn ngoài cơ thể và phẫu thuật tim mạch và chỉnh hình và ở những ứng cử viên cho các thủ thuật xâm lấn như can thiệp mạch vành qua da. Chảy máu là một nhược điểm lớn của heparin cũng như giảm tiểu cầu (lên đến 30% bệnh nhân), rụng tóc, phản ứng tại chỗ tiêm và tăng kali máu.
Trong lịch sử, các chất đối kháng vitamin K như warfarin (dicoumarol) và các dẫn xuất coumarin khác là một trong những thuốc chống đông máu sớm nhất được chấp thuận sử dụng trên lâm sàng. Warfarin là chất ức chế cạnh tranh VKORC1, dẫn đến giảm tổng hợp ở gan các yếu tố đông máu phụ thuộc vitamin K như cũng như Protein C và Protein
S. Liệu pháp warfarin đòi hỏi phải theo dõi chặt chẽ do cửa sổ điều trị hẹp, tương tác thuốc và phạm vi dùng thuốc rộng cần thiết để duy trì tỷ lệ bình thường hóa điều trị quốc tế (INR, international normalised ratio).
Việc phát triển các thuốc chống đông máu đường uống trực tiếp (DOAC) đảm bảo tính an toàn cao hơn với hiệu quả cao hơn đòi hỏi theo dõi liều lượng ít hơn.12 Tác dụng ngoại ý không gây chảy máu của những thuốc này rất hiếm, nhưng bao gồm tổn thương gan nặng và rối loạn tiêu hóa.13 Một nhược điểm lớn của thuốc chống đông máu đường uống mới nằm ở chỗ hiện nay trên toàn cầu không có sẵn các tác nhân đảo ngược cụ thể. Trong khi idarucizumab và andexanet alfa là hai loại thuốc như vậy được chấp thuận sử dụng ở Hoa Kỳ cũng như EU, các tác nhân đảo ngược khác đang được phát triển.
Fondaparinux đã được chấp thuận sử dụng ở Hoa Kỳ vào năm 2001 như một chất ức chế gián tiếp yếu tố Xa, chất này có tác dụng chống đông máu bằng cách liên kết và hoạt hóa antithrombin.15 Độc tính của fondaparinux rất phức tạp do thời gian bán hủy dài của nó.
Việc lựa chọn thuốc chống đông máu lý tưởng cho bất kỳ bệnh nào cũng cần tính đến các yếu tố cụ thể khác nhau của từng bệnh nhân như tình trạng huyết khối cơ bản, ví dụ đột quỵ do thiếu máu cục bộ hoặc rung nhĩ, cũng như nguy cơ chảy máu chấp nhận được và sự hiện diện của các bệnh đồng mắc như bệnh gan hoặc thận.
4. Vai trò của thuốc chống đông máu trong PE
PE cấp tính có tỷ lệ tử vong cao tới 30% trong tháng đầu tiên, với tới 30% người sống sót bị tái phát hoặc tàn tật mãn tính.17,18 Với tỷ lệ mắc hàng năm dao động từ 0,2 đến 0,8/1000, PE đã được giả thuyết là có đa yếu tố căn nguyên.
PE cấp tính đảm bảo phân tầng rủi ro bắt buộc để xác định can thiệp điều trị thích hợp. Các mô hình như Chỉ số mức độ nghiêm trọng của thuyên tắc phổi (PESI, Pulmonary Embolism Severity Index) và điểm dự đoán rủi ro PESI đơn giản (sPESI, simplified-PESI) cung cấp một công cụ để xác định bệnh nhân có nguy cơ thấp và nguy cơ cao. Theo hướng dẫn của ESC, điều trị PE cấp tính nguy cơ cao bao gồm thở oxy sớm dưới hình thức thông khí nếu cần, đảm bảo ổn định huyết động và xử trí suy tim phải, bao gồm cả việc cần dùng thuốc vận mạch và hỗ trợ sự sống nâng cao trong các trường hợp nặng.
Các hướng dẫn của CHEST đưa ra các khuyến nghị cụ thể liên quan đến việc lựa chọn thuốc chống đông máu liên quan đến giai đoạn điều trị VTE.24 Trong giai đoạn cấp tính, việc sử dụng thuốc chống đông máu đường tiêm tác dụng nhanh như UFH, LMWH hoặc fondaparinux được khuyến khích. LMWH và fondaparinux được ưa thích hơn UFH do nguy cơ chảy máu thấp hơn. DOAC như apixaban cũng được chấp thuận để điều trị cấp tính DVT và PE.
Thuốc đối kháng vitamin K (VKA, Vitamin K antagonists) với INR điều trị được khuyến nghị từ 2 đến 3 (INR mục tiêu 2,5) hoặc DOAC như dabigatran hoặc rivaroxaban được ưu tiên sử dụng trong thời gian dài (ngoài 10 ngày) và kéo dài thời gian điều trị PE kéo dài hơn 3 tháng.23,24 Một số thử nghiệm lâm sàng quan trọng đánh giá VKA để điều trị dự phòng thứ phát kết luận như sau.
- Điều trị VKA nên được tiếp tục trong thời gian ít nhất 3 tháng.
- Nguy cơ tái phát VTE sau thời gian điều trị dự phòng ngắn hơn (3–6 tháng) cao hơn so với thời gian dài hơn 12–24 tháng.
Fernandes và cộng sự ước tính rằng kháng đông kéo dài có thể làm giảm nguy cơ tái phát VTE lên đến 95%.26 Tuy nhiên, lợi ích đó được bù đắp bằng việc tăng nguy cơ chảy máu.
5. Phổ bệnh của COVID-19
Các biểu hiện lâm sàng của COVID-19 có liên quan đến nhiều bệnh lý hô hấp lâm sàng, từ nhiễm trùng đường hô hấp trên ở mức độ nhẹ đến dạng bệnh nặng như viêm phổi nặng đe dọa tính mạng, hội chứng suy hô hấp cấp tính (ARDS), Nhiễm trùng huyết, rối loạn đông máu và tử vong ở một tỷ lệ đáng kể bệnh nhân.27 Ngoài bệnh lý đường hô hấp đặc trưng, bệnh này còn được thấy có liên quan đến các biểu hiện ngoài phổi.28 Hầu hết các biểu hiện nghiêm trọng của COVID-19 đều liên quan đến phản ứng viêm quá mức.
Mục tiêu ưu tiên của SARS-CoV-2 là biểu mô đường hô hấp, nơi nó chủ yếu xâm nhập qua thụ thể men chuyển 2 (ACE2) vào tế bào chủ.29 Tế bào phổi loại 2 chiếm khoảng 83% tế bào biểu hiện ACE2 của phổi. Nó cũng được biểu hiện ở tim, mạch, não, ruột và thận, có thể chịu trách nhiệm về cơ chế bệnh sinh của các biểu hiện ngoài phổi. Nhiễm SARS-CoV-2 gây ra giảm điều hòa ACE2, do đó làm tăng tính dễ bị tổn thương đối với các tác động gây hại của angiotensin 2 (chủ yếu do stress oxy hóa và viêm). Đáp ứng miễn dịch phóng đại và rối loạn điều hòa, rối loạn chức năng của các con đường trung gian ACE2, tổn thương nội mô do viêm huyết khối và tổn thương mô trực tiếp bởi các phần tử virus là những cơ chế có thể có của các biểu hiện ngoài phổi qua trung gian SARS-CoV-2.28 Các biểu hiện ngoài phổi thường được báo cáo của COVID-19 được mô tả trong bảng 1.
6. Bất thường đông máu trong COVID-19
Mặc dù các biểu hiện hô hấp là dấu hiệu của bệnh, trong nhiều tháng qua, một số lượng lớn các tài liệu cho thấy COVID-19, do SARS-CoV-2, có liên quan đến một số bất thường về đông máu có thể gây ra các biểu hiện huyết khối liên quan đến bệnh này như thuyên tắc huyết khối tĩnh mạch (VTE, venous thromboembolism) và PE.

Tang và cộng sự trong một nghiên cứu trên 183 bệnh nhân viêm phổi COVID-19 đã trình bày dữ liệu sơ cấp làm nổi bật những thay đổi trong các thông số đông máu ở những người sống sót và không sống sót.30 Sau khi phân tích thứ cấp dữ liệu này, chúng tôi đã ghi nhận sự gia tăng mạnh mẽ thời gian prothrombin (PT) thời gian thromboplastin một phần (aPTT), fibrinogen, d-dimer và các sản phẩm phân giải fibrin (FDP) và giảm mạnh nồng độ antithrombin ở những người không sống sót so với những người sống sót. Các thay đổi đã được lập thành bảng 2.
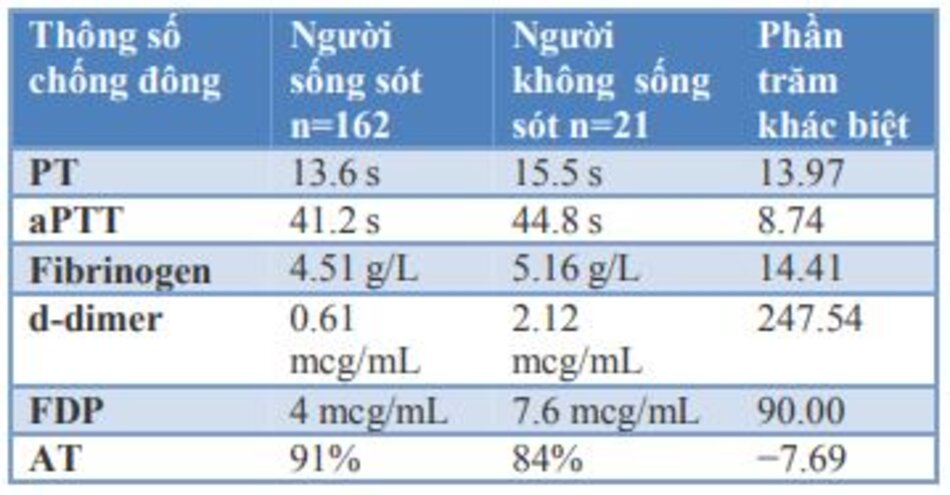
Một nghiên cứu trên 1561 bệnh nhân có COVID-19 đã được phòng thí nghiệm xác nhận bởi Yu và các đồng nghiệp cũng cho thấy sự gia tăng đáng kể của các thông số đông máu.31 Nghiên cứu báo cáo sự gia tăng 260,00% d-dimer ở những bệnh nhân mắc bệnh nặng, với mức dao động từ 0,9 đến 4,6 µg/mL với giá trị trung bình là 1,8mL. Những thay đổi trong các thông số đông máu khác nhau sau COVID-19 trong nghiên cứu này được mô tả trong bảng 2. Guan và cộng sự ghi nhận mức D-dimer tăng bất thường ở 260 (46,4%) trong số 560 trường hợp với tỷ lệ 43% và 60% ở những bệnh nhân người không ở đơn vị chăm sóc đặc biệt (ICU) nặng và bệnh nặng tương ứng.
Cơ chế chính xác của rối loạn chức năng đông máu ở bệnh nhân COVID-19 vẫn chưa được biết. SARS- CoV-2 không có bất kỳ hoạt tính đông máu nội tại nào. Một số giả thuyết đã được đưa ra để tìm hiểu sinh lý bệnh cơ bản đằng sau sự phát triển của trạng thái huyết khối trong COVID-19.33 Một giải thích có thể nghiên cứu tác động của nhiễm SARS-CoV-2 đối với các quá trình riêng lẻ liên quan đến bộ ba Virchow, cụ thể là tổn thương nội mô, ứ trệ dòng máu và trạng thái siêu đông.
Khả năng gây huyết khối của vi rút này chủ yếu là do tác động kết hợp của phản ứng viêm sâu cùng với viêm huyết khối và tổn thương nội mô. Coronavirus mới được báo cáo là gây rối loạn chức năng nội mô bằng con đường trung gian ACE2 với phản ứng viêm quá mức ở một số bệnh nhân, đặc biệt là những người bị bệnh nặng.4 COVID-19 cũng có liên quan đến tăng độ nhớt. Trong một nghiên cứu của Maier và cộng sự, tất cả 15 bệnh nhân được đánh giá đều cho thấy độ nhớt huyết tương lớn hơn 95% mức bình thường.34 Ức chế hệ thống plasminogen, rối loạn chức năng tiểu cầu và hoạt hóa bổ thể trong COVID-19 là một số yếu tố khác gây ra tình trạng tăng đông máu. Sử dụng catheter tĩnh mạch trung tâm và thở máy cùng với bất động kéo dài ở những bệnh nhân nặng đóng vai trò là các yếu tố nguy cơ bổ sung cho thuyên tắc huyết khối (TE, thromboembolism).
Mối liên quan có thể có giữa sự phát triển của các kháng thể kháng phospholipid, đặc biệt là thuốc chống đông máu lupus (LAC), và COVID-19 đã được xác định trong nhiều nghiên cứu, điều này cũng có thể góp phần làm tăng đông máu. Bowles và cộng sự đã tìm thấy sự hiện diện của LAC ở 31 trong số 34 bệnh nhân được chẩn đoán có aPTT cao.36 Harzallah và cộng sự đã báo cáo thêm 25 trường hợp dương tính với LAC trong số 56 bệnh nhân trong một nghiên cứu độc lập tại Mulhouse, Pháp.
Tỷ lệ mắc TE đã được báo cáo ở khoảng 20% –30% bệnh nhân trong một vài nghiên cứu, trong khi một số nghiên cứu khác đã báo cáo tỷ lệ này cao tới 70%.38 Một nghiên cứu từ Trung Quốc dự đoán rằng có tới 40% bệnh nhân có tỷ lệ này cao hơn theo Điểm dự đoán Nguy cơ phát triển DVT của Padua.39 Một nhóm nghiên cứu tiền cứu của Pháp đã báo cáo sự phát triển của PE mặc dù đã dùng kháng đông dự phòng ở 16,7% bệnh nhân.40 Một nghiên cứu của Hà Lan báo cáo tỷ lệ VTE là 27% mặc dù đã được điều trị dự phòng.41 Một nghiên cứu ở Ý cho thấy tỷ lệ VTE là 22,2%.
Bằng chứng về bệnh lý mạch máu và huyết khối cũng đã được thấy trong một số báo cáo về mô phổi mổ tử thi ở những bệnh nhân chết vì bệnh nặng. Ackermann và cộng sự đã kiểm tra bảy mẫu phổi của những bệnh nhân chết vì COVID-19 nghiêm trọng và thấy rằng, ngoài tổn thương phế nang lan tỏa và thâm nhiễm tế bào T quanh mạch, còn có tổn thương nội mô nghiêm trọng và tăng cường hình thành mạch cùng với huyết khối lan rộng trong mạch máu phổi.
Mối liên quan yếu cũng có thể có giữa các phương thức điều trị hiện tại đối với COVID-19 và đông máu. Tuy nhiên, bằng chứng trong lĩnh vực này còn thiếu nghiêm trọng. Corticosteroid đã được biết là làm tăng nguy cơ VTE. Tuy nhiên, thử nghiệm RECOVERY đã ủng hộ rất nhiều việc sử dụng corticosteroid liều thấp, cụ thể là dexamethasone, trong việc chống lại chứng viêm và ‘cơn bão cytokine’ thứ phát sau nhiễm trùng SARS-CoV-2.44 Cơ chế có thể được đề xuất là giảm fibrinogen và các yếu tố đông máu với một tăng các yếu tố chống đông máu. Một số nghiên cứu cũng đã cố gắng đánh giá tác dụng gây đông máu của remdesivir. Trong một nghiên cứu của Grein và cộng sự, 3 (5,66%) trong số 53 bệnh nhân được chẩn đoán với COVID- 19 phát triển DVT sau khi sử dụng remdesivir. Tuy nhiên, cần hiểu rõ hơn về vấn đề này.
7. Tử vong thứ phát sau rối loạn đông máu ở COVID-19
Tỷ lệ TE trong COVID-19 rất khác nhau trong các báo cáo được công bố khác nhau. Mức độ liên quan giữa tỷ lệ tử vong ở bệnh nhân COVID-19 và TE cũng là một vấn đề tranh luận. Các biểu hiện huyết khối tắc mạch có liên quan đến việc tăng tỷ lệ tử vong và bệnh tật ở bệnh nhân COVID-19 trong một số nghiên cứu.
Một nghiên cứu của Zhang và cộng sự cho thấy tỷ lệ tử vong cao hơn ở bệnh nhân COVID-19 với TE. Một nghiên cứu khác được thực hiện bởi Tang và cộng sự cho thấy mức độ d dimer và FDP cao hơn đáng kể tại thời điểm nhập viện trong nhóm không sống sót, do đó cho thấy tiên lượng kém hơn ở những bệnh nhân bị viêm phổi do coronavirus mới kèm theo rối loạn đông máu.47 Một phân tích tổng hợp do Malas và cộng sự thực hiện đã báo cáo tỷ lệ thuyên tắc huyết khối động mạch tổng thể (ATE) là 2%, tỷ lệ VTE là 21%, tỷ lệ DVT là 20% và tỷ lệ PE là 13% trong số những người bị nhiễm SARS-COV-2. Tỷ lệ ATE, VTE, DVT và PE tương ứng là 5%, 31%, 28% và 19% đối với bệnh nhân ICU.38 Họ cũng báo cáo rằng tỷ lệ tử vong tăng đáng kể theo TE (cao tới 74%).
Ngược lại, một nghiên cứu của Hippensteel và cộng sự không tìm thấy sự khác biệt đáng kể về tỷ lệ tử vong ở những bệnh nhân bị bệnh nặng, mặc dù họ nhận thấy tỷ lệ VTE cao hơn ở những bệnh nhân bị bệnh nặng với COVID-19.
Tuy nhiên, vì tất cả bệnh nhân mắc COVID-19 không được kiểm tra PE thường xuyên, do đó, tỷ lệ mắc và tử vong được báo cáo thứ phát sau đó, có thể khác với các số liệu được báo cáo.
8. Các thử nghiệm và hướng dẫn
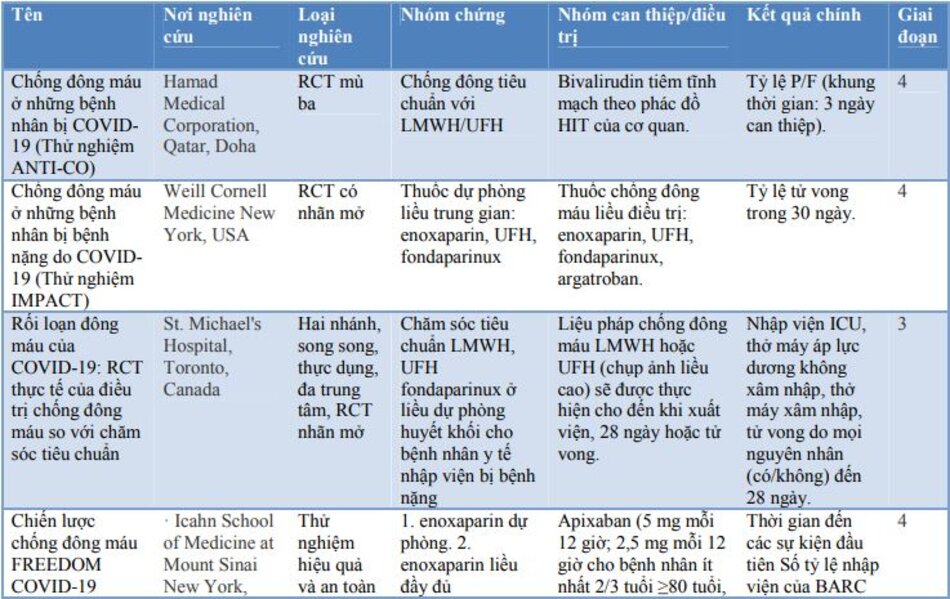
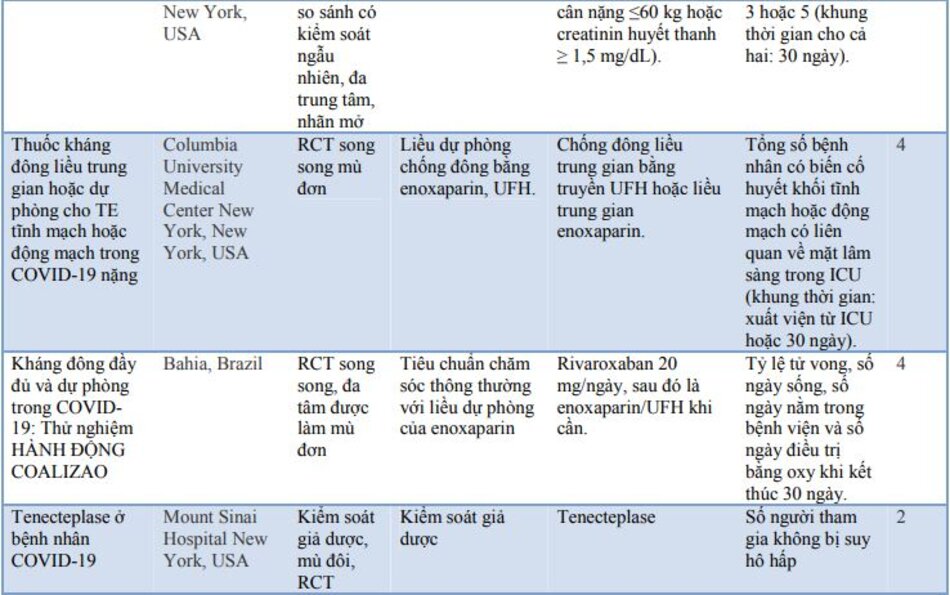
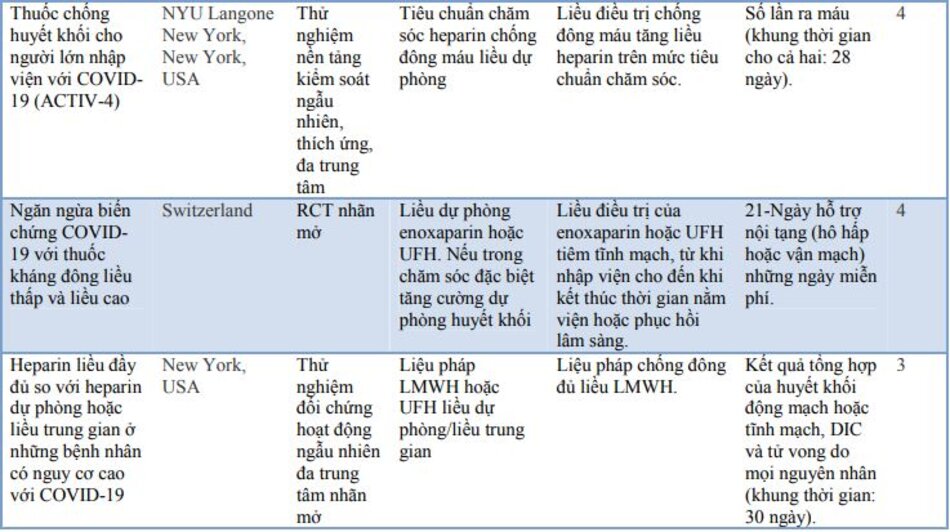
Các thử nghiệm đối chứng ngẫu nhiên (RCT) đang diễn ra vẫn chưa cung cấp bằng chứng cụ thể về vai trò cuối cùng của việc chống đông máu trong COVID-19, mặc dù kết quả rất hứa hẹn. Các RCT đang diễn ra đã được trình bày chi tiết trong bảng 3.
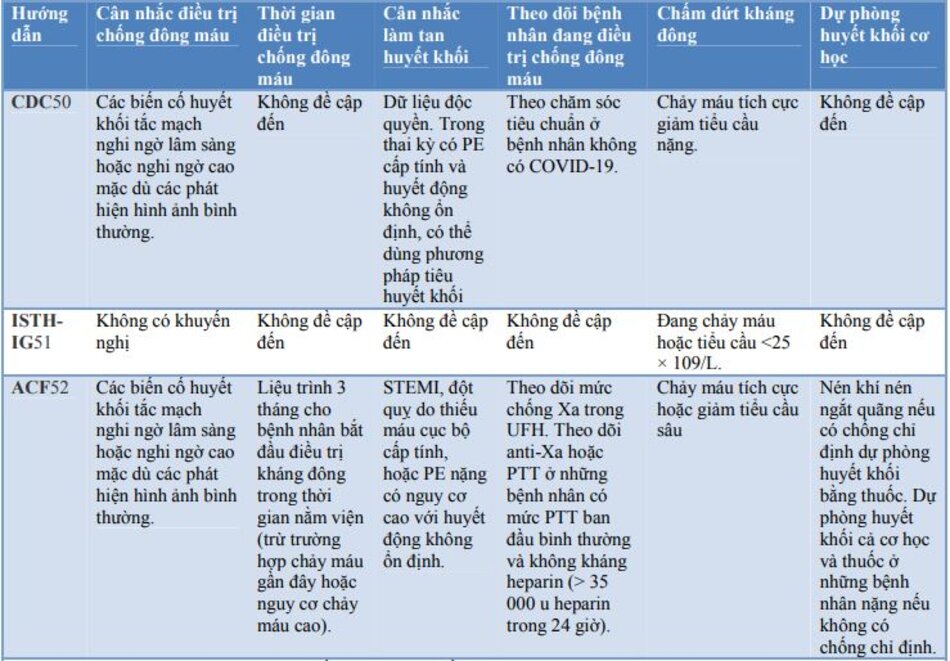
Một số hướng dẫn quốc tế đã được xây dựng về việc sử dụng chống đông máu trong COVID-19. Một số hướng dẫn nổi bật và các khuyến nghị tương ứng đã được trình bày trong bảng 4.
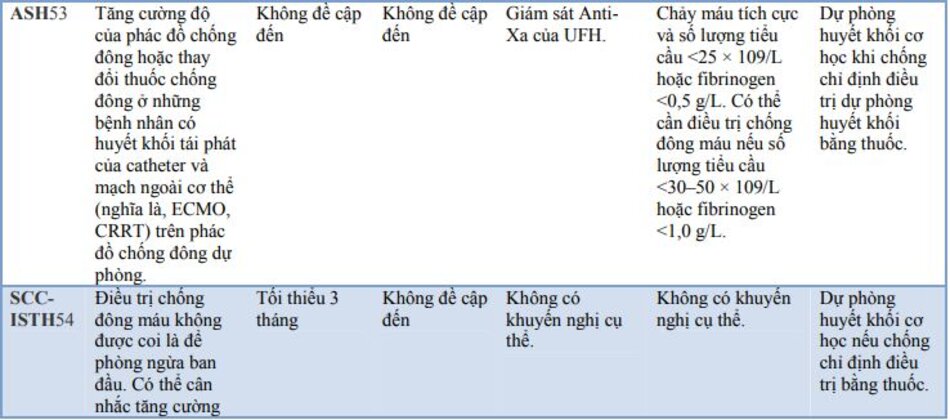
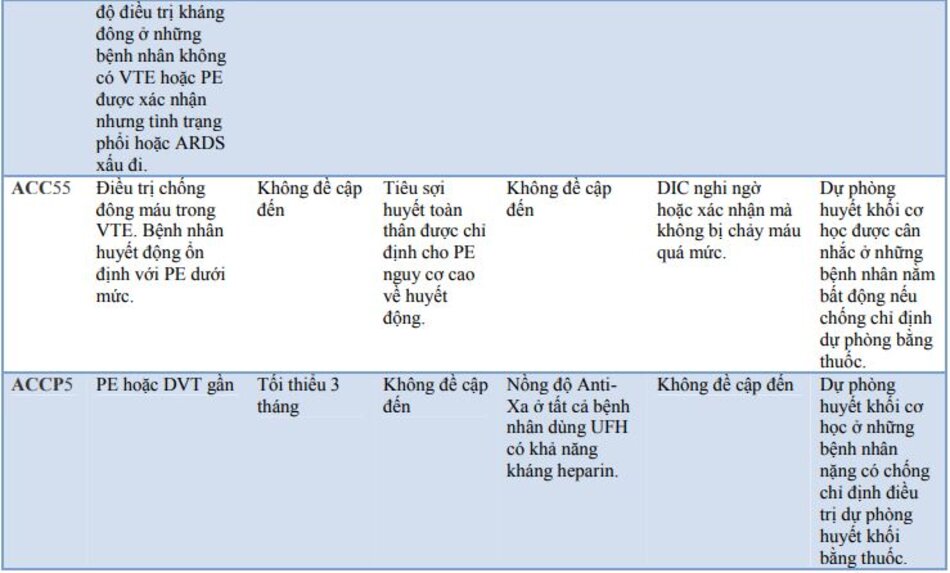
9.Thuốc chống đông máu trong COVID — sự đồng thuận hiện tại
Theo hiểu biết tốt nhất của chúng tôi, không có RCT đơn lẻ hoặc một nghiên cứu quan sát đáng tin cậy nào chưa được hoàn thành cũng như không được công bố nêu bật thời gian, liều lượng, sự lựa chọn và thời gian điều trị kháng đông ở bệnh nhân COVID-19. Tất cả các RCT đều đang diễn ra.49 Các hướng dẫn, được công bố trên phạm vi quốc tế cho đến khi, chỉ dựa trên các tuyên bố đồng thuận và ý kiến chuyên gia. Một số hướng dẫn này đề cập rõ ràng đến tỷ lệ chuyên gia trong hội đồng đồng ý với một khuyến nghị nhất định và tỷ lệ đề xuất ngược lại.
Do đó, chiến lược hữu ích hiện tại liên quan đến việc sử dụng thuốc chống đông máu trong COVID-19 đang tồn tại. Vùng xám này vẫn đang tiếp tục phát triển và do đó, đánh giá lâm sàng là cần thiết trong từng trường hợp cụ thể. Hạn chế chính của các hướng dẫn hiện có nằm ở việc thừa nhận COVID-19 là nguyên nhân gây ra vi thuyên tắc, dẫn đến tiên lượng xấu hơn của bệnh nhân, nhưng không thể đưa ra các tuyên bố đồng thuận hoặc hướng dẫn để giải quyết vấn đề này một cách thích hợp. Tất cả các hướng dẫn đều khuyến nghị dùng heparin với liều lượng điều trị chỉ ở những bệnh nhân được chẩn đoán hoặc nghi ngờ cao thuyên tắc huyết khối lớn (PE/DVT), trong khi bỏ qua vấn đề vi thuyên tắc không thể chẩn đoán được. Không có hệ thống tính điểm riêng biệt để đánh giá nguy cơ VTE khi nhập viện cụ thể đối với COVID-19. Mặc dù nồng độ d-dimer tăng cao đáng kể có nhiều khả năng liên quan đến VTE, nhưng tại thời điểm này, rất khó để xác định ngưỡng chỉ có thể được sử dụng để chẩn đoán huyết khối không xâm lấn. Thay vào đó, nên quyết định chẩn đoán hình ảnh thêm. dựa trên đánh giá lâm sàng tổng thể. d-dimer có thể hữu ích trong việc điều tra một VTE/PE cấp tính có thể xảy ra ở những bệnh nhân mới phát triển hoặc khó thở nặng hơn. Tuy nhiên, nó đã được chấp nhận rộng rãi rằng mặc dù mức d-dimer cao là một yếu tố tiên lượng xấu đã được chứng minh, nhưng nó không phải là hướng dẫn liều lượng hoặc lên thang thuốc chống đông máu. Một thử nghiệm ngẫu nhiên đơn trung tâm (n = 20) đã được thực hiện để so sánh hiệu quả của thuốc chống đông dự phòng và điều trị ở những bệnh nhân thở máy nặng với mức d-dimer cao (> 1000 µg/L).59 Họ cho thấy sự cải thiện đáng kể trong quá trình oxy hóa ở nhóm điều trị chống đông máu, mặc dù không có sự khác biệt nào được quan sát thấy ở cả hai nhóm về tỷ lệ tử vong tại bệnh viện hoặc tỷ lệ tử vong 28 ngày.
Hai loạt trường hợp nhỏ, một từ Viện Khoa học Y khoa Toàn Ấn Độ (AIIMS), Rishikesh và một trường hợp khác từ nước ngoài, đã thành công trong việc sử dụng chất hoạt hóa plasminogen mô tái tổ hợp (rTPA) trong tình trạng giảm oxy máu kháng trị trong ARDS (ngay cả trong trường hợp PE được chẩn đoán không chụp CT phổi). Tuy nhiên, cho đến nay vẫn chưa có hướng dẫn đồng thuận nào ủng hộ nỗ lực này. RCT về việc sử dụng rTPA đang diễn ra. Do đó, có phạm vi rất lớn cho đánh giá của ít hơn và không cần theo dõi aPTT (cần tiếp xúc với bệnh nhân).
bác sĩ lâm sàng trong khi tăng liều lượng thuốc chống đông máu cho đến khi có thêm dữ liệu. Hiện tại, sau khi xem xét tất cả các ý kiến chuyên gia và các tuyên bố đồng thuận, chúng tôi đã đưa ra kết luận như sau:
- Thuốc chống đông máu đường tiêm được chỉ định ở bất kỳ bệnh nhân nặng nhập viện nào. Do đó, nó được chỉ định trong các bệnh vừa, nặng và nguy kịch.
- LMWH/fondaparinaux được ưa chuộng hơn UFH, do nhân viên y tế tiếp xúc với bệnh nhân
Bệnh trung bình (bệnh nhân có nguy cơ tiêu chuẩn): liều dự phòng điều chỉnh theo cân nặng tiêu chuẩn (ví dụ: enoxaparin 40 mg x 1 lần/ngày cho người lớn 70 kg với CrCl> 30 mL/phút).
Bệnh nặng và nguy kịch (bệnh nhân nguy cơ cao: cần thông khí xâm nhập/thở áp lực dương liên tục (CPAP)/thông khí không xâm nhập (NIV)/oxy mũi dòng cao): LMWH liều trung gian (enoxaparin 40 mg hai lần mỗi ngày cho một Người lớn 70 kg với CrCl> 30 mL/phút).
Bệnh huyết khối lớn được chẩn đoán/nghi ngờ cao (PE/DVT): liều điều trị (enoxaparin 1 mg/kg tiêm dưới da 12 giờ một lần hoặc 1,5 mg/kg tiêm dưới da một lần mỗi ngày).
Suy thận: enoxaparin giảm liều được ưu tiên hơn các thuốc LMWH/fondaparinaux khác. UFH với theo dõi aPTT được chỉ định ở mức eGFR <15 mL/phút.
10. Dự phòng sau xuất viện trong COVID- 19
Dự phòng huyết khối sau xuất viện sau COVID-19 vẫn còn là một vấn đề còn nhiều tranh luận. Không khuyến cáo sử dụng thường quy thuốc chống đông máu ở tất cả bệnh nhân mắc COVID-19 tại thời điểm xuất viện. Các hướng dẫn của Trường Cao đẳng Bác sĩ Lồng ngực Hoa Kỳ được xuất bản trên CHEST cũng như các hướng dẫn của Trường Cao đẳng Tim mạch Hoa Kỳ được xuất bản trên Tạp chí của Trường Cao đẳng Tim mạch Hoa Kỳ (JACC) không làm sáng tỏ về dự phòng huyết khối sau xuất viện.
Tuyên bố đồng thuận của CHEST rõ ràng bác bỏ nó do thiếu bằng chứng. Tuy nhiên, hướng dẫn của NIH, được cập nhật vào ngày 11 tháng 2, cũng như hướng dẫn ISTH, hướng dẫn của BTS và SIGN (hướng dẫn của Scotland) đề cập đến việc điều trị dự phòng huyết khối sau xuất viện, dựa trên ý kiến chuyên gia.
Các quyết định liên quan đến kháng đông dự phòng sau xuất viện nên được cá nhân hóa. Dựa trên các khuyến nghị hiện tại cũng như các thử nghiệm trong quá khứ và đang diễn ra về việc sử dụng thuốc chống đông máu, chúng tôi có thể kết luận rằng những bệnh nhân mắc bệnh từ trung bình đến nặng và đáp ứng bất kỳ một trong các tiêu chí sau sẽ là ứng cử viên lý tưởng để điều trị dự phòng huyết khối sau xuất viện:
- Điểm IMPROVE VTE (MIV) được sửa đổi (bảng 5) ≥4
- MIV ≥2 với giá trị d-dimer> 2 lần giới hạn trên của phạm vi bình thường
- Tuổi ≥75 tuổi
- Tuổi> 60 với giá trị d-dimer> 2 lần giới hạn trên của giới hạn bình thường
- Tuổi từ 40–60 với giá trị d-dimer> 2 lần giới hạn trên của giới hạn bình thường và tiền sử VTE hoặc có bệnh lý ác tính được chẩn đoán
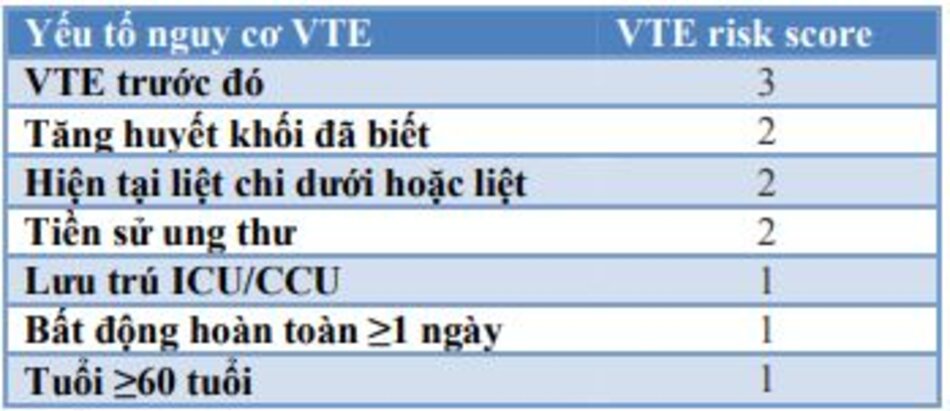
Do đó, các ứng viên được chọn phải được đánh giá về nguy cơ VTE bằng cách sử dụng điểm MIV.
Điểm này có thể được cân bằng với nguy cơ chảy máu bằng điểm VTE BLEED hoặc HASBLED. Nếu không xác định được nguy cơ chảy máu, bệnh nhân có thể được xuất viện trong điều trị dự phòng sau xuất viện. Không có vai trò của việc đo d-dimer định kỳ trong quá trình theo dõi sau xuất viện. DOAC không yêu cầu giám sát INR và do đó, được ưu tiên hơn VKA về mặt này. DOAC được ưu tiên bao gồm rivaroxaban (10 mg một lần một ngày), betrixaban (160 mg vào ngày đầu tiên, sau đó là 80 mg một lần một ngày) và apixaban (2,5 mg hai lần mỗi ngày) theo nghiên cứu.
Trong suy thận, warfarin được ưu tiên hơn DOAC với theo dõi INR. Tuy nhiên, ở mức eGFR 30–15 mL/phút, có thể sử dụng apixaban 2,5 mg hai lần mỗi ngày. Ở mức eGFR <15 mL/phút và bệnh nhân mắc chứng ESRD đang lọc máu, tốt hơn hết là tránh dùng DOAC. FDA đã phê duyệt apixaban 2,5 mg hai lần mỗi ngày với eGFR <15 mL/phút và 5 mg hai lần mỗi ngày ở bệnh nhân ESRD đang thẩm tách vì nó có thể lọc được một phần. Tuy nhiên, vì các hướng dẫn của Châu u phủ nhận việc sử dụng DOAC ở eGFR <15 mL/phút, nên tránh sử dụng các loại thuốc này trong tình huống lâm sàng như vậy có thể là điều khôn ngoan.
Về thời gian, FDA khuyến cáo sử dụng rivaroxaban (10 mg mỗi ngày) trong 31 đến 39 ngày và betrixaban (160 mg vào ngày đầu tiên, sau đó là 80 mg mỗi ngày một lần) trong 35 đến 42 ngày.50 ACC đề nghị điều trị dự phòng huyết khối kéo dài với LMWH hoặc DOAC trong thời gian tối đa là 45 ngày trong trường hợp có nguy cơ cao về VTE, chẳng hạn như mức d-dimer cao hơn hai lần giới hạn trên của mức bình thường hoặc sự hiện diện của ung thư đang hoạt động.55 SCC-ISTH đề xuất thời gian từ 14–30 ngày để dự phòng huyết khối.
11. Kết luận
Gia tăng tỷ lệ tử vong thứ phát sau COVID-19 đòi hỏi cần có các hướng dẫn dứt điểm về thời gian, lựa chọn, thời gian và liều lượng thuốc chống đông máu ở những bệnh nhân được chẩn đoán mắc loại coronavirus mới. Vì hầu hết các RCT cũng như các nghiên cứu quan sát đang diễn ra với nhiều hướng dẫn mâu thuẫn nhau, nên một chiến lược cụ thể vẫn chưa được đưa ra. Hầu hết các bác sĩ lâm sàng đã dựa vào sự thiên vị cá nhân trong việc điều trị bệnh nhân bằng thuốc chống đông máu, với các quyết định khác nhau tùy từng trường hợp theo hồ sơ bệnh nhân. Sau khi nghiên cứu kỹ lưỡng các giao thức hiện có, kiến thức hiện tại và các thử nghiệm đang diễn ra, chúng tôi đã xác định được các khu vực thiếu thông tin liên quan đến việc sử dụng thuốc chống đông máu trong quản lý COVID-19 và cố gắng tổng hợp tất cả các chiến lược hiện có để xây dựng một hướng dẫn duy nhất chỉ đạo điều trị chống đông máu. Chúng tôi khuyến nghị chống đông máu bằng enoxaparin trong các trường hợp COVID-19 vừa đến nặng cùng với điều trị dự phòng sau xuất viện để ngăn ngừa vi sinh vật chưa được chẩn đoán có thể xảy ra với các DOAC như rivaroxaban và apixaban. Chúng tôi khuyến khích nghiên cứu sâu hơn về các kết luận được rút ra ở trên và các khuyến nghị do chúng tôi đưa ra để giúp đối xử tốt hơn với nhân loại trong đại dịch này.
12. Thông điệp chính
- VTE thứ phát sau COVID-19 đã dẫn đến tử vong cao hơn.
- Phần lớn bệnh nhân có biểu hiện thuyên tắc huyết khối không được chẩn đoán sau COVID- 19.
- Nên sử dụng COVID-19 chống đông máu trong các trường hợp vừa đến nặng và nguy kịch.
- Enoxaparin là heparin trọng lượng phân tử thấp được ưa chuộng để chống đông máu trong giai đoạn cấp tính của huyết khối tĩnh mạch.
- Dự phòng sau xuất viện có thể được xem xét ở những bệnh nhân có nguy cơ cao bị biến cố huyết khối tắc mạch sau khi đánh giá nguy cơ chảy máu.
- Rivaroxaban và apixaban được ưu tiên dùng trong điều trị dự phòng sau xuất viện.
13. Câu hỏi nghiên cứu hiện tại
- Có nên khuyến cáo điều trị dự phòng sau xuất viện bằng thuốc chống đông máu cho tất cả bệnh nhân nhập viện điều trị COVID-19 không?
- Nếu có, thời gian điều trị dự phòng như vậy là bao lâu?
- Có nên sử dụng thuốc chống đông máu đường uống trực tiếp cho bệnh nhân suy thận COVID- 19 không?
14. Tài liệu tham khảo
1. ↵Wu Y, Ho W, Huang Y, et al. SARS-CoV-2 is an appropriate name for the new coronavirus. Lancet 2020;395:949–50.
2. ↵Miesbach W, Makris M. COVID-19: coagulopathy, risk of thrombosis, and the rationale for anticoagulation. Clin Appl Thromb Hemost 2020;26:107602962093814.
3. ↵Ahmed S, Zimba O, Gasparyan AY. Thrombosis in Coronavirus disease 2019 (COVID-19) through the prism of Virchow’s triad. Clin Rheumatol 2020;39:2529–43.
4. ↵Bourgonje AR, Abdulle AE, Timens W, et al. Angiotensin-converting enzyme 2 (ACE2), SARS-CoV-2 and the pathophysiology of coronavirus disease 2019 (COVID-19). J Pathol 2020;251:228–48.
5. ↵Moores LK, Tritschler T, Brosnahan S, et al. Prevention, diagnosis, and treatment of VTe in patients with coronavirus disease 2019: chest guideline and expert panel report. Chest 2020;158:1143–63.
6. ↵Wendelboe AM, Raskob GE. Global burden of thrombosis: epidemiologic aspects. Circ Res 2016;118:1340–7.
7. ↵Jackson CM. Mechanism of heparin action. Baillieres Clin Haematol 1990;3:483–504.
8. ↵Ahmed I, Majeed A, Powell R. Heparin induced thrombocytopenia: diagnosis and management update. Postgrad Med J 2007;83:575–82.
9. ↵Lim GB. Milestone 2: warfarin: from rat poison to clinical use. Nat Rev Cardiol 2017. doi:doi:10.1038/nrcardio.2017.172. [Epub ahead of print: 14 Dec 2017].
10. ↵Alquwaizani M, Buckley L, Adams C, et al. Anticoagulants: a review of the pharmacology, dosing, and complications. Curr Emerg Hosp Med Rep 2013;1:83–97.
11. ↵Harter K, Levine M, Henderson SO. Anticoagulation drug therapy: a review. West J Emerg Med 2015;16:11–17.
12. ↵Franchini M, Liumbruno GM, Bonfanti C, et al. The evolution of anticoagulant therapy. Blood Transfus 2016;14:175–84.
13. ↵Maura G, Billionnet C, Coste J, et al. Non-bleeding adverse events with the use of direct oral anticoagulants: a sequence symmetry analysis. Drug Saf 2018;41:881–97.
14. ↵Desai NR, Cornutt D. Reversal agents for direct oral anticoagulants: considerations for hospital physicians and intensivists. Hosp Pract 2019;47:113–22.
15. ↵LiverTox. Clinical and Research Information on Drug-Induced Liver Injury [Internet]. Bethesda, MD: National Institute of Diabetes and Digestive and Kidney Diseases, 2018.
16. ↵Schaefer JK, McBane RD, Wysokinski WE. How to choose appropriate direct oral anticoagulant for patient with nonvalvular atrial fibrillation. Ann Hematol 2016;95:437–49.
17. ↵Becattini C, Agnelli G, Lankeit M, et al. Acute pulmonary embolism: mortality prediction by the 2014 European Society of cardiology risk stratification model. Eur Respir J 2016;48:780–6.
18. ↵Klok FA, van der Hulle T, den Exter PL, et al. The post-PE syndrome: a new concept for chronic complications of pulmonary embolism. Blood Rev 2014;28:221–6.
19. ↵Andersson T, Söderberg S. Incidence of acute pulmonary embolism, related comorbidities and survival; analysis of a Swedish national cohort. BMC Cardiovasc Disord 2017;17:155.
20. ↵Blom JW, Doggen CJM, Osanto S, et al. Malignancies, prothrombotic mutations, and the risk of venous thrombosis. JAMA 2005;293:715–22.
21. ↵Cervera R, Piette J-C, Font J, et al. Antiphospholipid syndrome: clinical and immunologic manifestations and patterns of disease expression in a cohort of 1,000 patients. Arthritis Rheum 2002;46:1019–27.
22. ↵Duffett L, Castellucci LA, Forgie MA. Pulmonary embolism: update on management and controversies. BMJ 2020;370:m2177.
23. ↵Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European respiratory Society (ERS). Eur Heart J 2020;41:543–603.
24. ↵Kearon C, Akl EA, Comerota AJ, et al. Antithrombotic therapy for VTe disease: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of chest physicians evidence-based clinical practice guidelines. Chest 2012;141:e419S–96.
25. ↵Koehl JL, Hayes BD, Al-Samkari H, et al. A comprehensive evaluation of apixaban in the treatment of venous thromboembolism. Expert Rev Hematol 2020;13:155–73.
26. ↵Fernandes CJ, Calderaro D, Piloto B, et al. Extended anticoagulation after venous thromboembolism: should it be done? Ther Adv Respir Dis 2019;13:1753466619878556.
27. ↵Tu H, Tu S, Gao S, et al. Current epidemiological and clinical features of COVID-19; a global perspective from China. J Infect 2020;81:1–9.
28. ↵Gupta A, Madhavan MV, Sehgal K, et al. Extrapulmonary manifestations of COVID-19. Nat Med 2020;26:1017–32.
29. ↵Wang Q, Zhang Y, Wu L, et al. Structural and functional basis of SARS-CoV-2 entry by using human ACE2. Cell 2020;181:894–904.
30. ↵Tang N, Li D, Wang X, et al. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J ThrombHaemost 2020;18:844–7.
31. ↵Yu H-H, Qin C, Chen M, et al. D-dimer level is associated with the severity of COVID-19. Thromb Res 2020;195:219–25.
32. ↵Guan W-J, Ni Z-Y, Hu Y, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med 2020;382:1708–20.
33. ↵Henry BM, Vikse J, Benoit S, et al. Hyperinflammation and derangement of renin-angiotensin-aldosterone system in COVID- 19: a novel hypothesis for clinically suspected hypercoagulopathy and microvascular immunothrombosis. Clin Chim Acta 2020;507:167–73.
34. ↵Maier CL, Truong AD, Auld SC, et al. COVID-19-associated hyperviscosity: a link between inflammation and thrombophilia? Lancet 2020;395:1758–9.
35. ↵Marchandot B, Sattler L, Jesel L, et al. COVID-19 related coagulopathy: a distinct entity? J Clin Med 2020;9:1651.
36. ↵Bowles L, Platton S, Yartey N, et al. Lupus anticoagulant and abnormal coagulation tests in patients with Covid-19. N Engl J Med 2020;383:288–90.
37. ↵Harzallah I, Debliquis A, Drénou B. Lupus anticoagulant is frequent in patients with Covid-19. J ThrombHaemost 2020;18:2064–5.
38. ↵Malas MB, Naazie IN, Elsayed N, et al. Thromboembolism risk of COVID-19 is high and associated with a higher risk of mortality: a systematic review and meta-analysis. EClinicalMedicine 2020;29:100639.
39. ↵Wang T, Chen R, Liu C, et al. Attention should be paid to venous thromboembolism prophylaxis in the management of COVID-
19. Lancet Haematol 2020;7:e362–3.
40. ↵Akalin E, Azzi Y, Bartash R, et al. COVID-19 and kidney transplantation. N Engl J Med 2020;382:2475–7.
41. ↵Pereira MR, Mohan S, Cohen DJ, et al. COVID-19 in solid organ transplant recipients: initial report from the US epicenter. Am J Transplant 2020;20:1800–8.
42. ↵Alberici F, Delbarba E, Manenti C, et al. A single center observational study of the clinical characteristics and short-term outcome of 20 kidney transplant patients admitted for SARS-CoV2 pneumonia. Kidney Int 2020;97:1083–8.
43. ↵Ackermann M, Verleden SE, Kuehnel M, et al. Pulmonary vascular Endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med 2020;383:120–8.
44. ↵Mahase E. Covid-19: low dose steroid cuts death in ventilated patients by one third, trial finds. BMJ 2020;369:m2422. doi:10.1136/bmj.m2422pmid:http://www.ncbi.nlm.nih.gov/pubmed/32546467FREE Full TextGoogle Scholar
45. ↵Grein J, Ohmagari N, Shin D, et al. Compassionate use of Remdesivir for patients with severe Covid-19. N Engl J Med 2020;382:2327–36.
46. ↵Zhang L, Feng X, Zhang D, et al. Deep vein thrombosis in hospitalized patients with COVID-19 in Wuhan, China: prevalence, risk factors, and outcome. Circulation 2020;142:114–28.
47. ↵Tang N, Bai H, Chen X, et al. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost 2020;18:1094–9.
48. ↵Hippensteel JA, Burnham EL, Jolley SE. Prevalence of venous thromboembolism in critically ill patients with COVID-19. Br J Haematol 2020;190:e134–7.
49. ↵National Library of Medicine (US). Clinical trials, 2020. Available: https://www.ClinicalTrials.gov [Accessed 20 Nov 2020].
50. ↵COVID-19 Treatment Guidelines Panel. Coronavirus disease 2019 (COVID-19) treatment guidelines. National Institutes of Health.
51. ↵Thachil J, Tang N, Gando S, et al. ISTH interim guidance on recognition and management of coagulopathy in COVID-19. J Thromb Haemost 2020;18:1023–6.
52. ↵Barnes GD, Burnett A, Allen A, et al. Thromboembolism and anticoagulant therapy during the COVID-19 pandemic: interim clinical guidance from the anticoagulation forum. J Thromb Thrombolysis 2020;50:72–81.
53. ↵American Society of Hematology. COVID-19 and coagulopathy.
54. ↵Spyropoulos AC, Levy JH, Ageno W, et al. Scientific and standardization Committee communication: clinical guidance on the diagnosis, prevention, and treatment of venous thromboembolism in hospitalized patients with COVID-19. J Thromb Haemost 2020;18:1859–65.
55. ↵Bikdeli B, Madhavan MV, Jimenez D, et al. COVID-19 and thrombotic or thromboembolic disease: implications for prevention, antithrombotic therapy, and follow-up: JACC state-of-the-art review. J Am Coll Cardiol 2020;75:2950–73.
56. ↵Tritschler T, Mathieu M-E, Skeith L, et al. Anticoagulant interventions in hospitalized patients with COVID-19: a scoping review of randomized controlled trials and call for international collaboration. J Thromb Haemost 2020;18:2958–67.
57. ↵Flaczyk A, Rosovsky RP, Reed CT, et al. Comparison of published guidelines for management of coagulopathy and thrombosis in critically ill patients with COVID 19: implications for clinical practice and future investigations. Crit Care 2020;24:559. doi:10.1186/s13054-020-03273-ypmid:http://www.ncbi.nlm.nih.gov/pubmed/32938471PubMedGoogle Scholar
58. ↵George PM, Barratt SL, Condliffe R, et al. Respiratory follow-up of patients with COVID-19 pneumonia. Thorax 2020;75:1009–16.
59. ↵Lemos ACB, do Espírito Santo DA, Salvetti MC, et al. Therapeutic versus prophylactic anticoagulation for severe COVID-19: a randomized phase II clinical trial (HESACOVID). Thromb Res 2020;196:359–66.
60. ↵Goyal A, Saigal S, Niwariya Y, et al. Successful use of tPA for thrombolysis in COVID related ARDS: a case series. J Thromb Thrombolysis 2021;51:293–6.
61. ↵Bts guidance on venous thromboembolic disease in patients with COVID-19.
62. ↵COVID-19 position statement: the prevention and management of thromboembolism in hospitalised patients with COVID-19- related disease.
63. ↵Spyropoulos AC, Lipardi C, Xu J, et al. Modified improve VTe risk score and elevated D-dimer identify a high venous thromboembolism risk in acutely ill medical population for extended thromboprophylaxis. TH Open 2020;4:e59–65.
64. ↵Cohen AT, Harrington RA, Goldhaber SZ, et al. Extended thromboprophylaxis with Betrixaban in acutely ill medical patients. N Engl J Med 2016;375:534–44.