Tác giả: Thạc sĩ, Bác sĩ Hồ Hoàng Kim – Bệnh viện Nguyễn Tri Phương
Tóm tắt
Chảy máu liên quan đến tăng áp lực tĩnh mạch cửa và rối loạn đông máu là một biến chứng thường gặp ở bệnh nhân xơ gan. Các biến chứng và xử trí chảy máu là một nguồn đáng kể chi phí chăm sóc sức khỏe và sử dụng, cũng như tỷ lệ mắc bệnh và tử vong. Do khan hiếm bằng chứng xung quanh các chiến lược truyền máu và can thiệp cầm máu ở bệnh nhân xơ gan, đã có nhiều tranh luận về phương pháp tốt nhất. Dữ liệu mới nổi gần đây cho thấy bằng chứng ủng hộ việc truyền các tế bào hồng cầu lắng đến ngưỡng hemoglobin 7–8 g/ dL là rất mạnh. Các chất chủ vận thụ thể thrombopoietin (TPO) đã cho thấy nhiều hứa hẹn trong việc tăng mức độ tiểu cầu và giảm truyền máu trước khi thực hiện các thủ – phẫu thuật, mặc dù chưa được phát hiện cụ thể là làm giảm nguy cơ chảy máu. Dữ liệu về truyền máu có hướng dẫn của xét nghiệm viscoelastic (VET- viscoelastic testing) có vẻ thuận lợi cho việc giảm nhu cầu truyền máu trước các thủ thuật nhỏ và trong quá trình ghép gan. Các yếu tố nội môi huyết học như yếu tố VIIa tái tổ hợp, phức hợp prothrombin cô đặc, và axit tranexamic đã được nghiên cứu nhưng vai trò của chúng trên bệnh nhân xơ gan chưa rõ ràng. Các lĩnh vực khác ngày càng được quan tâm bao gồm tỷ lệ cân bằng và truyền máu toàn phần. Trong bài luận sau đây, chúng tôi tóm tắt những bằng chứng cập nhật nhất về truyền máu toàn phần có hướng dẫn, hướng dẫn dưới VET, tỷ lệ cân bằng và cũng như việc sử dụng các chất cầm máu ở bệnh nhân xơ gan để cung cấp hướng dẫn thực hành cho các bác sĩ lâm sàng.
Chảy máu đường tiêu hóa trên (UGIB) dẫn đến gần 300 000 ca nhập viện và 15000–30 000 ca tử vong mỗi năm ở Hoa Kỳ. [1] Chảy máu đường tiêu hóa trên liên quan đến tăng áp lực tĩnh mạch cửa là một biến chứng nghiêm trọng ở bệnh nhân xơ gan. UGIB do tăng áp cửa đại diện cho 60% –65% các trường hợp UGIB ở bệnh nhân xơ gan và có liên quan đến tỷ lệ tử vong lên đến 30% trong lần nhập viện ban đầu của họ. [2,3] Chảy máu nói chung cũng chiếm một phần đáng kể của chi phí chăm sóc sức khỏe và tính hiệu quả như tỷ lệ mắc và tỷ lệ tử vong ở những bệnh nhân bị bệnh gan mãn tính.
Tất cả các yếu tố đông máu, ngoại trừ yếu tố Von Willebrand và Yếu tố VIII có nguồn gốc từ nội mô, đều do gan sản xuất; do đó, xơ gan có thể dẫn đến nhiều bất thường đông máu có thể phát hiện được trên nhiều loại xét nghiệm thường được sử dụng. Thrombopoietin, chất điều hòa chính của sản xuất tiểu cầu, cũng được tổng hợp ở gan. Điều này cùng với tình trạng lách to do tăng áp lực tĩnh mạch cửa thường dẫn đến giảm tiểu cầu đặc trưng của bệnh gan.[4] Trong vài thập kỷ gần đây, ngày càng có nhiều nhận thức rằng việc giảm nồng độ chất tạo đông trong xơ gan cũng đi kèm với giảm nồng độ chất chống đông máu; một khái niệm được gọi là “cân bằng lại cầm máu”.[5,6] Những tình trạng sinh lý này làm phức tạp khả năng của chúng ta trong việc giải thích các xét nghiệm đông máu cơ bản trong phòng xét nghiệm ở bệnh nhân xơ gan và xử trí thích hợp các biến cố xuất huyết cấp tính liên quan đến xơ gan.
Do thiếu bằng chứng xung quanh các chiến lược truyền máu ở bệnh nhân xơ gan, đã có nhiều tranh luận về phương pháp tốt nhất. Tiêu chuẩn chăm sóc hiện tại bao gồm truyền máu dựa theo ngưỡng: Hướng dẫn thực hành của Hiệp hội Nghiên cứu Bệnh gan Hoa Kỳ (AASLD) khuyến nghị sử dụng các ngưỡng truyền máu truyền thống (huyết sắc tố ngưỡng 7 g/ dL).[2] Có rất ít dữ liệu liên quan đến việc sử dụng ngưỡng truyền máu thích hợp để giải quyết tình trạng rối loạn đông máu trong bệnh gan, cũng như quản lý giảm tiểu cầu dựa theo ngưỡng.[7] Hiện tại, một số chiến lược truyền máu được áp dụng bao gồm truyền máu theo ngưỡng, xét nghiệm độ đàn hồi cục máu (VET), tỷ lệ cân bằng, và truyền máu toàn phần. Một số chất cầm máu cũng đã được nghiên cứu ở bệnh nhân xơ gan. Do thiếu bằng chứng và hướng dẫn rõ ràng, chúng tôi xem xét những gì hiện đã biết và nêu bật các lĩnh vực cho nghiên cứu tiềm năng trong tương lai.
Chiến lược truyền máu dựa theo ngưỡng
Truyền hemoglobin dựa theo ngưỡng trong trường hợp chảy máu cấp tính là tiêu chuẩn chăm sóc hiện tại theo khuyến cáo của AASLD.[2] Một thử nghiệm ngẫu nhiên có đối chứng gần đây (RCT) trên những bệnh nhân bị chảy máu GI cho thấy rằng một chiến lược hồng cầu lắng “hạn chế” (pRBC) (ngưỡng hemoglobin 7 g/ dL) có liên quan đến việc giảm tỷ lệ tử vong đáng kể so với chiến lược truyền máu “tự do” (ngưỡng hemoglobin là 9 g/ dL). Một phân tích nhóm nhỏ của RCT này cho thấy tỷ lệ tái xuất huyết sớm và tỷ lệ tử vong ở bệnh nhân xơ gan thấp hơn đáng kể, đặc biệt là những bệnh nhân có Child-Turcotte-Pugh loại A và B.[8] Do đó, các hướng dẫn hiện hành khuyến cáo truyền máu với mục tiêu 7– 8 g/ dL ở bệnh nhân xơ gan [9,10]; tuy nhiên, vẫn không có hướng dẫn sử dụng các sản phẩm máu dựa trên huyết tương khác (Bảng 1). Hơn nữa, truyền các sản phẩm máu có thể làm tăng áp lực cửa hoặc thay đổi các thông số đông máu ở bệnh nhân xơ gan, do đó làm tăng nguy cơ chảy máu thêm hoặc dẫn đến chảy máu lại [11,12]. Cuối cùng, trong khi một số cung cấp truyền pRBC trước phẫu thuật với các ngưỡng nhất định, phương pháp này không được nghiên cứu kỹ hoặc thực hành phổ biến.
| Bảng 1. Tóm tắt các khuyến cáo về truyền máu của các tổ chức & hiệp hội | |
| Hiệp hội | Hướng dẫn thực hành |
| Hiệp hội tiêu hóa Hoa Kỳ (AGA) 2019 | Cập nhật thực hành lâm sàng: đông cầm máu trong xơ gan |
| Các xét nghiệm toàn bộ về sự hình thành cục máu đông, chẳng hạn như đo đàn hồi huyết khối quay (ROTEM), đo độ đàn hồi huyết khối, đo lưu biến huyết khối và tạo thrombin, có thể có vai trò trong việc đánh giá quá trình đông máu ở bệnh nhân xơ gan, nhưng hiện tại vẫn thiếu các giá trị mức mục tiêu đã được xác nhận.
Nói chung, các bác sĩ lâm sàng không nên điều chỉnh thường quy tình trạng giảm tiểu cầu và rối loạn đông máu trước khi tiến hành các thủ thuật điều trị nguy cơ thấp, chọc dò lồng ngực và nội soi thường quy trên để cột thắt tĩnh mạch ở bệnh nhân có bất thường đông máu do rối loạn chức năng tổng hợp của gan. Nên sử dụng ít các sản phẩm máu vì chúng làm tăng áp lực tĩnh mạch cửa và có nguy cơ gây quá tải tuần hoàn do truyền máu, tổn thương phổi cấp tính liên quan đến truyền máu, lây truyền bệh nhiễm trùng, rối loạn miễn dịch và/ hoặc phản ứng truyền máu. Các ngưỡng mục tiêu truyền máu sau đây để xử trí chảy máu đang hoạt động hoặc các thủ thuật có nguy cơ cao có thể tối ưu hóa sự hình thành cục máu đông trong bệnh gan tiến triển: hematocrit > 25%, số lượng tiểu cầu > 50.000, và fibrinogen > 120 mg/ dL. Các ngưỡng được sử dụng phổ biến để hiệu chỉnh tỷ lệ chuẩn hóa quốc tế không được chứng minh bằng bằng chứng. Chất đồng vận thrombopoietin là một thay thế tốt cho truyền tiểu cầu, nhưng cần thời gian (khoảng 10 ngày) để nâng cao mức tiểu cầu. Thể tích lớn huyết tương tươi đông lạnh cần thiết để đạt được mục tiêu tỷ lệ chuẩn hóa quốc tế (INR) tùy ý, các giới hạn của mục tiêu thông thường, tác dụng tối thiểu đối với việc tạo thrombin, và các tác dụng phụ lên áp lực tĩnh mạch cửa hạn chế đáng kể công dụng của tác nhân này. Phức hợp yếu tố prothrombin 4 cô đặc chứa cả yếu tố đông và chống đông máu cung cấp một phương pháp điều trị với khối lượng thấp đáng hấp dẫn để cân bằng lại hệ thống cầm máu bị rối loạn. Tuy nhiên, liều lượng một phần dựa trên tỷ lệ chuẩn hóa quốc tế, đây là vấn đề ở bệnh xơ gan, và kinh nghiệm được công bố về bệnh gan còn hạn chế. Liệu pháp chống tiêu sợi huyết có thể được xem xét ở những bệnh nhân bị chảy máu dai dẳng do rỉ niêm mạc hoặc chảy máu vết thương do bị suy giảm tính toàn vẹn của cục máu đông. Cả axit ε-aminocaproic và axit tranexamic đều ức chế sự hòa tan cục máu đông. Cả hai đều không được cho là tạo ra trạng thái tăng đông, mặc dù cả hai đều có thể làm trầm trọng thêm huyết khối đã có từ trước |
|
| Hiệp hội tiêu hóa Hoa Kỳ (AGA) 2019 | Cập nhật thực hành lâm sàng về đánh giá rủi ro phẫu thuật và quản lý chu phẫu trong xơ gan. |
| INR không dự đoán được biến chứng chảy máu ở bệnh nhân xơ gan, và truyền huyết tương tươi đông lạnh “dự phòng” trước phẫu thuật không được khuyến cáo…
Các nghiên cứu cắt ngang trong phòng thí nghiệm và hồi cứu đã chỉ ra rằng số lượng tiểu cầu trên 50000/ μL là đủ để cho phép hình thành cục máu đông ở hầu hết bệnh nhân xơ gan. Truyền máu dự phòng để nâng số lượng tiểu cầu lên mức cao hơn không có lợi và có thể khiến bệnh nhân gặp phải các biến chứng khi truyền, quá tải thể tích hoặc huyết khối bất ngờ. Mức độ fibrinogen thấp có liên quan đến tăng nguy cơ chảy máu và nồng độ <100 mg/ dL có liên quan đến nguy cơ ức chế sự hình thành cục máu đông ở bệnh nhân xơ gan … Mặc dù chưa có thử nghiệm đối chứng nào về hiệu quả của truyền fibrinogen ở bệnh nhân xơ gan, có vẻ hợp lý về mặt sinh lý học để bổ sung lượng fibrinogen bằng cách truyền kết tủa lạnh trước các thủ thuật phẫu thuật có nguy cơ cao để tạo cơ sở cho sự hình thành cục máu đông đầy đủ. Nếu có, xét nghiệm độ đàn hồi nên được xem xét trước và trong quá trình phẫu thuật ở bệnh nhân xơ gan để giúp định hướng chiến lược truyền máu hợp lý. |
|
| Hiệp hội Nghiên cứu về Gan của Châu Âu (EASL) 2018 | Hướng dẫn thực hành lâm sàng cho việc quản lý bệnh nhân xơ gan mất bù |
| Một chiến lược truyền máu hạn chế được khuyến cáo ở hầu hết bệnh nhân có ngưỡng hemoglobin để truyền là 7 g/dL và khoảng mục tiêu là 7-9 g/ dL; Bằng chứng I; Lớp 1.
[liên quan đến LVP] không có dữ liệu hỗ trợ việc sử dụng dự phòng huyết tương tươi đông lạnh, các tiểu cầu pool, mặc dù chúng được sử dụng ở nhiều trung tâm khi hoạt động prothrombin dưới 40% và số lượng tiểu cầu <40000 / ll. LVP nên tránh khi có đông máu nội mạch lan tỏa. |
|
| Hiệp hội Nghiên cứu Bệnh gan Hoa Kỳ (AASLD) 2016 | Chảy máu do tăng áp cửa trong xơ gan: phân tầng nguy cơ, chẩn đoán và xử trí: Hướng dẫn thực hành năm 2016 |
| Việc truyền PRBC nên được thực hiện một cách thận trọng, bắt đầu truyền khi hemoglobin khi đạt ngưỡng khoảng 7 g/ dL với mục tiêu duy trì nó trong khoảng 7 đến 9 g/ dL.
Về việc điều chỉnh rối loạn đông máu, RCT của yếu tố tái tổ hợp VIIa không cho thấy lợi ích rõ ràng, và do đó việc điều chỉnh tỷ lệ chuẩn hóa quốc tế (INR) bằng cách sử dụng huyết tương tươi đông lạnh hoặc yếu tố VIIa không được khuyến khích, đặc biệt vì INR không phải là một chỉ số đáng tin cậy tình trạng đông máu trong xơ gan. Không có khuyến nghị nào có thể được đưa ra liên quan đến việc truyền tiểu cầu ở những bệnh nhân bị xuất huyết do tăng áp cửa. |
|
| Baveno VI faculty 2015 | Đồng thuận mở rộng trong tăng áp lực tĩnh mạch cửa, Báo cáo của Hội thảo Đồng thuận Baveno VI: Phân tầng nguy cơ và cá nhân hóa chăm sóc tăng áp lực tĩnh mạch cửa |
| Việc truyền khối hồng cầu lắng nên được thực hiện một cách thận trọng ở mức hemoglobin mục tiêu từ 7 đến 8 g/ dL, mặc dù chính sách truyền máu ở từng bệnh nhân cũng cần xem xét các yếu tố khác như rối loạn tim mạch, tuổi tác, tình trạng huyết động và tình trạng chảy máu đang diễn ra. Mức chứng cứ 1b; Lớp A
Không thể đưa ra các khuyến nghị về quản lý rối loạn đông máu và giảm tiểu cầu trên cơ sở dữ liệu hiện có. Bằng chứng cấp độ 5; Lớp D PT/ INR không phải là một chỉ số đáng tin cậy về tình trạng đông máu ở bệnh nhân xơ gan. Mức chứng cứ 1b; Lớp A |
|
| Hiệp hội Huyết học Châu Âu (EHA) và các tổ chức khác năm 2006 | Khuyến cáo về việc sử dụng yếu tố VII hoạt hóa tái tổ hợp như một phương pháp điều trị bổ trợ cho chảy máu lượng nhiều. |
| Dựa trên bằng chứng hiện có, rFVIIa không nên được sử dụng cho bệnh nhân xơ gan Child- Pugh A. Bằng chứng hạng B
Ở bệnh nhân xơ gan Child-Pugh B và C, hiệu quả của rFVIIa ở những bệnh nhân có các đợt chảy máu (chảy máu thực quản và UGI, và chảy máu sau sinh thiết kim qua da) là không chắc chắn. Bằng chứng hạng C |
|
Giảm tiểu cầu và thrombopoitein kích thích sản xuất tiểu cầu
Giảm tiểu cầu là một biến chứng thường gặp trong bệnh gan. Sự phát triển của giảm tiểu cầu ở bệnh xơ gan là do nhiều yếu tố và bao gồm do cường lách và giảm sản xuất yếu tố tăng trưởng tạo tiểu cầu thrombopoietin (TPO) ở gan.[13] Hiện chưa có sự nhất trí về giá trị ngưỡng thích hợp để truyền tiểu cầu ở bệnh nhân xơ gan nhưng các bác sĩ lâm sàng thường truyền cho bệnh nhân xơ gan với ngưỡng 50.000 trong trường hợp chảy máu hoặc một thủ thuật xâm lấn sắp tới.[14,15] Một yếu tố khác làm phức tạp các khuyến nghị về truyền tiểu cầu là số lượng tiểu cầu không phản ánh chức năng tiểu cầu. Chức năng tiểu cầu, đặc biệt ở bệnh nhân xơ gan, có thể bị ảnh hưởng tiêu cực bởi vô số các yếu tố như thuốc men, nhiễm trùng và độ thanh thải của thận. Một nghiên cứu đã quan sát thấy rằng sản xuất thrombin liên quan đến tiểu cầu trong ống nghiệm (như một biện pháp gián tiếp của chức năng tiểu cầu) là đủ ở những bệnh nhân xơ gan có mức tiểu cầu ít nhất 56000.[16] Tuy nhiên, không có thử nghiệm lâm sàng nào cho thấy ngưỡng 50000 là mục tiêu thích hợp để ngăn ngừa chảy máu. Liên quan đến chọc dò dẫn lưu, một nghiên cứu tiến cứu trên 1100 ca dẫn lưu thể tích lớn ghi nhận không có biến chứng chảy máu cần truyền máu trước hoặc sau thủ thuật mặc dù số lượng tiểu cầu thấp đến 19000.[17] Như vậy, AASLD không khuyến nghị sử dụng dự phòng thường quy huyết tương hoặc tiểu cầu tươi đông lạnh trước khi chọc dò.[18] Cuối cùng, quyết định truyền tiểu cầu phải luôn được cân nhắc trước nguy cơ sản xuất kháng thể tiểu cầu, phản ứng truyền máu và khả năng tăng áp lực tĩnh mạch cửa.
Thrombopoietin, kích thích chính để tạo huyết khối, được tổng hợp bởi gan và bị phân hủy bởi các tiểu cầu lưu thông. Sự gắn kết của TPO với thụ thể TPO tạo ra một loạt các phản ứng tế bào dẫn đến tăng sinh và biệt hóa megakaryocytic (tế bào mẫu tiểu cầu) và do đó tạo ra tiểu cầu.[19] Bệnh nhân xơ gan được phát hiện có mức TPO huyết thanh thấp hơn so với nhóm chứng khỏe mạnh.[20] Chất chủ vận thụ thể TPO đã cho thấy hứa hẹn trong việc tăng lượng tiểu cầu ở bệnh nhân xơ gan và ngăn ngừa việc truyền tiểu cầu để đạt được ngưỡng 50000. Avatrombopag và Lusutrombopag hiện là hai chất chủ vận thụ thể TPO dùng đường uống duy nhất được FDA chấp thuận.
Trong ADAPT-1 và ADAPT-2, nhóm Avatrombopag so với nhóm giả dược đã giảm đáng kể tiêu chí chính của nghiên cứu về truyền tiểu cầu hoặc thủ thuật cấp cứu chảy máu.[21] Lusutrombopag đã được nghiên cứu ở bệnh nhân giảm tiểu cầu với bệnh nhân xơ gan Child-Pugh A hoặc B trải qua một thủ thuật xâm lấn không khẩn cấp. Có nhiều bệnh nhân hơn đáng kể trong nhóm Lusutrombopag không cần truyền tiểu cầu trước khi làm thủ thuật hoặc liệu pháp cấp cứu chảy máu sau thủ thuật so với nhóm giả dược .[22] Dựa trên những nghiên cứu này, thuốc chủ vận thụ thể TPO đã chứng minh làm giảm truyền tiểu cầu nhưng không làm giảm chảy máu. Cuối cùng, việc sử dụng các chất chủ vận thụ thể TPO bị hạn chế bởi tác dụng bắt đầu chậm ( 5 ngày hoặc hơn trước khi mức tiểu cầu tăng lên với đỉnh cao từ 12–14 ngày) và do đó có thể cần lập kế hoạch.[23]
PT/INR và huyết tương tươi đông lạnh
Xét nghiệm protime (PT) được phát triển vào năm 1935 như một phương tiện để kiểm tra rối loạn đông máu liên quan đến vàng da tắc nghẽn.[24] Tỷ lệ chuẩn hóa quốc tế (INR) được giới thiệu vào năm 1984 như một phương tiện chuẩn hóa kết quả để cải thiện tính an toàn của thuốc chống đông máu đường uống. Trong nhiều năm, PT/ INR đã trở thành xét nghiệm được lựa chọn để kiểm tra các chứng rối loạn đông máu bẩm sinh hoặc mắc phải và cũng như một cách để theo dõi điều trị bằng thuốc kháng vitamin K. Hiện đã có thêm tài liệu cho thấy INR ở bệnh nhân xơ gan có thể không dự đoán được biến chứng chảy máu.[25] Xét nghiệm Protime đáp ứng với sự thiếu hụt nhiều yếu tố đông máu (VII, X, C, II, và fibrinogen). Trong bệnh gan, xét nghiệm này trở nên khó giải thích vì không chỉ các yếu tố đông máu giảm mà các yếu tố chống đông máu như antithrombin, protein C và protein S cũng giảm. Các hướng dẫn đồng thuận trong cả tài liệu về gây mê hồi sức và X quang can thiệp, mặc dù không đặc hiệu cho bệnh nhân bệnh gan, vẫn khuyến cáo truyền máu dựa trên ngưỡng để đạt được mục tiêu INR trước khi làm thủ thuật. Các hướng dẫn của Hiệp hội X quang can thiệp khuyến cáo truyền máu để đạt được mục tiêu INR < 1,5 đối với các thủ thuật có nguy cơ chảy máu trung bình đến đáng kể và INR < 2,0,[26]. Nhiều nhà cung cấp chọn không sử dụng dựa theo ngưỡng INR cho các trường hợp bệnh nhân xơ gan. Cuối cùng, không có bằng chứng hỗ trợ điều chỉnh dự phòng INR tăng cao trước khi thực hiện dẫn lưu dịch thể tích lớn.[17]
Huyết tương tươi đông lạnh (FFP) thường được sử dụng để điều chỉnh rối loạn đông máu ở những bệnh nhân có INR cao. Các nghiên cứu in vitro đã đánh giá hiệu quả điều chỉnh rối loạn đông máu ở bệnh xơ gan. Một nghiên cứu đã đánh giá sự tạo thrombin in vitro trong plasmas từ bệnh nhân xơ gan khi trộn với lượng thích hợp huyết tương bình thường gộp chung (PNP). Tuy nhiên, các tác giả nhận thấy rằng huyết tương rút ngắn thời gian kéo dài thrombin, sự hình thành thrombin vẫn không thay đổi ngay cả khi trộn với PNP. Nghiên cứu này đặt ra câu hỏi về ý nghĩa của việc rút ngắn PT và APTT do FFP gây ra nếu quá trình hình thành thrombin trong ống nghiệm không thay đổi đáng kể. [27] Một nghiên cứu khác gần đây đã kiểm tra tiềm năng thrombin nội sinh với thrombomodulin sau khi truyền FFP ở bệnh nhân xơ gan.[28] Mặc dù, họ thấy truyền FFP cải thiện các xét nghiệm đông máu thông thường và tăng cường tạo thrombin ở một số rất hạn chế bệnh nhân, 34% trường hợp đã giảm tạo thrombin để đáp ứng với truyền FFP. Nhóm suy đoán rằng truyền FFP có thể làm giảm quá trình tạo thrombin bằng cách bổ sung protein C, đưa ra một lý do khác chống lại việc truyền FFP dựa trên các ngưỡng PT và APTT tùy ý. Hiện tại, AASLD và Hiệp hội Tiêu hóa Hoa Kỳ (AGA) không khuyến cáo sử dụng FFP như một phần của việc quản lý chảy máu do tăng áp lực tĩnh mạch cửa hoặc để dự phòng trước phẫu thuật hoặc trước khi tiến hành nội soi; Cơ sở lý luận là INR không phải là một chỉ số đáng tin cậy về tình trạng đông máu ở bệnh xơ gan. [29,30] Cuối cùng, truyền máu với FFP cũng có nguy cơ tăng áp lực tĩnh mạch cửa và tăng thể tích máu.[31]
Fibrinogen
Fibrinogen là một glycoprotein được tổng hợp trong tế bào gan. Khi fibrinogen được phân tách thành fibrin, nó sẽ liên kết với các tiểu cầu và thúc đẩy sự hình thành cục máu đông. Mức fibrinogen bình thường hoặc tăng nhẹ ở bệnh nhân xơ gan nhẹ hoặc trung bình; tuy nhiên, những bệnh nhân xơ gan nặng, đặc biệt là những bệnh nhân xơ gan mất bù, thường bị giảm.[32] Rối loạn chức năng gan gây ra những thay đổi trong chức năng fibrinogen bằng cách tổng hợp fibrinogen bất thường, được gọi là rối loạn fibrinogen huyết (dysfibrinogenemia), giảm sản xuất fibrinogen và tăng tiêu sợi huyết, như mô tả dưới đây. Dysfibrinogenemia đã được phát hiện ở 76% bệnh nhân xơ gan.[34] Các nghiên cứu gần đây cho thấy rằng những thay đổi này đối với phân tử fibrinogen là nguyên nhân giảm tính thấm của cục máu đông được hình thành so với đối chứng và thậm chí có thể tạo ra tính năng siêu đông tụ. [35]
Fibrinogen thấp ngày càng được công nhận là một yếu tố nguy cơ độc lập làm tăng chảy máu ở bệnh nhân xơ gan. Trong một nghiên cứu trên những bệnh nhân xơ gan được nhận vào ICU, fibrinogen và tiểu cầu đã giảm đáng kể so với những bệnh nhân ICU khác. Tỷ lệ các biến cố chảy máu lớn tăng lên ở bệnh nhân xơ gan và mức fibrinogen dưới 60 mg/ dL.[32] Trong một nghiên cứu trên toàn quốc ở Vương quốc Anh về việc sử dụng máu ở bệnh nhân xơ gan nhập viện, fibrinogen được phát hiện là một yếu tố tiên lượng độc lập về tử vong , với tỷ lệ tử vong tăng 29% cho mỗi 1 g/ L (100 mg/ dL) giảm fibrinogen.[36] Nồng độ fibrinogen thấp có liên quan đến tăng nguy cơ chảy máu sau khi cột thắt tĩnh mạch nội soi dự phòng.[37] Các nghiên cứu về ghép gan cũng đề nghịsử dụng nồng độ fibrinogen như một yếu tố dự báo cho việc truyền máu quá nhiều trong phẫu thuật.[38]
Việc duy trì mức fibrinogen trên 100–120 mg/ dL đã được một số hiệp hội và nhóm chuyên gia đề xuất trong trường hợp mất máu cấp tính.[39,40] Bù fibrinogen bằng kết tủa lạnh thường được ưu tiên hơn huyết tương tươi đông lạnh do liên quan đến thể tích truyền lớn. Tuy nhiên, những khuyến cáo này chưa được nghiên cứu đầy đủ trong một thử nghiệm lâm sàng và vẫn chưa rõ mức fibrinogen thích hợp. Hơn nữa, các mức ngưỡng fibrinogen và khuyến cáo truyền máu chưa được điều chỉnh cho bệnh nhân xơ gan và rối loạn fibrinogen huyết. Các nghiên cứu sâu hơn được đảm bảo để đạt được mục tiêu fibrinogen thích hợp cho bệnh nhân xơ gan và công dụng của tủa lạnh đối với mất máu cấp tính và dự phòng thủ thuật.
Các yếu tố cầm máu
Yếu tố VII hoạt hóa tái tổ hợp
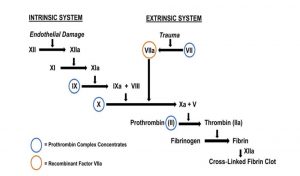
Yếu tố VIIa hoạt hóa tái tổ hợp (rFVIIa) ban đầu được phát triển và chấp thuận để điều trị các đợt chảy máu ở bệnh nhân ưa chảy máu A phức tạp bằng kháng thể kháng allo yếu tố VIII. rFVII được cho là hoạt động tại các vị trí tổn thương mạch máu thông qua việc tạo ra thrombin và hình thành fibrin (Hình 1).[41] Cơ sở lý luận đằng sau việc thử nghiệm rFVIIa trong bệnh gan là mặc dù rối loạn đông máu được cho là “cân bằng”, sự cân bằng này không ổn định và có thể dễ bị nghiêng về hướng chảy máu hoặc huyết khối hoặc khác bởi các tác nhân nhỏ. [5,42] Các nghiên cứu mù đôi, ngẫu nhiên gần đây nhất về bệnh nhân xơ gan có xuất huyết tiêu hóa trên và chảy máu tĩnh mạch thực quản không cho thấy tác dụng tổng thể của rFVIIa đối với việc ngừng chảy máu , giảm tỷ lệ chảy máu lại hoặc tỷ lệ tử vong trong thời gian ngắn.[43,44] Tuy nhiên, điều thú vị là ở những bệnh nhân bị chảy máu tĩnh mạch thực quản, những bệnh nhân được dùng rFVIIa so với giả dược có tỷ lệ tử vong trong 42 ngày thấp hơn đáng kể. Do đó, các hướng dẫn đồng thuận gần đây nhất về việc sử dụng rFVIIa như một phương pháp điều trị bổ trợ cho chảy máu lượng lớn kết luận rằng rFVIIa không được khuyến cáo cho bệnh nhân xơ gan Child-Pugh A (bằng chứng cấp B); tuy nhiên, việc sử dụng ở những bệnh nhân bị bệnh gan tiến triển hơn là không chắc chắn (bằng chứng cấp C).[45]
rVFIIa cũng đã được nghiên cứu như một tác nhân dự phòng trước khi ghép gan. Mặc dù với những hứa hẹn ban đầu, nhiều nghiên cứu RCT đã không thấy lợi ích nào về nhu cầu truyền máu chu phẫu với rVFIIa.[48] Tương tự, kết quả phân tích tổng hợp [49,50] cũng như tổng quan Cochrane [51] không tìm thấy sự khác biệt về tỷ lệ tử vong hoặc nhu cầu truyền máu giữa bệnh nhân dùng rFVIIa hoặc giả dược trước khi ghép gan. Cuối cùng, sự nhiệt tình đối với rVFIIa đã suy yếu kể từ khi nó được giới thiệu vào năm 2005 khi chất cô đặc phức hợp prothrombin (PCC) với yếu tố VII trở nên sẵn có.
Phức hợp cô đặc prothrombin (PCC)
Phức hợp prothrombin cô đặc (PCC) là chất cô đặc có hoạt tính cầm máu có chứa các yếu tố II, IX và X và một lượng thay đổi của yếu tố VII với nồng độ yếu tố đông máu tổng thể cuối cùng cao hơn khoảng 25 lần so với huyết tương bình thường (Hình 1).[52] PCC được phát hiện là không kém hơn so với FFP trong trường hợp đảo ngược khẩn cấp tình trạng thiếu hụt yếu tố đông máu mắc phải do thuốc đối kháng vitamin K gây ra xuất huyết nặng cấp tính.[53] Yếu tố bổ sung khiến PCC hấp dẫn hơn FFP là tốc độ PCC có thể được sử dụng, do thực tế rằng nó không yêu cầu kết hợp hoặc rả đông và thể tích truyền tương đối nhỏ. Các hướng dẫn về điều trị chống đông máu tại lồng ngực năm 2012 khuyến cáo PCC thay vì FFP để đảo ngược nhanh chóng tình trạng chống đông máu đối với xuất huyết nặng liên quan đến vitamin K (VKA) . [54]
Vai trò của PCC chưa được xác định rõ ở những bệnh nhân bị rối loạn đông máu liên quan đến xơ gan và chảy máu nhiều. Trong khi bằng chứng và hướng dẫn về chủ đề này rất khan hiếm, Ủy ban Cố vấn Quốc gia (NAC) về Máu và Sản phẩm Máu của Canada không khuyến nghị PCC cho bệnh rối loạn đông máu liên quan đến rối loạn chức năng gan.[55] Một thử nghiệm ngẫu nhiên có đối chứng đa trung tâm hiện đang được tiến hành để giải quyết liệu PCC so với giả dược trước khi phẫu thuật sẽ làm giảm nhu cầu truyền máu ở bệnh nhân xơ gan được ghép gan hay không.[56] Phần còn lại của tài liệu về PCC ở bệnh nhân xơ gan chỉ giới hạn trong các nghiên cứu hồi cứu và báo cáo trường hợp, với các nghiên cứu về việc sử dụng nó trong các trường hợp xuất huyết cấp tính thậm chí còn hiếm hơn. Các tài liệu cho thấy PCC làm giảm INR hiệu quả ở bệnh nhân xơ gan nhưng vẫn chưa rõ liệu điều này có tương quan với việc giảm chảy máu hay không.[57,58] Kwon và cộng sự đã nghiên cứu hồi cứu những bệnh nhân xơ gan đã được điều trị dự phòng bằng PCC, FFP và rVFIIa. Họ phát hiện ra rằng những người đã nhận PCC có ít pRBC và truyền tiểu cầu hơn đáng kể và tỷ lệ quá tải thể tích thấp hơn so với FFP.[59] Về các tác dụng phụ, PCC có liên quan đến tăng nguy cơ thuyên tắc huyết khối [60] và DIC [61] và không rõ tại thời điểm này liệu bệnh nhân xơ gan có nguy cơ cao hơn do tình trạng đông máu của họ. Vai trò chính xác và tính an toàn của PCC ở bệnh nhân xơ gan vẫn chưa được biết rõ.
Tranexamic acid
Ngoài việc giảm sản xuất các yếu tố chống đông máu và tiền đông máu, tăng phân hủy sợi huyết đã được phát hiện là biến chứng rối loạn đông máu của bệnh gan. Goodpasture ban đầu quan sát thấy quá trình tiêu sợi huyết tự phát ở bệnh nhân xơ gan vào năm 1914 và kể từ đó sự tồn tại của tăng tiêu sợi huyết ở bệnh nhân bệnh gan tiến triển đã được hỗ trợ thêm bởi phân tích các sản phẩm phân giải fibrin và D-dimer. Có tranh cãi có hay không tình trạng tăng ly giải sợi huyết liên quan trực tiếp đến chảy máu tiêu hóa ở bệnh nhân xơ gan vì tất cả các nghiên cứu cố gắng giải quyết vấn đề này đều bị hạn chế bởi tính chất hồi cứu và kích thước mẫu nhỏ. [34,64,65]
Axit tranexamic (TXA) là một chất chống tiêu sợi huyết tổng hợp, ức chế sự chuyển đổi plasminogen thành plasmin bằng cách ngăn chặn sự liên kết của plasminogen với fibrin. Nó đã được chứng minh là làm giảm truyền máu ở những bệnh nhân trải qua phẫu thuật cấp cứu hoặc khẩn cấp, [66,67] giảm mất máu sau sinh và ngăn ngừa xuất huyết sau sinh và truyền máu.[68] Dựa trên phân tích tổng hợp Cochrane năm 2015 ở bệnh nhân UGIB cấp tính, TXA dường như có một tác động có lợi đối với tỷ lệ tử vong; tuy nhiên, một số thử nghiệm có tỷ lệ bỏ cuộc cao, hạn chế tính hợp lệ của những phát hiện này.[69] Họ khuyến nghị thêm các nghiên cứu tiền cứu, ngẫu nhiên, mù đôi để xác định tác động của TXA trong trường hợp UGIB cấp tính. Một số thử nghiệm ngẫu nhiên có đối chứng đang được tiến hành để xác định liệu TXA có làm giảm hiệu quả tình trạng chảy máu, tái chảy máu hoặc tử vong trong UGIB ở tất cả các bệnh nhân [70] và bệnh nhân xơ gan hay không.[71]
Liên quan đến ghép gan, các thử nghiệm ngẫu nhiên có đối chứng đã chứng minh hiệu quả của TXA dự phòng trong việc giảm lượng máu mất và nhu cầu truyền máu khoảng 30% –40% so với giả dược.[72,73] Một tổng quan hệ thống và phân tích tổng hợp các RCT không tìm thấy sự khác biệt lớn về biến chứng huyết khối tĩnh mạch, huyết khối động mạch gan, hoặc tử vong sau phẫu thuật; tuy nhiên, các nghiên cứu chưa đủ hiệu quả. [74] Một tổng quan hệ thống của Cochrane năm 2011 không tìm thấy sự khác biệt đáng kể về tỷ lệ tử vong trong 60 ngày, không chức năng ghép chính, tái ghép hoặc các đợt huyết khối giữa TXA và giả dược.[51] Tuy nhiên, các tác giả kết luận rằng tất cả các thử nghiệm có nguy cơ sai lệch cao. Tính không đồng nhất cũng là một yếu tố hạn chế do các kỹ thuật ghép và kết quả giữa các lần thử nghiệm. Dựa trên dữ liệu hiện có, TXA dự phòng có vẻ có lợi trong việc giảm mất máu và giảm nhu cầu truyền máu trong OLT; tuy nhiên, cần có các nghiên cứu sâu hơn để xác định rõ hơn các tác dụng ngoại ý, liều dùng tối ưu và lựa chọn bệnh nhân. Axit Epsilon Aminocaproic (EACA) là một chất chống tiêu sợi huyết thay thế được sử dụng lần đầu tiên trong OLT vào những năm 1960 nhưng chưa được nghiên cứu rộng rãi trong dân số này như TXA. Vào năm 2000, một nghiên cứu RCT đã so sánh việc sử dụng dự phòng TXA, EACA và giả dược trước OLT. EACA làm giảm nhu cầu truyền máu nhưng không có ý nghĩa thống kê so với giả dược, trong khi TXA đã làm giảm đáng kể tỷ lệ tiêu sợi huyết và truyền máu trong phẫu thuật.[73] Cuối cùng, aprotinin, một chất chống tiêu sợi huyết khác, đã cho thấy hứa hẹn trong việc giảm nhu cầu truyền máu trong OLT,[75] đã bị thu hồi ở một số quốc gia do liên quan đến nó với tỷ lệ tử vong cao hơn.[76]
Hướng dẫn truyền máu dựa theo test kiểm tra độ đàn hồi cục máu
Xét nghiệm co cục máu đồ (VET) là một kỹ thuật đánh giá quá trình cầm máu bằng cách sử dụng máu toàn phần, có tính đến chức năng tiểu cầu, sự hình thành huyết khối, độ bền kéo của cục máu đông và sự tiêu sợi huyết. Có ba hình thức VET chính: đàn hồi huyết khối đồ (TEG-thromboelasography), đo quay đàn hồi huyết khối (ROTEM-thromboelasometry), và sonorheometry. TEG và ROTEM được sử dụng rộng rãi nhất và chia sẻ các nguyên tắc tương tự: Trong TEG, máu toàn phần được quay trong cốc có chốt treo (Hình 2) và trong ROTEM, máu toàn phần được giữ trong cốc cố định có trung tâm, chốt xoay. Mặt khác, sonorheometry sử dụng xung siêu âm nhưng hiện thiếu dữ liệu được công bố để sử dụng trong bệnh gan.[77] Xét nghiệm độ đàn hồi cục máu là một xét nghiệm chức năng nhanh chóng, chính xác hơn trong việc dự đoán nguy cơ chảy máu của bệnh nhân xơ gan hơn INR hoặc thời gian prothrombin. [25,78]
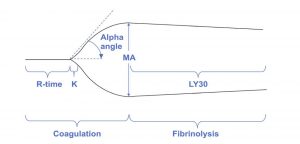
Hình 2 cho thấy biểu đồ mẫu của xét nghiệm TEG bao gồm các thông số phổ biến được sử dụng để định lượng kết quả. Thời gian R là thời gian cho đến khi cục máu đông đạt đến (giây) đường kính 2 mm và tương ứng với thời gian hình thành fibrin đầu tiên. Thời gian K là thời gian cho đến khi cục máu đông đạt (giây) đường kính 20 mm và tương ứng với chức năng tiểu cầu và liên kết chéo fibrin. Biên độ tối đa (MA) đề cập đến đường kính cục máu đông tối đa (mm) và tương ứng với tổng chức năng của tiểu cầu, fibrinogen và các yếu tố. Góc alpha đề cập đến tiếp tuyến của đồ thị khi cục máu đông dày 2 mm (D) và tương ứng với tốc độ hình thành cục máu đông fibrin. LY30 đề cập đến đường kính cục máu đông sau 30 phút và tương ứng với quá trình tiêu sợi huyết.[77]
VET đã rất hữu ích trong việc ghép gan và được sử dụng rộng rãi tại các trung tâm ghép gan để hướng dẫn truyền huyết tương tươi đông lạnh, tiểu cầu và tủa lạnh trong quá trình phẫu thuật rộng rãi nơi đông máu có thể diễn tiến nặng và luôn thay đổi. Truyền máu có sự hướng dẫn của VET làm giảm nhu cầu truyền các sản phẩm máu trong quá trình ghép gan so với truyền dựa trên tiêu chuẩn chuẩn.[79,80] Các nghiên cứu cũng chỉ ra rằng VET đã được kiểm tra ngay trước khi ghép gan với MA < 47 mm có độ nhạy 90% và độ đặc hiệu 72% để dự đoán bệnh nhân có cần truyền khối lượng lớn > 10 pRBC trong 24 giờ sau đó hay không.[81]
Mở rộng từ việc sử dụng VET chỉ trong phẫu thuật ghép gan, truyền máu có hướng dẫn VET cũng có thể làm giảm số lần truyền sản phẩm máu trước khi thực hiện các thủ thuật nhỏ hơn như đặt đường truyền trung tâm, chọc dò dẫn lưu dịch, TIPS, cột thắt búi giãn tĩnh mạch, chọc dò dẫn lưu lồng ngực, sinh thiết gan hoặc ERCP như so với tỷ lệ truyền máu có hướng dẫn chăm sóc chuẩn.[82] Nhóm VET nhận được các sản phẩm máu khi thời gian R kéo dài ngoài phạm vi bình thường của xét nghiệm (12–26 phút) ở > 40 phút hoặc MA thấp hơn phạm vi bình thường của xét nghiệm (42–63 mm) ở <30 mm. Đối với tiêu chuẩn của nhóm chăm sóc, bệnh nhân nhận được FFP và INR > 1,8 hoặc tiểu cầu khi giá trị <50000. Với việc giảm số lượng các sản phẩm máu trong truyền có hướng dẫn của VET, cũng có một số phản ứng truyền máu giảm. Tỷ lệ chảy máu nói chung là cực kỳ thấp trong các thủ thuật chảy máu nguy cơ thấp ở cả hai nhóm.
Gần đây, một thử nghiệm đối chứng ngẫu nhiên về bệnh xơ gan có chảy máu tĩnh mạch cấp tính được truyền các sản phẩm máu dựa trên việc truyền máu có hướng dẫn của VET là 13,3% so với tiêu chuẩn chăm sóc có hướng dẫn là 100%. Tỷ lệ chảy máu lại tương tự ở 5 ngày sau khi chảy máu cấp tính, nhưng ít hơn đáng kể ở 42 ngày chảy máu và tử vong trong 6 tuần thấp hơn ở nhóm truyền máu có hướng dẫn của VET.[83] Những phát hiện này có thể là do áp lực tĩnh mạch cửa thấp hơn từ truyền sản phẩm máu ít hơn; ủng hộ việc có một hướng dẫn truyền máu hạn chế hơn ở bệnh nhân xơ gan. Hiện tại, những hạn chế đối với việc sử dụng các chiến lược truyền máu theo hướng dẫn VET bao gồm không có tiêu chuẩn hoặc hướng dẫn để cung cấp truyền máu dựa trên các giá trị VET và thiếu các thông số rủi ro đã được xác thực trong các nghiên cứu hiện có.
Tỷ lệ cân bằng huyết tương, tiểu cầu và khối hồng cầu lắng
Nhiều mô hình thực hành trong xử trí sốc mất máu đã được hướng dẫn bởi nghiên cứu trong các tài liệu về chấn thương. Vào giữa những năm 2000, chiến lược “hồi sức kiểm soát tổn thương” đã được đề xuất để tránh rối loạn đông máu và hạn chế tác dụng phụ của can thiệp điều trị quá mức của hồi sức trong sốc mất máu.[84] Chiến lược này bao gồm kiểm soát nguồn chảy máu nhanh chóng, sử dụng sớm tỷ lệ cân bằng giữa huyết tương, tiểu cầu và pRBC (để bắt chước nồng độ toàn phần trong máu), hạn chế quá nhiều dịch tinh thể, và ngăn ngừa hạ thân nhiệt và rối loạn điện giải. Hiện nay, việc truyền máu cho bệnh nhân chấn thương với tỷ lệ sản phẩm máu là 1: 1: 1 hoặc 1: 1: 2 của huyết tương: tiểu cầu: pRBC đã trở nên phổ biến. Gần đây hơn, một thử nghiệm lâm sàng ngẫu nhiên (thử nghiệm Tỷ lệ tiểu cầu và huyết tương tối ưu thực tế, ngẫu nhiên (PROPPR)) đã nghiên cứu tỷ lệ sản phẩm máu 1: 1: 1 so với 1: 1: 2 ở bệnh nhân chấn thương và nhận thấy rằng mặc dù không có sự khác biệt trong tử vong, nhiều bệnh nhân trong nhóm 1: 1: 1 cầm máu được nhiều hơn và ít tử vong do mất máu hơn trong vòng 24 giờ .[85]
Dữ liệu hỗ trợ một tỷ lệ cố định, hoặc ít nhất là FFP nhiều hơn và tỷ lệ tiểu cầu trên pRBC cao hơn đang xuất hiện trong tài liệu OLT. Trong một nghiên cứu hồi cứu đơn trung tâm về những người OLT có nhu cầu truyền pRBC trong phẫu thuật, những người nhận FFP: tiểu cầu: pRBC với tỷ lệ > 1: 1: 2 so với tỷ lệ < 1: 1: 2 có nhu cầu về pRBC và chế phẩm máu trong phẫu thuật thấp hơn, cải thiện tỷ lệ tử vong trong 1 tháng và tỷ lệ sống trong 1 năm.[86] Dữ liệu của họ cho thấy rằng truyền máu cân bằng có thể quan trọng hơn ở những bệnh nhân cần truyền máu lượng lớn (hơn 7–10 đơn vị pRBC), phù hợp với dữ liệu từ thử nghiệm PROPPR.[85]
Tỷ lệ cân bằng giữa huyết tương, tiểu cầu và pRBC vẫn chưa được nghiên cứu như một chiến lược hồi sức ở bệnh nhân xơ gan có sốc mất máu. Do khuynh hướng của bệnh nhân xơ gan sẽ chảy máu GI ồ ạt, chiến lược truyền máu theo tỷ lệ cân bằng có thể là một cách tiếp cận hợp lý khi cần nhiều hơn 7–10 đơn vị pRBC. Cần tiến hành điều tra bổ sung để đánh giá tiện ích của phương pháp này đối với dân số xơ gan và cũng như nghiên cứu các kết quả bất lợi tiềm ẩn. Một nghiên cứu gần đây về những bệnh nhân được nhận vào ICU với GIB (bao gồm cả bệnh nhân xơ gan) nhận thấy sự gia tăng đáng kể nguy cơ tổn thương phổi do truyền máu (TRALI) khi sử dụng protol truyền 1: 1: 1.[87] Các biến chứng tiềm ẩn khác của truyền cân bằng bao gồm các tình trạng đáp ứng qua trung gian viêm: suy đa cơ quan, huyết khối tĩnh mạch , nhiễm trùng, [88,89] và các tác dụng phụ liên quan đến thể tích như áp lực tĩnh mạch cửa cao hơn và tăng nguy cơ chảy máu. [11,12]
Truyền máu toàn phần
Gần cuối Thế chiến thứ nhất và trong suốt Thế chiến thứ hai, truyền máu toàn phần là phương pháp điều trị tiêu chuẩn cho bệnh xuất huyết do chấn thương quân sự. [90] Kể từ khi phương pháp điều trị thành phần máu ra đời, việc sử dụng máu toàn phần không còn được ưa chuộng. Liệu pháp thành phần máu cho phép tiếp cận mục tiêu hơn để hồi sức và giảm chất thải do thời gian lưu trữ lâu hơn.[91] Mặc dù có những lợi ích này, tuy nhiên, liệu pháp thành phần máu có những mặt trái của nó khi nói đến sốc mất máu nặng. Ngay cả tỷ lệ 1: 1: 1 các sản phẩm máu cũng tạo ra một hỗn hợp máu loãng với khoảng 29% hematocrit, số lượng tiểu cầu khoảng 90.000 và các yếu tố đông máu chỉ chiếm 60% nồng độ máu toàn phần.[92]
Gần đây, đã có sự quan tâm mới đến máu toàn phần. Các lý lẽ về việc sử dụng máu toàn phần còn nhiều lần: Nó cung cấp sự hồi sức cân bằng của tất cả các thành phần máu gần nhất với máu sinh lý (bao gồm fibrinogen và chất chống đông máu) và nó chứa một lượng dung dịch chống đông máu/ chất bảo quản nhỏ hơn so với các thành phần máu riêng lẻ. Năm 2014, Ủy ban Chăm sóc Thương tật Chiến thuật Chiến trường đã khuyến nghị máu tươi toàn phần (FWB) là sản phẩm hồi sức ưu tiên cho sốc mất máu.[94] Ngày nay, 19 trung tâm chấn thương hàng đầu ở Hoa Kỳ đang sử dụng máu toàn phần O được chuẩn độ nồng độ thấp (LTOWB) cho chấn thương dân sự. [95] Seheult và cộng sự gần đây đã thực hiện một nghiên cứu quan sát, hồi cứu về việc sử dụng LTOWB ở bệnh nhân chấn thương dân sự. [96] Họ phát hiện ra rằng những người đã nhận LTOWB cộng với các thành phần máu cũng làm tốt hoặc tốt hơn so với những người chỉ nhận từng thành phần máu.
Trong một nghiên cứu tiền cứu ngẫu nhiên trên 33 bệnh nhân đang điều trị OLT, máu toàn phần, khi so sánh với liệu pháp từng thành phần, có liên quan đến việc tiếp xúc với tạng hiến ít hơn và có hiệu quả như nhau trong điều trị thay thế máu.[97] Liệu việc sử dụng máu toàn phần thay cho liệu pháp từng thành phần máu có lợi trong bệnh xơ gan bệnh nhân bị sốc mất máu là một câu hỏi đáng được khám phá và cho đến nay vẫn là một câu hỏi đáng được nghiên cứu thêm. Thể tích truyền thấp hơn cũng như khả năng cung cấp các thành phần máu bắt chước các tình trạng sinh lý là hai lợi thế chính mà máu toàn phần có thể mang lại cho bệnh nhân xơ gan.
Kết luận
Tóm lại, có nhiều chiến lược khả thi để cung cấp hỗ trợ truyền máu cho bệnh nhân mắc bệnh gan mãn tính, mặc dù bằng chứng cho nhiều người trong số bệnh nhân này là rất hiếm. Bằng chứng mạnh mẽ nhất là truyền máu ngưỡng hemoglobin với pRBC với các hướng dẫn khuyến nghị truyền máu đến mục tiêu 7–8 g/ dL.[2,9] Thông thường là truyền máu đến ngưỡng tiểu cầu 50000 trong trường hợp có thủ thuật chảy máu hoặc xâm lấn dựa trên bằng chứng từ in vitro và hồi cứu 15 Việc sử dụng giai đoạn trước thủ thuật của thuốc chủ vận thụ thể TPO đã cho thấy nhiều hứa hẹn trong việc tăng số lượng tiểu cầu và giảm nhu cầu truyền máu.[21,22] Liên quan đến các chiến lược truyền máu dựa theo ngưỡng khác, INR như một dấu hiệu cho rối loạn đông máu đã không còn được ưa chuộng ở bệnh nhân xơ gan.[25] Hiện tại không có bằng chứng về ngưỡng INR trước bất kỳ thủ thuật nào ở bệnh nhân xơ gan và AASLD hiện không khuyến nghị sử dụng FFP như một phần của việc quản lý chảy máu do tăng áp lực tĩnh mạch cửa hoặc sử dụng dự phòng trước khi thực hiện chọc dẫn lưu dịch để đáp ứng với tình trạng tăng INR.[29] Mức fibrinogen ngày càng được công nhận là một yếu tố nguy cơ độc lập làm tăng chảy máu và tử vong ở bệnh nhân xơ gan. Duy trì mức fibrinogen trên 100–120 mg/ dL đã được một số xã hội đề xuất trong trường hợp mất máu cấp tính; [39,40] tuy nhiên, những khuyến nghị này chưa được điều chỉnh hoặc nghiên cứu cụ thể cho bệnh nhân xơ gan và rối loạn fibrinogen huyết.
Một số chất cầm máu đã được kiểm tra để sử dụng cho bệnh nhân xơ gan. Cho đến nay, các tài liệu về yếu tố VIIa hoạt hóa tái tổ hợp (rFVIIa) ở bệnh nhân xơ gan, trong điều kiện UGIB hoặc ghép gan, không cho thấy lợi ích đáng kể. Các hướng dẫn đồng thuận hiện tại về việc sử dụng rFVIIa như một phương pháp điều trị bổ trợ cho chảy máu lượng lớn không khuyến cáo nó ở bệnh nhân xơ gan Child-Pugh A; tuy nhiên, việc sử dụng ở những bệnh nhân mắc bệnh gan tiến triển nặng hơn là không chắc chắn.
Bằng chứng đang mở rộng cho xét nghiệm độ đàn hồi cục máu (VET). Hiện nay, VET được sử dụng rộng rãi tại các trung tâm ghép gan để hướng dẫn truyền máu và đã được chứng minh là làm giảm lượng máu truyền trong mổ so với truyền máu dựa trên tiêu chuẩn chăm sóc.[79] Ngày càng có nhiều bằng chứng cho thấy truyền máu với hướng dẫn của VET làm giảm số lượng máu và nhu cầu các chế phẩm sử dụng tình trạng chảy máu dãn tĩnh mạch cấp tính và trước các thủ thuật nhỏ. [82,83]
Về hướng đi trong tương lai, nhiều nhóm vẫn đang hy vọng trả lời được câu hỏi chiến lược truyền máu nào là tối ưu ở bệnh nhân xơ gan. “Thử nghiệm POCKET” [99] đã cố gắng so sánh ba chiến lược truyền máu (hướng dẫn xét nghiệm đông máu thường quy, thông thường hoặc hạn chế, hoặc dưới hướng dẫn của VET) trước khi đặt catheter tĩnh mạch trung tâm ở những bệnh nhân xơ gan bị bệnh nặng; tuy nhiên, thử nghiệm đã kết thúc sớm do tỷ lệ thu nhận thấp. Nghiên cứu EXARHOSE (NCT 003023189), hiện đang trong giai đoạn tuyển dụng, là một thử nghiệm ngẫu nhiên giữa axit tranexamic so với giả dược ở bệnh nhân xơ gan có UGIB cấp tính.[71]
Một tỷ lệ cân bằng các sản phẩm máu được truyền đã được hứa hẹn trong trường hợp sốc mất máu do chấn thương nhưng chưa được nghiên cứu cụ thể ở bệnh nhân xơ gan. Sẽ rất thú vị khi xem liệu chiến lược truyền máu này có mang lại lợi ích gì không, đặc biệt khi yêu cầu nhiều hơn 7–10 đơn vị pRBC. Tương tự như vậy, với sự quan tâm trở lại đến máu toàn phần, sẽ rất đáng để khám phá liệu khả năng lý thuyết cung cấp các thành phần máu bắt chước các điều kiện sinh lý có chuyển thành kết quả thuận lợi hay không.
Tóm lại, bằng chứng hiện tại còn hạn chế nên các nhà thực hành lâm sàng được lựa chọn chiến lược truyền máu dựa trên dữ liệu hạn chế hoặc ngoại suy từ các quần thể không xơ gan. Nghiên cứu trong tương lai hy vọng sẽ cung cấp các chiến lược an toàn hơn cho phép bệnh nhân đạt được kết quả tốt nhất trong khi cân bằng việc sử dụng tài nguyên tốt nhất.