Bài viết Chế độ thông khí theo tỷ lệ: từ công nghệ cho đến sinh lý hỗ trợ bản dịch của BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
1. Tóm tắt
Các chế độ thông khí theo tỷ lệ hỗ trợ bệnh nhân bằng cách thích nghi với nỗ lực của họ, điều này trái ngược với tất cả các chế độ khác. Hai chế độ thông khí tỷlệ là hỗ trợ thông khí điều chỉnh bằng thần kinh (neurally adjusted ventilatory assist, NAVA) và thông khí hỗ trợ tỷ lệ (proportional assist ventilation, PAV+) với hệ số khuếch đại có thể điều chỉnh theo mức tải: chúng cung cấp hỗ trợ hô hấp tương ứng với nỗ lực của bệnh nhân và do đó đáp ứng trực tiếp với những thay đổi về nhu cầu thông khí. Do nguyên lý hoạt động của chúng, NAVA và PAV+ có khả năng cung cấp thông khí tự điều chỉnh để bảo vệ phổi và cơ hoành. Vì các chế độ tỷ lệ này khác với các chế độ “cổ điển” như thông khí hỗ trợ áp lực (PSV), việc đặt mức hỗ trợ hô hấp thường gây khó hiểu cho các bác sĩ lâm sàng tại giường bệnh vì nó không dựa trên các thông số thông thường như thể tích khí lưu thông và PaCO2 mục tiêu. Bài báo này cung cấp một cái nhìn tổng quan sâu sắc về nguyên lý hoạt động của NAVA và PAV+ và sự khác biệt sinh lý với PSV. Hiểu được những khác biệt này là cơ bản đểáp dụng bất kỳ chế độ hỗ trợ nào ở đầu giường. Chúng tôi xem xét các phương pháp khác nhau để thiết lập hỗ trợ hô hấp trong suốt NAVA và PAV+, và (trong tương lai) để theo dõi nỗ lực của bệnh nhân. Cuối cùng, sự khác biệt với các chế độ tự động được đề cập.
2. Take-home message
Tổng quan này giải thích cách các chế độ thông khí theo tỷ lệ cải thiện sự phù hợp giữa bệnh nhân và máy thở và cung cấp tiềm năng cho cả thông khí bảo vệ phổi và cơ hoành. Chúng tôi thảo luận về các phương pháp khác nhau để điều chỉnh mức hỗ trợ hô hấp, đây là một thách thức quan trọng tại giường bệnh, vì mục tiêu tối ưu của nỗ lực cơ hô hấp có thể khác nhau giữa các bệnh nhân và trong quá trình bệnh nặng.
3. Giới thiệu
Các chế độ thông khí theo tỷ lệ hoạt động bằng cách khuếch đại nỗ lực hoạt động cơ hô hấp của bệnh nhân, cung cấp sự hỗ trợ cần thiết để cải thiện sự mất cân bằng giữa công suất và nhu cầu, đồng thời đạt được mục tiêu thông khí của bệnh nhân. Các chế độtỷ lệ này có khả năng cung cấp thông khí bảo vệ phổi và cơ hô hấp bằng cách duy trì các cơ chế kiểm soát của bệnh nhân chống lại sự căng quá mức của phổi và sự hỗ trợ quá mức của máy thở, và tránh sự phát triển của teo cơ hoành [1, 2]. Hỗ trợ hít vào được cung cấp đồng bộvới nỗlực của bệnh nhân trong tổng chu kỳ thở máy, và do đó, trái ngược với các chế độ khác, đáp ứng trực tiếp với những thay đổi về nhu cầu thông khí [3, 4]. Điều này về cơ bản khác với các phương thức thông khí được hỗ trợ một phần thông thường như thông khí hỗ trợ áp lực (PSV), trong đó máy thở được cung cấp cùng một áp lực cho mỗi nhịp thởvà không phụthuộc vào nhu cầu chuyển hóa và mức độ nỗ lực của bệnh nhân và thời gian của nó. Do đó, sự không đồng bộ bệnh nhân – máy thở và sự hỗ trợ quá mức của máy thở là phổ biến và thường không được chú ý trong các chế độ thông thường như PSV [5-9].
Các phương thức thông khí tỷ lệ có sẵn trong thực hành lâm sàng trên máy thở chuyên dụng là hỗ trợ thông khí điều chỉnh thần kinh (NAVA) [ 3] và thông khí hỗ trợ tỷ lệ với hệ số khuếch đại điều chỉnh theo tải (PAV+) [2]. Tác dụng sinh lý của chúng rất giống nhau, nhưng chúng khác nhau về tín hiệu được sử dụng để điều khiển máy thở.
NAVA cung cấp hỗ trợ hô hấp tương ứng với hoạt động điện cơ hoành ( diaphragm electrical activity, EAdi), phản ánh chặt chẽ điều hòa hô hấp trung tâm và được đo thông qua ống thông mũi-dạdày (cho ăn) chuyên dụng với các điện cực nhúng [3]. PAV+ cung cấp hỗ trợ tương ứng với lưu lượng và thể tích tức thời được tạo ra bởi nỗ lực hít vào hoặc áp lực cơ (Pmus) của bệnh nhân, được ước tính từ các phép đo tự động bán liên tục của cơ hô hấp áp dụng phương trình chuyển động của hệ hô hấp [ 10, 11]. Khi bệnh nhân tự điều chỉnh lượng trợgiúp, các chế độtỷ lệ đơn giản hóa việc thực hiện thở máy có hỗ trợ [12]. Tuy nhiên, một rào cản quan trọng đối với việc triển khai rộng rãi các chế độ đó là sự không quen thuộc với các cài đặt và chức năng, khác với các chế độ thông thường. Theo dõi thời gian thực của trung khu điều hòa hô hấp (diễn biến thời gian EAdi trong NAVA) và nỗ lực của bệnh nhân (ước tính bán liên tục của Pmus trong PAV+) cũng có sẵn ở các chế độ tỷ lệ và cho phép định lượng phản ứng sinh lýđối với những thayđổi trong hỗtrợ thông khí. Mặc dù các chế độ tỷ lệ ngày càng được sử dụng nhiều hơn, việc thiết lập các mức hỗ trợ hô hấp vẫn là một thách thức ở đầu giường vì nó không thể dựa trên các thông số thông thường như thể tích khí lưu thông và mục tiêu PaCO2 [13, 14]. Hơn nữa, các mục tiêu an toàn cho nỗ lực hô hấp có thể khác nhau giữa các bệnh nhân, tùy thuộc vào mứcđộ nghiêm trọng của tổn thương phổi và chức năng cơ hoành [15–17]. Sự không chắc chắn liên quan đến việc chuẩn độ hỗ trợ thở bằng NAVA và PAV+ có thể là một trong những lý do tại sao vẫn còn hạn chế dữ liệu cho thấy kết quả lâm sàng được cải thiện khi sử dụng các chế độ tỷ lệ so với các chế độ thông thường [18, 19], nhưng lợi ích lâm sàng của NAVA so với PSV gần đây đã được chứng minh ở những bệnh nhân khó cai máy [20, 21]. Đồng thời, mặc dù có những hậu quả sinh lý rất phức tạp, PSV vẫn duy trì vẻ ngoài đơn giản và là phương thức thông khí hỗ trợ một phần được sử dụng thường xuyên nhất [22].
Tổng quan này cung cấp sự hiểu biết sinh lý về các chế độ tỷ lệ trong quá trình thở máy xâm lấn ở người lớn trong đơn vị chăm sóc đặc biệt (ICU) và sự khác biệt của chúng với PSV, là điều cơ bản cần hiểu khi áp dụng bất kỳ chế độ hỗ trợ nào tại giường bệnh. Chúng tôi thảo luận về các phương pháp điều chỉnh hỗ trợ hô hấp trong quá trình NAVA và PAV+, và các chỉ số (trong tương lai) để theo dõi nỗ lực của bệnh nhân. Cuối cùng, chúng tôi cũng nêu rõ nhữngđiểm khác biệt chính với các chế độ tự động.
4. Nguyên lý hoạt động
4.1 NAVA
Được đo bằng ống thông mũi dạ dày chuyên dụng, EAdi phản ánh cường độ điện trường do cơ hoành tạo ra và là tín hiệu có sẵn gần nhất với đầu ra của trung tâm hô hấp. EAdi là đại diện chính xác nhất của hệ thống truyền động hô hấp thần kinh với điều kiện là sự dẫn truyền thần kinh cơ và khả năng kích thích màng sợi cơ còn nguyên vẹn, và cơ hoành được sử dụng làm cơ hít vào chính (tức là không có sự khác biệt đáng kể giữa các cơ hô hấp phụ khác) [3, 23, 24]. EAdi chủ yếu phản ánh hoạt động của cơ hoành, nhưng là đại diện cho hoạt động từ các phần bên bờ của cơ hoành. EAdi tương quan tốt với áp lực xuyên cơ hoành [25, 26] và tín hiệu vẫn đáng tin cậy ở các thể tích phổi khác nhau [27]. Các thuật toán của máy thở liên tục sửa lỗi can thiệp từ hoạt động của tim và các động tác chuyển động do co bóp tim và nhu động thực quản.
NAVA là duy nhất so với tất cả các chế độ máy thở khác, vì nó sử dụng EAdi để điều khiển máy thở, đặc biệt là kích hoạt, mức độ trợ giúp hít vào và chuyển chu kỳ. Áp lực hít vào (Paw) áp dụng trên mức áp lực dương cuối thì thở ra (PEEP) trong thời gian NAVA được xác định bằng độtăng tỷ lệ (mức NAVA, tính bằng cmH2O/µV) do bác sĩ lâm sàng thiết lập:
Paw = (mức NAVA × EAdi) + PEEP (1)
Do đó, khi biên độ EAdi là 10 µV và mức NAVA 1,5 cmH2O/µV, đỉnh Paw đạt 15 cmH2O trên PEEP. Hỗ trợ hít vào tỷ lệ thuận với EAdi trong chu kỳ hít vào; nó được kích hoạt cho mỗi lần tăng EAdi > 0,5 µV trên mức cơ bản và kết thúc khi biên độ EAdi giảm xuống ở70% giá trị đỉnh của nó, có thể gần đúng với thời điểm kết thúc quá trình co thắt chủ động. Tín hiệu EAdi độc lập với kích hoạt khí nén và do đó việc kích hoạt không bị ảnh hưởng trực tiếp bởi sự hiện diện của rò rỉ hoặc PEEP nội tại;nhịp thở được hỗ trợ có thể được kích hoạt bởi EAdi, Paw hoặc flow, theo một hệ thống phân cấp tuân theo nguyên tắc “đến trước được phục vụ trước” [3]. EAdi cho phép theo dõi thời gian thực hoạt động của cơ hoành, không giới hạn ở việc sử dụng ở chế độ NAVA và thậm chí có thể thực hiện được ở bệnh nhân không đặt nội khí quản. Khi sử dụng EAdi cho mụcđích theo dõi, điều quan trọng là nhận ra rằng sự gia tăng EAdi có thể do nhiều nguyên nhân như tăng tải cơ học lên các cơ hô hấp (ví dụ: tăng sức cản), tăng nhu cầu thở (ví dụ, tăng sản xuất CO2), hoặc sự gia tăng hoạt động trung khu hô hấp không liên quan đến tải trọng (ví dụ: viêm) [28–30]. Vì thể tích khí lưu thông được kiểm soát chủyếu bởi các trung tâm hô hấp thân não, nên việc thay đổi mức hỗtrợ có thể không ảnh hưởng đến thể tích khí lưu thông.
4.2 PAV+
Trong PAV+, bộ kích hoạt hoạt động tương tự như các chế độ thông khí được hỗ trợ khác; máy thở phát hiện nỗ lực hít vào bằng cách đo tức thời lưu lượng và thể tích được bệnh nhân hít vào và cung cấp hỗ trợ áp lực cho phù hợp [10, 11]. Hỗ trợ hô hấp được tính toán ngay lập tức từ lưu lượng và thể tích đo được bằng cách sử dụng phương trình chuyển động của hệ hô hấp và hệ số có thể điều chỉnh xác định phần trăm của tổng áp lực được tính toán để cung cấp [2,4]. Tổng áp lực cung cấp đến hệ thống hô hấp (Ptotal) sau đó là tổng của Paw và Pmus và nó vượt qua cả áp lực sức cản và áp lực co giãn đàn hồi:
Ptotal = Paw + Pmus = (lưu lượng × sức cản) + (thể tích × độ đàn hồi) (2)
Máy thở tự động tính toán sức cản của hệ thống hô hấp [10] và độ đàn hồi [11] bằng cách thực hiện các thủ thuật tắc ngắn cuối thì hít vào sau mỗi 8–15 nhịp thở (lưu ý: tính năng này dành riêng cho PAV+ và không có trong “PAV” áp lực đơn giản hoặc “hỗ trợ áp lực tỷlệ”) và sửdụng hệ số tăng ( gain) làm % hỗ trợ:
Paw = % hỗ trợ × Ptotal (3)
Sử dụng Phương trình (2), mối quan hệ này có thể được viết thêm là:
Paw = Pmus × % hỗ trợ/(100 − % hỗ trợ) (4)
Do đó, Paw là một phần nhỏ của Ptotal và tỷ lệ với Pmus tức thời trong toàn bộ chu kỳ thở (Hình 1); hệ số tăng cho biết tỷ lệ cơ hô hấp không hoạt động, do bác sĩ lâm sàng thiết lập. Do đó, nếu hệ số tăng được đặt ở 75%, có nghĩa là máy thở cung cấp 75% tổng áp lực, 25% còn lại được giả định bởi Pmus của bệnh nhân (Phương trình 3): Paw bằng ba lần Pmus trong giai đoạn hít vào ( Phương trình 4). Thực tế, mức tăng này có thể từ 5% đến 85%. Thật vậy, mức hỗ trợ gần 100% sẽ khiến bệnh nhân có nguy cơ bịtrợgiúp quá mức trong trường hợp có sai sót trong tính toán tự động của cơ hô hấp dẫn đến đánh giá quá mức áp lực cần thiết. Tương tự như NAVA, vì não của bệnh nhân kiểm soát thể tích mong muốn, thể tích được cung cấp cho bệnh nhân có thể có chút thay đổi khi thay đổi mức độ hỗ trợ [31]. Hít vào sẽ chuyển chu kỳ khi lưu lượng giảm xuống mức thấp được thiết lập trước (theo mặc định được đặt thành 3 L/phút). Cơ chế chuyển chu kỳ này thường làm cho sự chấm dứt của hỗ trợ máy thở rất gần với sự chấm dứt của hít vào thần kinh. Không thể sử dụng PAV+ trong quá trình thông khí không xâm nhập, vì không thể thực hiện tắc cuối thì hít vào khi có rò rỉ. Ngoài ra, ước tính của Ptotal không đúng với PEEP nội tại, nếu có, điều này có thể dẫn đến việc đánh giá thấp áp lực cung cấp ở những bệnh nhân có siêu bơm phồng đáng kể [32].
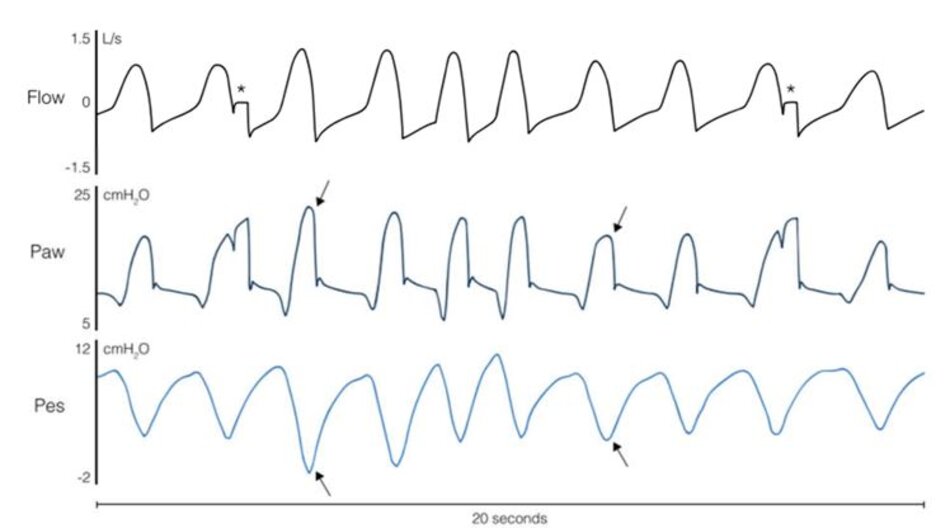
5. Sự khác biệt giữa các chế độ tỷ lệ và PSV
5.1 Tương tác bệnh nhân – máy thở: Mối quan hệ giữa Pmus-VT và tiêu chí chu kỳ
Sự khác biệt sinh lý chính giữa PSV và các chế độ tỷ lệ có thể được giải thích với mối quan hệ giữa nỗ lực của bệnh nhân hoặc Pmus và thể tích khí lưu thông (VT) được cung cấp bởi máy thở ( Hình 2a). Trong quá trình thở không có trợ giúp, sự gia tăng của Pmus dẫn đến sự gia tăng tương đối tuyến tính của thể tích khí lưu thông (tức là, mối quan hệ tuyến tính giữa Pmus và PaCO2) [33, 34]. Hệ số góc của mối quan hệ này thể hiện hiệu quả của các cơ hô hấp. Với PSV, đường cong Pmus-VT bị dịch chuyển lên trên và do đó, không bắt đầu từ thể tích 0 (Hình 2a); điều này là do một lượng khí lưu thông đáng kể vẫn được cung cấp mặc dù điều hòa trung khu hô hấp tối thiểu và không có nỗ lực đo lường được (ví dụ: do dùng thuốc an thần hoặc quá mức); thể tích này phụ thuộc chủ yếu vào mức hỗ trợ áp lực và độ giãn nở của hệ thống hô hấp [35, 36]. Sự hiện diện của ‘thểtích khí lưu thông tối thiểu’ này gợi ý một cách sai lầm cho các bác sĩ lâm sàng rằng bệnh nhân đang thở tự nhiên, trong khi bệnh nhân chỉ khởi động máy thở và sau đó thả lỏng các cơ hít vào của mình, ngụ ý máy thở hỗ trợ quá mức (Hình 3) [35]. Sự hỗ trợ quá mức của máy thở dẫn đến thể tích khí lưu thông quá mức, hoạt động của cơ hoành rất thấp và có thểcó nguy cơ teo cơ [ 5, 37]. Hỗtrợ hô hấp quá mức làm giảm nỗ lực của bệnh nhân gần như bằng không [38] và dẫn đến các hiện tượng ngưng thởtrung ương trong khi ngủ ngay khi đạt đến ngưỡng ngưng thở PaCO2. Ngưng thở dẫn đến kích thích và thức giấc, khiến giấc ngủ ssâu (không yên) trở nên khó khăn [39]. Độ dốc ban đầu của mối quan hệPmus-V T không bị ảnh hưởng trong PSV, vì một áp lực không đổi được áp dụng bất kể nỗ lực của bệnh nhân. Do đó, bệnh nhân có trung khu điều hòa hô hấp cao cũng có thể được hỗ trợ không đầy đủ, có nguy cơ bị tổn thương do tải trọng cơ hoành và bệnh nhân tự gây ra chấn thương phổi [15, 16]. Ngoài ra, sự đồng bộ hoàn hảo bệnh nhân – máy thở thường không đạt được ở PSV [ 19, 40, 41]. Nguy cơ khi chu kỳ muộn (tức là bơm phồng cơ học kết thúc sau khi kết thúc nỗ lực hít vào; còn được gọi là bơm phồng kéo dài hoặc chu kỳkéo dài) cao trong thời gian PSV, vì chu kỳ chuyển sang thở ra khi lưu lượng đã đạt đến một tỷ lệ phần trăm đặt trước của đỉnh lưu lượng hít vào: sự hỗ trợ càng cao, thời gian để đạt được tiêu chí chu kỳ và thời gian hít vào cơ học càng lâu, do đó làm tăng sự không phù hợp với thời gian hít vào thần kinh của bệnh nhân [42, 43] (Hình 2b). Vì sựtrợgiúp của máy thởquá mức thúc đẩy siêu bơm phồng động và làm giảm nỗ lực của bệnh nhân, điều này khiến bệnh nhân có nguy cơ nỗ lực không hiệu quả [6, 8] (Hình 2b). Ngoài ra, tự động kích hoạt dẫn đến việc cung cấp nhịp thở đầy đủ có thể xảy ra trong PSV nhưng không theo chế độ tỷ lệ. Nhiễu tín hiệu điện trong EAdi có thể kích hoạt một số cung cấp áp lực trong quá trình NAVA; tuy nhiên, con số này sẽ luôn rất thấp (tỷ lệ thuận với lượng nhiễu) [44].
Ngược lại, trong thời gian NAVA và PAV+, hệ số tăng tương xứng do bác sĩ lâm sàng thiết lập xác định độ dốc của đường cong Pmus-VT [2, 35] (Hình 2a), nghĩa là có nhiều trợ giúp hơn khi nhu cầu thông khí của bệnh nhân tăng lên. Khi đường cong bắt đầu từ 0 (tức là không có sự dịch chuyển lên trên như trong PSV), một số hoạt động của cơ hô hấp được yêu cầu để duy trì thông khí đầy đủ và hỗ trợ thông khí được kết thúc ngay khi nỗ lực của bệnh nhân giảm bớt (Hình 2a, c). Do đó, các chế độ tỷ lệ cung cấp sự đồng bộ của máy thở với bệnh nhân trong toàn bộ chu kỳ thở đầy đủ, ngăn ngừa sự hỗ trợ quá mức của máy thở, sử dụng cơ hoành và tránh các hiện tượng ngừng thởtrong khi ngủ. Những nguyên tắc này giải thích tại sao NAVA và PAV+ sinh lý hơn so với PSV [41].
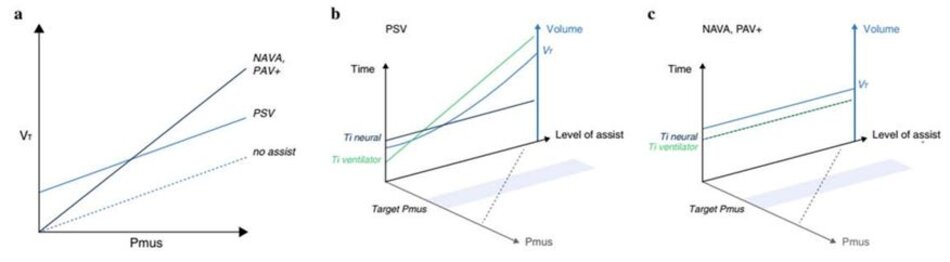
lưu thông (VT) trong nhịp thở tự phát không có trợ giúp (đường đứt nét), trong quá trình thông khí hỗ trợ áp lực (PSV) và đối với các chế độ tỷ lệ như thông khí hỗ trợ tỷ lệ – hệ số khuếch đại điều chỉnh với tải (PAV+) và hỗ trợ thông khí điều chỉnh thần kinh (NAVA).
b Tương tác giữa bệnh nhân với máy thở trong thời gian PSV. Tăng mức hỗ trợ áp lực làm tăng VT (đường màu xanh) và thời gian thở máy (Ti, đường màu xanh lá cây), trong khi nỗ lực của bệnh nhân (Pmus, đường chấm màu xám) được điều chỉnh giảm. Ngoài ra, Ti thần kinh (đường màu xanh lam đậm) vẫn không thay đổi với mức độ hỗ trợ ngày càng tăng, dẫn đến chu kỳ muộn.
cTương tác giữa bệnh nhân với máy thởtrong thời gian NAVA và PAV+. Hỗtrợmáy thở được cung cấp tỷlệ thuận với nhu cầu của bệnh nhân trong toàn bộ chu kỳ thở máy (Ti thần kinh = Ti máy thở, lưu ý rằng các đường gạch ngang màu xanh lá cây và xanh lam đậm trùng nhau). Tăng mức hỗ trợ hít vào (mức NAVA hoặc mức tăng PAV+) điều chỉnh giảm Pmus (đường chấm màu xám). Vì não của bệnh nhân chủ yếu kiểm soát VT mong muốn, nên việc thay đổi mức hỗ trợ thường chỉ có tác động tối thiểu lên V T, như được thể hiện bằng đường màu xanh lam ngang trên Thể tích so với mức của đường cong hỗ trợ.
5.2 Dỡ tải cơ hô hấp và khớp nối thần kinh cơ
Ở những bệnh nhân đang hồi phục sau suy hô hấp cấp, mức dỡ tải cơ có thể so sánh giữa mức PSV trong khoảng từ 7 đến 25 cmH 2O và mức NAVA trong khoảng từ 0,5 đến 2,5 cmH 2O/μV [38]. Tuy nhiên, NAVA đã cải thiện sự tương tác giữa máy thở với bệnh nhân, duy trì sự thay đổi nhịp thở và cho phép đồng bộ hóa tốt hơn. Điều thú vị là NAVA đã dẫn đến sự đóng góp lớn hơn của cơ hoành vào các nỗ lực hít vào [45], có khả năng cải thiện sự trao đổi khí do tăng cường thông khí ở các vùng đáy phổi [ 46]. Một nghiên cứu khác khẳng định chức năng cơ hoành được cải thiện với NAVA so với PSV sau khi thở máy kiểm soát kéo dài [47], trong khi sựkhác biệt giữa PSV và PAV+ không rõ rệt [48]. Tuy nhiên, để đáp ứng với sự gia tăng tải trọng đàn hồi, hiệu quả cơ hô hấp lớn hơn được tìm thấy với PAV+ so với PSV [49, 50].
5.3 Chế độ tỷ lệ đối với thông khí bảo vệ phổi và cơ hoành
Các chế độ tỷ lệ cải thiện sự đồng bộ của máy thở với bệnh nhân, khớp nối thần kinh cơ và trao đổi khí, và phục hồi sự thay đổi nhịp thở [ 19, 41, 50– 53]. Sự tương tác giữa máy thở với bệnh nhân được cải thiện này là một cơ chế tiềm năng mà NAVA và PAV+ có thểcung cấp thông khí bảo vệphổi và cơ hoành. Căng phổi quá mức được ngăn ngừa do hai cơ chế sinh lý đã biết. Đầu tiên, cơ chế phản hồi sinh học ức chế bơm phồng Hering – Breuer điều chỉnh giảm điều hòa trung khu hô hấp (và do đó giảm biên độ EAdi và nỗ lực của bệnh nhân) ở thể tích khí lưu thông cao hơn để tránh siêu bơm phồng [27, 54, 55]. Thứ hai, với việc tăng thể tích phổi, cơ hoành rút ngắn và có thể trở thành một máy tạo áp lực kém hiệu quả hơn, do đó làm giảm nỗ lực [ 27, 56]. Thật vậy, Carteaux và cộng sự [38] cho thấy rằng hầu hết bệnh nhân có thể tự điều chỉnh thể tích khí lưu thông của họ trong phạm vi bảo vệ (từ 6 đến 8 mL/kg PBW) mặc dù tăng mức NAVA trong một phạm vi ‘hợp lý’ nhất định. Hơn nữa, gần đây đã chỉ ra rằng những bệnh nhân được thở máy trong PAV+ sau hội chứng suy hô hấp cấp tính có thể tránh được tình trạng quá căng phổi, như được chỉ ra bởi áp lực đẩy được giữ dưới 15 cmH 2O [57]. Ngược lại, việc tăng mức hỗ trợ trong thời gian PSV, làm tăng thể tích khí lưu thông mặc dù có sự điều tiết giảm của điều hòa trung khu thần kinh [45]. Do đó, các chế độ tỷ lệ có thể bảo vệ bệnh nhân khỏi thể tích khí lưu thông có hại và đồng thời ngăn ngừa teo cơ hoành. Tuy nhiên, cần nhấn mạnh rằng quá trình hô hấp quá mức có thể lấn át phản xạ bảo vệ phổi, và do đó, cần thận trọng hơn khi sử dụng các chế độ tỷ lệ ở những bệnh nhân có tần số hô hấp cao và cơ học hô hấp cực kỳ suy giảm.
5.4 So sánh lâm sàng giữa các chế độ tỷ lệ và PSV
Việc sử dụng các chế độ tỷ lệ, đặc biệt là PAV+, có liên quan đến thời gian cai máy ngắn hơn so với PSV [19] trong các nghiên cứu nhỏvà làm tăng xác suất còn lại với thông khí tự phát có hỗ trợ [58]. Người ta cho rằng điều này là do sự tương tác giữa bệnh nhân với máy thở tốt hơn, giảm nhu cầu an thần [12, 59] và cải thiện chất lượng giấc ngủ [60– 62]. Vì những lý do này, sự thoải mái của bệnh nhân tăng lên trong các chế độ tỷ lệ thường được cho là có nhưng hiếm khi đượcđo lường [ 53, 63, 64]. Mặc dù sự không đồng bộ giảm trong khi ngủ đã được báo cáo, tác động trực tiếp của các chế độ tỷ lệ đến chất lượng giấc ngủ là rất nhỏ, giúp cải thiện giấc ngủ trong hai nghiên cứu [60, 61] nhưng không phải trong tất cả [62].
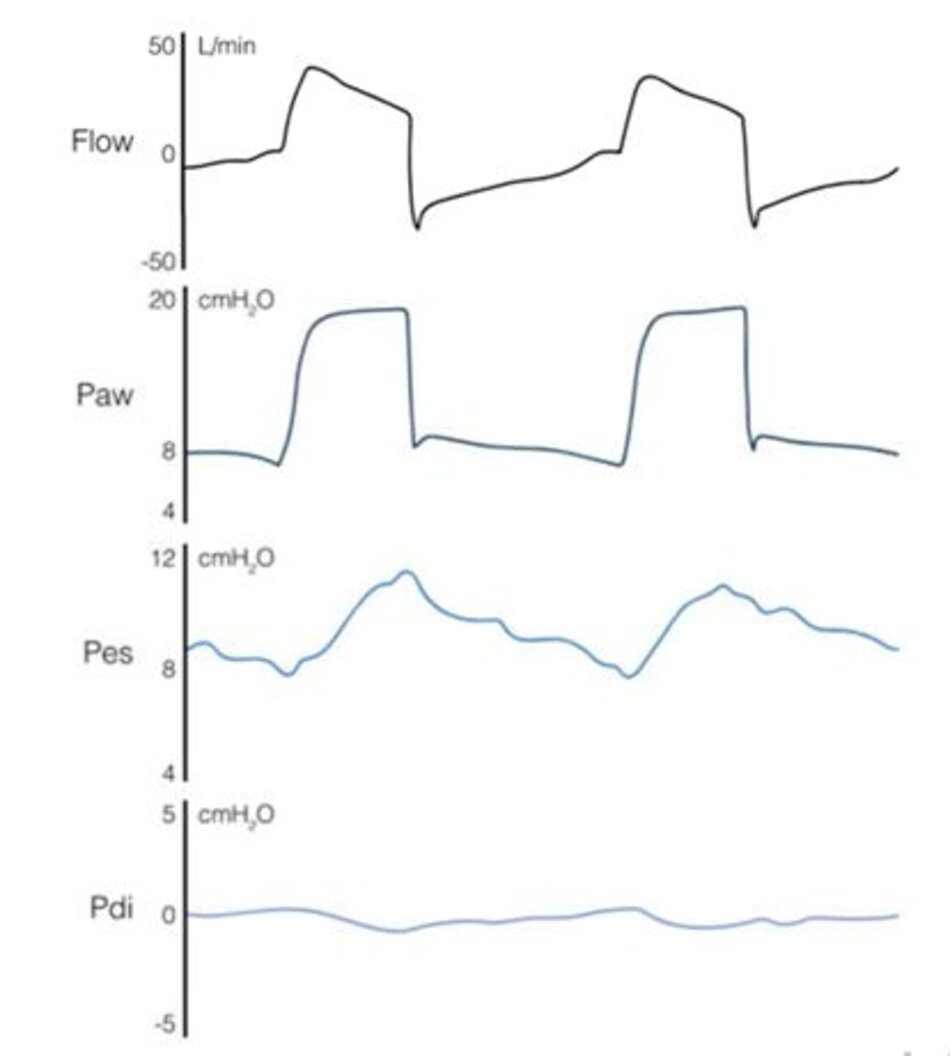
Sự khác biệt về thời gian cai máy hoặc kết quảICU khôngđược chứng minh trong một nghiên cứu ngẫu nhiên lớn (n = 128) so sánh NAVA với PSV ở bệnh nhân hồi phục sau suy hô hấp cấp [18]. Tuy nhiên, điều quan trọng cần lưu ý là giám sát EAdi cũng có sẵn trong nhóm PSV. Trong nghiên cứu đó, NAVA làm giảm sự không đồng bộ của máy thở với bệnh nhân và tỷ lệ áp dụng thông khí không xâm lấn sau rút nội khí quản, và tính khả thi và an toàn của NAVA trong vài ngày đã được chứng minh thành công. Một nghiên cứu gần đâyđã xác nhận sự tuần thủ có thể chấp nhận được với chế độ được chỉ định sau 48 giờ khi so sánh NAVA với PSV [21]. Hơn nữa, Liu và cộng sự gần đây cho thấy thời gian cai máy ngắn hơn với NAVA so với PSV ở một số bệnh nhân khó cai máy được chọn [20].
6. Cài đặt hỗ trợ hít vào trong NAVA
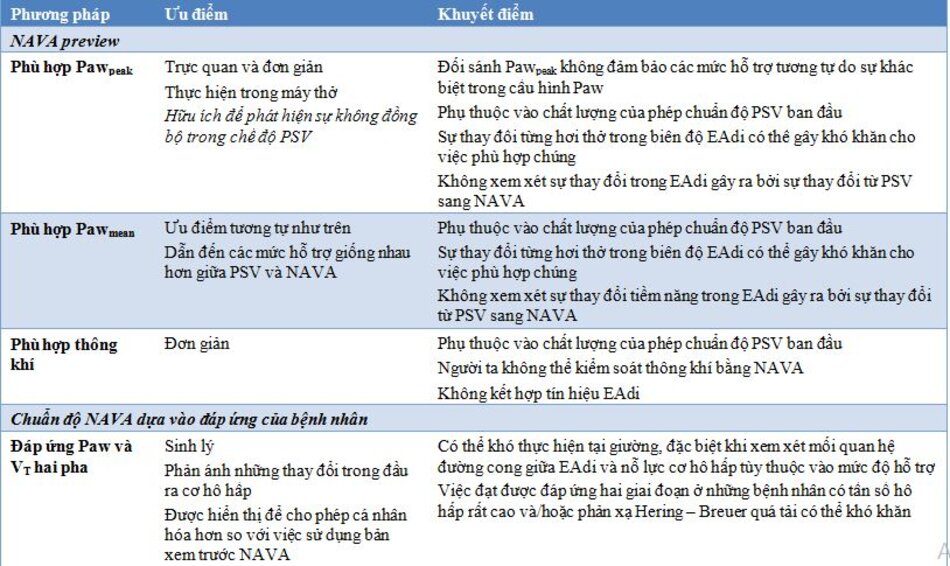
Các phương pháp khác nhau để chuẩn độ NAVA bắt đầu từ PSV hoặc dựa trên đánh giá sinh lý kỹ lưỡng ở chế độ NAVA được tóm tắt trong Bảng 1. Trước khi bắt đầu bất kỳ chuẩn độnào, hãy đặt catheter EAdi thích hợp theo các khuyến nghị đã công bố [65] và công cụ định vị của nhà sản xuất (sử dụng khoảng cách tính toán và các tín hiệu nhiễu của điện tâm đồ trong tín hiệu) và chất lượng tín hiệu EAdi phải được xác nhận. Nếu EAdi thấp hoặc không có bất thường mặc dù đã đặt catheter đúng cách, hỗ trợ quá mức máy thở, an thần quá mức, ngưng thở trung ương, suy nhược cơ hoành nghiêm trọng hoặc các bệnh thần kinh cơ đã có từ trước nênđược coi là những lý do có thể gây ra EAdi thấp. Các tổn thương thần kinh hoành trực tiếp có thể cản trở việc áp dụng NAVA nếu không đo được EAdi hít vào, nhưng trường hợp này khá hiếm.
6.1 NAVA “preview”
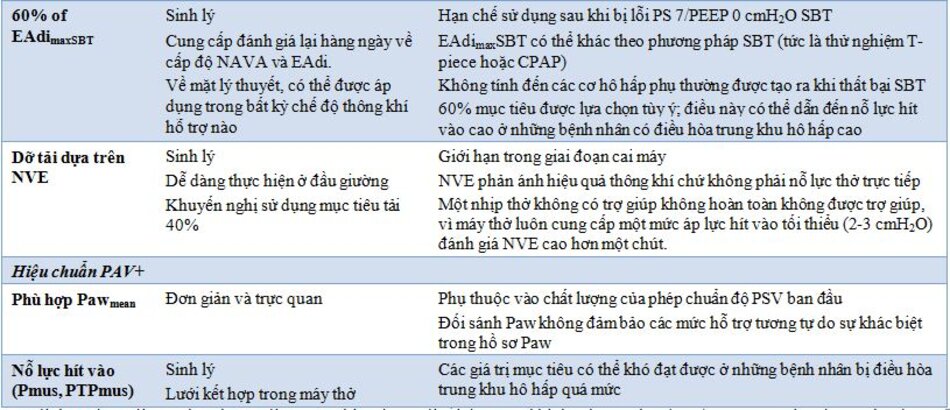
Một đường cong màu xám ( Hình 4) hiển thị trên màn hình trong quá trình PSV cho thấy “bản xem trước” của Paw ước tính sẽ tồn tại nếu bệnh nhân được thở máy ở chế độ NAVA với cài đặt tỷ lệhiện tại. Hình dạng của đường cong Paw giống với cấu hình EAdi (tức là tỷ lệ), trong khi số lượng hỗ trợ phụthuộc vào biên độ EAdi và mức NAVA đã chọn.
Mục tiêu áp lực đường thở
Phương pháp được sử dụng thường xuyên nhất là thiết lập mức NAVA sao cho hỗ trợ hít vào đạt đến cùng đỉnh Paw (Paw peak) thu được trong PSV. Tuy nhiên, khi áp dụng phương pháp này, sựkhác biệt về hình dạng của đường cong Paw giải thích tại sao áp lực được cung cấp (tức là diện tích dưới đường cong Paw) với NAVA thường thấp hơn PSV. Nên nhắm mục tiêu các mức NAVA để có được các giá trị Paw (Pawmean) trung bình tương tự [45]. Sự không chắc chắn chính về tính phù hợp của phương pháp này là liệu hỗ trợ có đầy đủ (không hỗ trợ quá mức hoặc hỗ trợ dưới mức) trong PSV hay không.
Mục tiêu thông khí
Coisel và cộng sự [66] đặt mức NAVA để đạt được thông khí trong phút tương tự như được xác định bằng cách áp dụng PSV trước 5 phút với thể tích khí lưu thông là 6–8 mL/kg PBW và tần số hô hấp 20–30 lần/phút. Tương tự như đối với mục tiêu Paw, phương pháp này phụ thuộc vào chất lượng của phép chuẩn độ PSV ban đầu. Ngoài ra, thông khí không thực sự được ‘kiểm soát’ bởi các cài đặt.
6.2 Đánh giá phản ứng sinh lý đối với trợ giúp hô hấp
Các phương pháp trên không tận dụng được nguyên lý làm việc của NAVA là chế độ tỷ lệ. Các phương pháp sau đây để chuẩn độ NAVA dựa trên thực tế là điều hòa trung khu thần kinh và nỗ lực của bệnh nhân, chứ không nhất thiết là thể tích khí lưu thông, thay đổi theo mức độ hỗ trợ hô hấp.
Phản ứng hai giai đoạn của Paw và thể tích khí lưu thông
Bắt đầu từ tình trạng máy thở không được hỗ trợ (tức là máy thở hỗ trợ tối thiểu ~ 3 cmH2O), Brander và cộng sự [67] đã đánh giá những thay đổi về Paw và thể tích khí lưu thông trong quá trình tăng từng bước mức NAVA. Một phản ứng theo hai giai đoạn đã được quan sát thấy: sự gia tăng ban đầu của mức NAVA dẫn đến sựgia tăng mạnh cảvề Paw và thể tích khí lưu thông (phản ứngđầu tiên) và tại một số điểm, tăng mức NAVA hơn nữa dẫn đến mức tăng Paw ít hơn và không thay đổi về thể tích khí lưu thông (phản ứng thứ hai). Mức NAVA tối ưu được xác định tại điểm chuyển tiếp, mô tả sự thay đổi từ mức hỗ trợ ban đầu không đủ sang mức hỗtrợ đáp ứng nhu cầu hô hấp của bệnh nhân như được chỉ ra bởi thể tích khí lưu thông ổn định.
Trong giai đoạn đầu, bệnh nhân cho phép Paw và thể tích khí lưu thông tăng lên, trong khi ở giai đoạn thứ hai này, thể tích khí lưu thông đạt mức bình nguyên (điều hòa EAdi) vì thông khí đáp ứng nhu cầu của bệnh nhân. Cùng một nhóm đã xác nhận phản ứng này ở thỏ được tải bằng sức cản [54]. Một nghiên cứu khác so sánh phương pháp này với mức NAVA ban đầu được thiết lập bằng cách sử dụng công cụ xem trước với việcđối sánh NAVA Paw peak với Pawpeak được đo trong PSV; mặc dù không đáng kể, nhưng xu hướng đánh giá quá cao mức NAVA khi sửdụng công cụ xem trước NAVA đã được báo cáo [68]. Không rõ mức độ khả thi của quy trình này vì nhiều bệnh nhân không thể hiện rõ ràng hai giai đoạn này [38].
Phần trăm EAdi tối đa trong một SBT không thành công
Ở những bệnh nhân khó cai máy, Rozé và cộng sự[69] đặt mức NAVA để thu được biên độ EAdi tương ứng với ~ 60% của đỉnh EAdi (mức được chọn tùy ý) được đo trong một thử nghiệm thở tự phát thất bại dưới PSV (PS 7 cmH2O, không có PEEP); mức này được gọi là EAdi maxSBT. Quy trình này được lặp lại hàng ngày, cho phép giảm dần mức NAVA cho đến khi rút nội khí quản. Đặt mức NAVA bằng cách sử dụng EAdimaxSBT, được cho là một mục tiêu không gây mệt mỏi và phù hợp hơn mục tiêu thể tích, nhưng có thể cần theo dõi thêm ở những bệnh nhân có điều hòa trung khu hô hấp quá mức [70].
Chỉ số hiệu quả thần kinh – thông khí (Neuroventilatory efficiency index NVE)
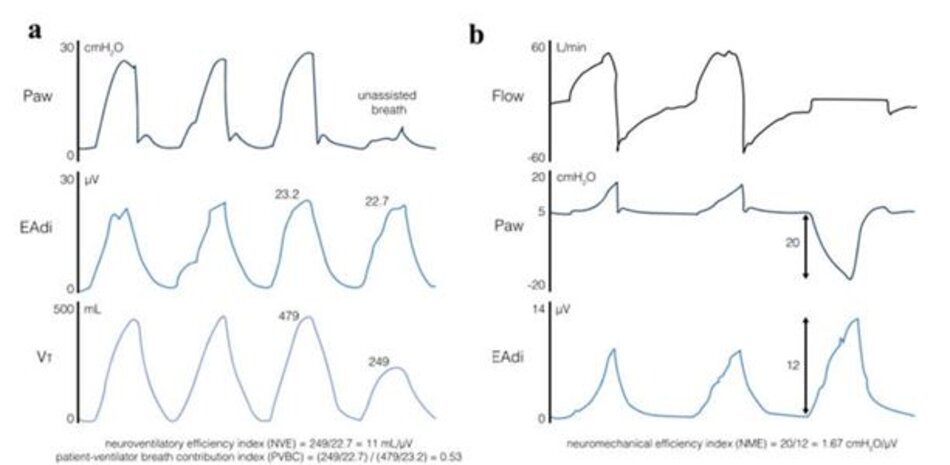
Ở những bệnh nhân đã bắt đầu cai máy, Campoccia và cộng sự [71] điều chỉnh NAVA để mục tiêu dỡ tải. Tỷ lệ không tải do máy thở cung cấp có thể được tính bằng thể tích khí lưu thông chỉdo máy thở cung cấp, chia cho tổng thể tích khí lưu thông (VTtot, thể tích do nỗ lực của bệnh nhân + hỗ trợ của máy thở). Thể tích khí lưu thông do máy thở cung cấp có thể được ước tính bằng hiệu số giữa thể tích khí lưu thôngđược hỗtrợtrừ đi thểtích khí lưu thông không hỗ trợ do bệnh nhân tạo ra. Sau đó có thể đạt được trong một lần thở không có trợ giúp, khi mức NAVA bằng không. Chỉ số hiệu quả thần kinh – thông khí (NVE) sau đó có thể được tính toán (Hình 5a). NVE mô tả khả năng chuyển EAdi thành thể tích khí lưu thông của cơ hô hấp (VT/EAdi, tính bằng mL/µV). Phần trăm không tải do máy thở cung cấp được tính như sau: (1- (NVE × EAdipeak/VTtot)) × 100%. Các mục tiêu dỡ tải 40% và 60% là khả thi để thực hiện và ít dỡ tải hơn có liên quan đến hoạt động cơ hoành lớn hơn và cải thiện thông khí ở các vùng phổi lưng phụ thuộc [71].
6.3 Bệnh nhân có điều hòa trung khu hô hấp cao
Đối với hầu hết bệnh nhân, mức NAVA có thể được giữ dưới 2,5 cmH2O/μV [38]. Tuy nhiên, việc thiết lập hỗtrợhô hấp ởnhững bệnh nhân có điều hòa trung khu hô hấp cao có thể đặc biệt khó khăn. Cần ngăn chặn mức NAVA cao để hạn chế việc hỗ trợ thông khí quá mức. Áp lực quá mức trong quá trình hít vào có thể được ngăn chặn bằng cách cài đặt cảnh báo Paw thích hợp, và NAVA sẽ tắt ở mức 3 cmH2O dưới mức Paw tối đa đã đặt. Nghịch lý thay, sự kết hợp giữa mức NAVA cao và giới hạn áp lực đã được sử dụng trong một số nghiên cứu để tạo ra một áp lực vuông như trong PSV [72–74]. Sau đó, sự hỗ trợ cao sẽ được đưa ra khi bắt đầu thở đồng thời với nhu cầu của bệnh nhân, đồng thời ngăn chặn Paw quá mức. Lưu ý, chế độ PSV kích hoạt thần kinh này vẫn chưa có sẵn để sử dụng trong lâm sàng và việc sử dụng “cài đặt báo động” để điều khiển máy thở có khả năng không an toàn và không được khuyến nghị.
6.4 Các chỉ số tiềm năng có nguồn gốc EAdi
Chỉ số đóng góp nhịp thở của bệnh nhân – máy thở
Thể tích khí lưu thông hít vào (VT,insp) trong thời gian NAVA phản ánh thể tích do nỗ lực của bệnh nhân cộng với sự hỗ trợ của máy thở tương ứng. Chỉ số “chia sẻ nỗ lực” có thể được rút ra bằng cách so sánh nhịp thở được hỗ trợ với nhịp thở không được hỗ trợ. Chỉ số đóng góp vào nhịp thở của bệnh nhân – máy thở( patient-ventilator breath contribution, PVBC) này được định nghĩa là tỷ số giữa VT,insp/ΔEAdi của nhịp thở không có trợ giúp (tức là NVE, như được mô tả ở trên) so với nhịp thở có hỗ trợ của máy thở (Hình 5a) [73, 75]:
PVBC = (VT,insp/ΔEAdi) không hỗ trợ/(VT,insp/ΔEAdi) hỗ trợ
Giá trị PVBC có thể nằm trong khoảng từ 0 (VT,insp hoàn toàn do máy thở cung cấp) và 1 (VT,insp hoàn toàn do bệnh nhân tạo ra) và đã được xác nhận dựa trên các phép đo áp lực xuyên phổi [73, 75]. Độ tin cậy của PVBC được cải thiện khi so sánh nhịp thở không trợ giúp và thở có hỗ trợ với nhịp thở tương tự (tức là biên độ và độ dốc EAdi) [ 76]. Diễn giải PVBC rất phức tạp. Ví dụ, giá trị PVBC cao có thể được tìm thấyởnhững bệnh nhân có điều hòa trung khu hô hấp thấp đã sẵn sàng cai máy (bệnh nhân nỗ lực ít nhưng đủ để thực hiện phần lớn công việc), nhưng cũng ởnhững bệnh nhân có điều hòa trung khu hô hấp quá mức (bệnh nhân đang có hỗ trợ). Việc diễn giải phải tính đến sự trợ giúp tuyệt đối của máy thở và nỗ lực của bệnh nhân.
Ước tính nỗ lực thở
Chỉ số hiệu quả thần kinh – cơ học (neuro- mechanical efciency index, NME) định lượng áp lực mà cơ hô hấp có thể tạo ra, được chuẩn hóa thành EAdi (tính bằng cmH2O/μV) [26]. Tính toán NME trong thời gian ngắn tắc nghẽn cuối kỳ thở ra (NMEoccl) có thể cho phép ước tính không xâm lấn: trong trường hợp không có lưu lượng khí, thay đổi ở Paw tương đương với thay đổi ở Pmus. Do đó, NMEoccl có thể đơn giảnđược tính ở đầu giường là Pawoccl/EAdioccl [26, 77] (Hình 5b). Nên lấy trung bình ba trong năm phép đo với độ biến thiên thấp nhất [77].
NMEoccl có thể được sử dụng để ước tính áp lực cơ hô hấp trong quá trình thở theo khí lưu thông, sử dụng công thức sau: Pmus = EAdi × NMEoccl/1,5. Hệ số hiệu chỉnh (/1,5) là bắt buộc, bởi vì khi có tắc, cơ hoành tạo ra nhiều áp lực hơn cho cùng một EAdi so với một đường thở mở [ 26]. Các tính toán của NME trong khoảng thời gian tắc nghẽn đường thở ngắn 200 ms khi bắt đầu thở máy phản ánh chặt chẽ NMEoccl [78], và ước tính nỗ lực thở máy. Một sự thay đổi trong NME cũng có thể chỉ ra việc huy động các cơ hô hấp phụ, vì EAdi không nhạy cảm với việc tuyển dụng các cơ hô hấp phụ.
Khi sử dụng PVBC và NME trong thực hành lâm sàng, điều quan trọng là phải xác nhận chất lượng tín hiệu EAdi đầy đủ, vì việc lọc tín hiệu dưới mức tối ưu có thể ảnh hưởng đến độ tin cậy của các chỉ sốnày [ 44, 76, 77].
7. Thiết lập hỗ trợ hít vào trong PAV+
Một số cách tiếp cận đãđược mô tả để thiết lập mức tăng cho PAV+ và được mô tả trong Bảng 1.
7.1 Mục tiêu áp lực đường thở
Costa và cộng sự [48] đề xuất đặt PAV+ sao cho thu được Pawmean giống như ở chế độ PSV hiện tại, và nhận thấy rằng kiểu hô hấp, trao đổi khí và nỗ lực hít vào có thể so sánh được trong khi cải thiện sựtương tác giữa bệnh nhân với máy thở.
7.2 Mục tiêu nỗ lực hít vào
Việc điều chỉnh mức độ hỗ trợ trong các chế độ tỷ lệ chủ yếu làm thay đổi hoạt động vận động của cơ hô hấp, vì thể tích khí lưu thông tương đối không đổi, thời gian bơm phồng được giữ gần với thời gian hít vào của thần kinh, và sự thay đổi và đồng bộnhịp thở được duy trì. Về mặt lý thuyết, do đó, lượng cơ hô hấp không hoạt động sẽ là mục tiêu thích hợp để điều chỉnh mức độ hỗ trợ theo các chế độtỷ lệnhằm tối ưu hóa các tương tác giữa bệnh nhân và máy thở. Carteaux và cộng sự[ 14] đã đánh giá tính khả thi của việc thiết lập mức tăng PAV+ để nhắm đến một phạm vi nỗ lực được xác định trước. Họ đã sử dụng khả năng của PAV+ để cung cấp một áp lực tỷ lệ với Pmus, trong đó Pmus được tính toán lại dựa trên các ước tính từ Paw:
Pmuspeak = (Pawpeak − PEEP) × ((100 − % hỗ trợ)/% hỗ trợ).
Một lưới được xây dựng từ phương trình này có sẵn trên màn hình máy thở, cung cấp một Pmuspeak ước tính cho mỗi sự kết hợp giữa gain và delta Paw (tức là Pawpeak – PEEP). Pmus từ 5 đến 10 cmH2O được xác định là một mục tiêu tốt để nhắm mục tiêu sản phẩm áp lực cơ hô hấp theo thời gian (PTPmus, tức là vùng dưới đường cong Pmus trong khi hít vào) từ 50 đến 150 cmH2O.s.min-1. Mức tăng ban đầu được đặt thành 50%, và sau đó được điều chỉnh để đạt được các giá trị Pmuspeak trong phạm vi mục tiêu 5– 10. Phương pháp này đã được chứng minh là khả thi trong thực hành lâm sàng ở hầu hết các bệnh nhân. Tuy nhiên, cần lưu ý rằng các phép đo nỗ lực do máy thở cung cấp có thể đánh giá thấp hoạt động thởthực sựcủa bệnh nhân, đặc biệt khi PEEP nội tại cao [79]. Các giá trị mục tiêu có thể khó đạt được ở những bệnh nhân có điều hòa trung khu hô hấp quá mức và suy giảm cơ học hô hấp do phản xạ bảo vệ phổi có thể bị ghi đè [35, 57].
7.3 Giám sát nỗ lực
Trong PAV+, các giá trị sức cản và độ đàn hồi của hệ hô hấp đo được cung cấp thông tin về cơ học hô hấp và những thay đổi của chúng theo thời gian hoặc để đáp ứng với các mức độ hỗ trợ hô hấp khác nhau [10, 11]. Bởi vì độ giãn nở và thể tích khí lưu thông được cung cấp, áp lực lái xe được giám sát dễ dàng. Hơn nữa, với các thông số này, máy thở có thể ước lượng Pmus trên cơ sở bán liên tục, phát hiện những thay đổi trong nỗ lực của bệnh nhân theo thời gian [4, 14].
8. Sự khác biệt với các chế độ tự động
Các chế độ thông khí tự động như thông khí hỗ trợ thíchứng (ASV) và SmartCare ™ liên tục điều chỉnh các cài đặt máy thở nhất định để giữ các biến hô hấp của bệnh nhân trong phạm vi mục tiêu do bác sĩ lâm sàng đặt ra [ 4, 80]. Mặc dù NAVA, PAV+ và các chế độ tự động đều tích hợp các nguyên tắc vòng kín, nhưng điều quan trọng cần nhấn mạnh là các chế độ tự động không cung cấp hỗ trợ tương xứng, cũng như đo lường trực tiếp nỗ lực của bệnh nhân. Ngược lại, các chế độ tự động kết hợp các thuật toán cố gắng đạt được kết quả mong muốn bằng cách tự động sửa đổi cài đặt máy thở theo những thay đổi trong tình trạng của bệnh nhân [80]. Điều này có thể làm giảm công việc của bác sĩ. Trong số đó, ASV kiểm soát thông khí theo phút bằng cách tìm ra sự kết hợp tối ưu giữa tần số hô hấp và thểtích khí lưu thông bằng cách sử dụng ước tính hằng số thời gian của hệ hô hấp [81]. Điều này dựa trên các mô hình của Otis [82] và Mead [83], công nhận rằng có một nhịp hô hấp tối ưu giúp giảm thiểu nỗ lực thở. ASV thích hợp cho cả bệnh nhân thở thụ động và tựphát, nhưng không nhất thiết cung cấp thông khí bảo vệ phổi, điều này phụ thuộc vào các thông số ban đầu do bác sĩ lâm sàng thiết lập [84, 85]. Với điều kiện là nó được lập trình phù hợp, ASV có thể cung cấp hệ thống thông khí an toàn trong cộngđồng dân cư nói chung; tuy nhiên, cần thận trọng ở những bệnh nhân tổn thương phổi cấp tính với độ giãn nở ít bị tổn hại hơn vì thể tích khí lưu thông cao hơn có thể xảy ra [86]. Một sự khác biệt quan trọng giữa chế độ tự động và chế độ tỷ lệ là tầm quan trọng lớn hơn, với chế độ trước đây, về cách bác sĩ lâm sàng điều chỉnh chính xác các cài đặt. Các nghiên cứu đã chỉ ra rằng ASV làm giảm thời gian cai máy thường xuyên nhất ở giai đoạn hậu phẫu [87, 88]. Chế độ ASV vòng kín hoàn toàn được phát triển hơn nữa, IntelliVent- ASV, kết hợp kiểm soát bổ sung độ bão hòa oxy và CO2 cuối triều và đã cho thấy là khả thi và có thể cung cấp thông khí bảo vệtươngđối ởnhững bệnh nhân thở thụ động và tự phát với các tình trạng phổi khác nhau [81, 89]. Giao thức cai máy IntelliVent- ASV tự động cung cấp tự động giảm dần mức độ hỗ trợ hô hấp trong khi đánh giá mức độ sẵn sàng đối với các tiêu chí cai máy và có liên quan đến việc giảm thời gian thở máy ở các cơ sở khác nhau [ 87, 88]. SmartCare ™, một chế độdựa trên PSV, được thiết kế đặc biệt để tự động hỗ trợ và đẩy nhanh quá trình cai máy. Nó chủ yếu dựa trên tần số hô hấp và cũng tích hợp các giá trị của thể tích khí lưu thông và CO2 cuối triều [90, 91]. Dựa trên các đặc điểm và mục tiêu nhất định của bệnh nhân do bác sĩ lâm sàng đặt ra, cai máy tự động liên quan đến việcđiều chỉnh mức PSV, tiếp theo là tự động giảm dần mức PSV và kiểm tra cai máy khi mức hỗ trợ đủ thấp [91]. So với các chiến lược cai máy không tự động, việc giảm thời gian cai máy bằng SmartCare ™ đã được chứng minh trong một số nghiên cứu; Các nghiên cứu lâm sàng ngẫu nhiên được cung cấp đầy đủ được đảm bảo [92, 93].
9. Kết luận
Trong quá trình máy thở PSV hỗ trợ quá mức và tương tác kém giữa máy thở với bệnh nhân là phổ biến và thường không được chú ý. Chế độ thông khí theo tỷ lệ cải thiện sự phù hợp giữa bệnh nhân và máy thở và cung cấp tiềm năng cho cả thông khí bảo vệ phổi và cơ hoành. Một thách thức quan trọng là điều chỉnh mức hỗ trợ hô hấp tại giường bệnh, vì mục tiêu tối ưu của nỗ lực cơ hô hấp có thể khác nhau giữa các bệnh nhân và trong quá trình bệnh nặng. Trong PAV+, hỗ trợ hô hấp điều chỉnh để đạt được mục tiêu Pmus là khả thi và cho phép theo dõi nỗ lực thở. Trong NAVA, nó có thể được đề xuất như một cách tiếp cận đầu tiên để thiết lập các mức hỗ trợ hít vào thông qua đối sánh Paw mean như thu được trong PSV, đây là một phương pháp đơn giản và khả thi để thực hiện tại giường bệnh và điều chỉnh lại sau đó. Các chỉ số có nguồn gốc từ EAdi như NME và PVBC hứa hẹn trong tương lai, nhưng cần có các nghiên cứu sâu hơn về việc sử dụng chúng trong quá trình thở máy và trong các thử nghiệm cai máy. Các chế độ tự động khác nhau bằng cách yêu cầu bác sĩ thiết lập các thông số để đạt được một mục tiêu thông khí nhất định.
10. Tài liệu tham khảo
1. Vaporidi K. NAVA and PAV+ for lung and diaphragm protection. Curr Opin Crit Care. 2020;26:41–46. doi: 10.1097/MCC.0000000000000684. [PubMed] [CrossRef] [Google Scholar]
2. Younes M. Proportional assist ventilation, a new approach to ventilatory support: theory. Am Rev Respir Dis. 1992;145:114–120. doi: 10.1164/ajrccm/145.1.114. [PubMed] [CrossRef] [Google Scholar]
3. Sinderby C, Navalesi P, Beck J, et al. Neural control of mechanical ventilation in respiratory failure. Nat Med. 1999;5:1433–1436. doi: 10.1038/71012. [PubMed] [CrossRef] [Google Scholar]
4. Suarez-Sipmann F. New modes of assisted mechanical ventilation. Med Intensive Engl Ed. 2014;38:249–260. doi: 10.1016/j.medine.2014.04.001. [PubMed] [CrossRef] [Google Scholar]
5. Goligher EC, Fan E, Herridge MS, et al. Evolution of diaphragm thickness during mechanical ventilation impact of inspiratory effort. Am J Respir Crit Care Med. 2015;192:1080–1088. doi: 10.1164/rccm.201503-0620OC. [PubMed] [CrossRef] [Google Scholar]
6. Kondili E, Prinianakis G, Georgopoulos D. Patient-ventilator interaction. Br J Anaesth. 2003;91:106–119. doi: 10.1093/bja/aeg129. [PubMed] [CrossRef] [Google Scholar]
7. Leung P, Jubran A, Tobin MJ. Comparison of assisted ventilator modes on triggering, patient effort, and dyspnea. Am J Respir Crit Care Med. 1997;155:1940–1948. doi: 10.1164/ajrccm.155.6.9196100. [PubMed] [CrossRef] [Google Scholar]
8. Thille AW, Cabello B, Galia F, et al. Reduction of patient-ventilator asynchrony by reducing tidal volume during pressure-support ventilation. Intensive Care Med. 2008;34:1477–1486. doi: 10.1007/s00134-008-1121-9. [PubMed] [CrossRef] [Google Scholar]
9. Colombo D, Cammarota G, Alemani M, et al. Efficacy of ventilator waveforms observation in detecting patient– ventilator asynchrony. Crit Care Med. 2011;39:2452–2457. doi: 10.1097/CCM.0b013e318225753c. [PubMed] [CrossRef] [Google Scholar]
10. Younes M, Kun J, Masiowski B, et al. A method for noninvasive determination of inspiratory resistance during proportional assist ventilation. Am J Respir Crit Care Med. 2001;163:829–839. doi: 10.1164/ajrccm.163.4.2005063. [PubMed] [CrossRef] [Google Scholar]
11. Younes M, Webster K, Kun J, et al. A method for measuring passive elastance during proportional assist ventilation. Am J Respir Crit Care Med. 2001;164:50–60. doi: 10.1164/ajrccm.164.1.2010068. [PubMed] [CrossRef] [Google Scholar]
12. Xirouchaki N, Kondili E, Klimathianaki M, Georgopoulos D. Is proportional-assist ventilation with load-adjustable gain factors a user-friendly mode? Intensive Care Med. 2009;35:1599–1603. doi: 10.1007/s00134-009-1524-2. [PubMed] [CrossRef] [Google Scholar]
13. Terzi N, Piquilloud L, Rozé H, et al. Clinical review: update on neurally adjusted ventilatory assist – report of a round- table conference. Crit Care. 2012;16:225. doi: 10.1186/cc11297. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
14. Carteaux G, Mancebo J, Mercat A, et al. Bedside adjustment of proportional assist ventilation to target a predefined range of respiratory effort. Crit Care Med. 2013;41:2125–2132. doi: 10.1097/CCM.0b013e31828a42e5. [PubMed] [CrossRef] [Google Scholar]
15. Telias I, Brochard L, Goligher EC. Is my patient’s respiratory drive (too) high? Intensive Care Med. 2018;44:1936– 1939. doi: 10.1007/s00134-018-5091-2. [PubMed] [CrossRef] [Google Scholar]
16. Yoshida T, Nakahashi S, Nakamura MAM, et al. Volume-controlled ventilation does not prevent injurious inflation during spontaneous effort. Am J Respir Crit Care Med. 2017;196:590–601. doi: 10.1164/rccm.201610-1972OC. [PubMed] [CrossRef] [Google Scholar]
17. Jonkman AH, de Vries HJ, Heunks LMA. Physiology of the respiratory drive in icu patients: implications for diagnosis and treatment. Crit Care. 2020;24:104. doi: 10.1186/s13054-020-2776-z. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
18. Demoule A, Clavel M, Rolland-Debord C, et al. Neurally adjusted ventilatory assist as an alternative to pressure support ventilation in adults: a French multicentre randomized trial. Intensive Care Med. 2016;42:1723–1732. doi: 10.1007/s00134-016-4447-8. [PubMed] [CrossRef] [Google Scholar]
19. Kataoka J, Kuriyama A, Norisue Y, Fujitani S. Proportional modes versus pressure support ventilation: a systematic review and meta-analysis. Ann Intensive Care. 2018;8:123. doi: 10.1186/s13613-018-0470-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
20. Liu L, Xu X, Sun Q, et al (2020) Neurally adjusted ventilatory assist versus pressure support ventilation in diffiult weaning. Anesthesiology 1482–93 [PubMed]
21. Hadfield DJ, Rose L, Reid F, et al. Neurally adjusted ventilatory assist versus pressure support ventilation: a randomized controlled feasibility trial performed in patients at risk of prolonged mechanical ventilation. Crit Care. 2020;24:220. doi: 10.1186/s13054-020-02923-5. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
22. Esteban A, Ferguson ND, Meade MO, et al. Evolution of mechanical ventilation in response to clinical research. Am J Respir Crit Care Med. 2008;177:170–177. doi: 10.1164/rccm.200706-893OC. [PubMed] [CrossRef] [Google Scholar]
23. Tobin MJ, Gardner W. Principles and practice of intensive care monitoring. New York: McGraw-Hill; 1998. Monitoring the control of breathing; pp. 415–464. [Google Scholar]
24. Telias I, Spadaro S. Techniques to monitor respiratory drive and inspiratory effort. Curr Opin Crit Care. 2020;26:3–
10. doi: 10.1097/MCC.0000000000000680. [PubMed] [CrossRef] [Google Scholar]
25. Beck J, Gottfried SB, Navalesi P, et al. Electrical activity of the diaphragm during pressure support ventilation in acute respiratory failure. Am J Respir Crit Care Med. 2001;164:419–424. doi: 10.1164/ajrccm.164.3.2009018. [PubMed] [CrossRef] [Google Scholar]
26. Bellani G, Mauri T, Coppadoro A, et al. Estimation of patient’s inspiratory effort from the electrical activity of the diaphragm. Crit Care Med. 2013;41:1483–1491. doi: 10.1097/CCM.0b013e31827caba0. [PubMed] [CrossRef] [Google Scholar]
27. Sinderby C, Beck J, Spahija J, et al. Inspiratory muscle unloading by neurally adjusted ventilatory assist during maximal inspiratory efforts in healthy subjects. Chest. 2007;131:711–717. doi: 10.1378/chest.06-1909. [PubMed] [CrossRef] [Google Scholar]
28. Spinelli E, Mauri T, Beitler JR, et al. Respiratory drive in the acute respiratory distress syndrome: pathophysiology, monitoring, and therapeutic interventions. Intensive Care Med. 2020;46:606–618. doi: 10.1007/s00134-020-05942-6. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
29. Tang G-J, Kou YR, Lin YS (1998) Peripheral neural modulation of endotoxin-induced hyperventilation. Crit Care Med 26 [PubMed]
30. Jacono FJ, Mayer CA, Hsieh Y-H, et al. Lung and brainstem cytokine levels are associated with breathing pattern changes in a rodent model of acute lung injury. Respir Physiol Neurobiol. 2011;178:429–438. doi: 10.1016/j.resp.2011.04.022. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
31. Lilitsis E, Stamatopoulou V, Andrianakis E, et al. Inspiratory effort and breathing pattern change in response to varying the assist level: a physiological study. Respir Physiol Neurobiol. 2020 doi: 10.1016/j.resp.2020.103474. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
32. Kacmarek RM. Proportional assist ventilation and neurally adjusted ventilatory assist. Respir Care. 2011;56:140–152. doi: 10.4187/respcare.01021. [PubMed] [CrossRef] [Google Scholar]
33. Georgopoulos D, Mitrouska I, Webster K, et al. Effects of inspiratory muscle unloading on the response of respiratory motor output to CO2. Am J Respir Crit Care Med. 1997;155:2000–2009. doi: 10.1164/ajrccm.155.6.9196108. [PubMed] [CrossRef] [Google Scholar]
34. Georgopoulos D, Mitrouska I, Bshouty Z, et al. Respiratory response to co2 during pressure-support ventilation in conscious normal humans. Am J Respir Crit Care Med. 1997;156:146–154. doi: 10.1164/ajrccm.156.1.9606055. [PubMed] [CrossRef] [Google Scholar]
35. Vaporidi K, Akoumianaki E, Telias I, et al. Respiratory drive in critically ill patients. Pathophysiology and clinical implications. Am J Respir Crit Care Med. 2020;201:20–32. doi: 10.1164/rccm.201903-0596SO. [PubMed] [CrossRef] [Google Scholar]
36. Mitrouska J, Xirouchaki N, Patakas D, et al. Effects of chemical feedback on respiratory motor and ventilatory output during different modes of assisted mechanical ventilation. Eur Respir J. 1999;13:873. doi: 10.1034/j.1399- 3003.1999.13d30.x. [PubMed] [CrossRef] [Google Scholar]
37. Brochard L, Harf A, Lorino H, Lemaire F. Inspiratory pressure support prevents diaphragmatic fatigue during weaning from mechanical ventilation. Am Rev Respir Dis. 1989;139:513–521. doi: 10.1164/ajrccm/139.2.513. [PubMed] [CrossRef] [Google Scholar]
38. Carteaux G, Córdoba-Izquierdo A, Lyazidi A, et al. Comparison between neurally adjusted ventilatory assist and pressure support ventilation levels in terms of respiratory effort. Crit Care Med. 2016;44:503–511. doi: 10.1097/CCM.0000000000001418. [PubMed] [CrossRef] [Google Scholar]
39. Parthasarathy S, Tobin MJ. Effect of ventilator mode on sleep quality in critically ill patients. Am J Respir Crit Care Med. 2002;166:1423–1429. doi: 10.1164/rccm.200209-999OC. [PubMed] [CrossRef] [Google Scholar]
40. Marini JJ, Rodriguez RM, Lamb V. The Inspiratory workload of patient-initiated mechanical ventilation. Am Rev Respir Dis. 1986;134:902–909. doi: 10.1164/arrd.1986.134.5.902. [PubMed] [CrossRef] [Google Scholar]
41. Doorduin J, Sinderby C, Beck J, et al. Assisted ventilation in patients with acute respiratory distress syndrome: lung- distending pressure and patient-ventilator interaction. Anesthesiology. 2015 doi: 10.1183/13993003.congress- 2015.OA4478. [PubMed] [CrossRef] [Google Scholar]
42. Patroniti N, Bellani G, Saccavino E, et al. Respiratory pattern during neurally adjusted ventilatory assist in acute respiratory failure patients. Intensive Care Med. 2012;38:230–239. doi: 10.1007/s00134-011-2433-8. [PubMed] [CrossRef] [Google Scholar]
43. Spahija J, de Marchie M, Albert M, et al. Patient-ventilator interaction during pressure support ventilation and neurally adjusted ventilatory assist. Crit Care Med. 2010;38:518–526. doi: 10.1097/CCM.0b013e3181cb0d7b. [PubMed] [CrossRef] [Google Scholar]
44. Jonkman AH, Roesthuis LH, de Boer EC, et al. Inadequate assessment of patient-ventilator interaction due to suboptimal diaphragm electrical activity signal filtering. Am J Respir Crit Care Med. 2020;202:141–144. doi: 10.1164/rccm.201912-2306LE. [PubMed] [CrossRef] [Google Scholar]
45. Cecchini J, Schmidt M, Demoule A, Similowski T. Increased diaphragmatic contribution to inspiratory effort during neurally adjusted ventilatory assistance versus pressure support: an electromyographic study. Anesthesiology. 2014;121:1028–1036. doi: 10.1097/ALN.0000000000000432. [PubMed] [CrossRef] [Google Scholar]
46. Blankman P, Hasan D, van Mourik MS, Gommers D. Ventilation distribution measured with EIT at varying levels of pressure support and neurally adjusted ventilatory assist in patients with ALI. Intensive Care Med. 2013;39:1057–1062. doi: 10.1007/s00134-013-2898-8. [PubMed] [CrossRef] [Google Scholar]
47. Di Mussi R, Spadaro S, Mirabella L, et al. Impact of prolonged assisted ventilation on diaphragmatic efficiency: NAVA versus PSV. Crit Care. 2015;20:1. doi: 10.1186/s13054-015-1178-0. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
48. Costa R, Spinazzola G, Cipriani F, et al. A physiologic comparison of proportional assist ventilation with load- adjustable gain factors (PAV+) versus pressure support ventilation (PSV) Intensive Care Med. 2011;37:1494–1500. doi: 10.1007/s00134-011-2297-y. [PubMed] [CrossRef] [Google Scholar]
49. Kondili E, Prinianakis G, Alexopoulou C, et al. Respiratory load compensation during mechanical ventilation: proportional assist ventilation with load-adjustable gain factors versus pressure support. Intensive Care Med. 2006;32:692–699. doi: 10.1007/s00134-006-0110-0. [PubMed] [CrossRef] [Google Scholar]
50. Akoumianaki E, Prinianakis G, Kondili E, et al. Physiologic comparison of neurally adjusted ventilator assist, proportional assist and pressure support ventilation in critically ill patients. Respir Physiol Neurobiol. 2014;203:82–89. doi: 10.1016/j.resp.2014.08.012. [PubMed] [CrossRef] [Google Scholar]
51. Wrigge H, Golisch W, Zinserling J, et al. Proportional assist versus pressure support ventilation: effects on breathing pattern and respiratory work of patients with chronic obstructive pulmonary disease. Intensive Care Med. 1999;25:790– 798. doi: 10.1007/s001340050954. [PubMed] [CrossRef] [Google Scholar]
52. Piquilloud L, Vignaux L, Bialais E, et al. Neurally adjusted ventilatory assist improves patient–ventilator interaction. Intensive Care Med. 2011;37:263–271. doi: 10.1007/s00134-010-2052-9. [PubMed] [CrossRef] [Google Scholar]
53. Schmidt M, Kindler F, Cecchini J, et al. Neurally adjusted ventilatory assist and proportional assist ventilation both improve patient-ventilator interaction. Crit Care. 2015;19:56. doi: 10.1186/s13054-015-0763-6. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
54. Lecomte F, Brander L, Jalde F, et al. Physiological response to increasing levels of neurally adjusted ventilatory assist (NAVA) Respir Physiol Neurobiol. 2009;166:117–124. doi: 10.1016/j.resp.2009.02.015. [PubMed] [CrossRef] [Google Scholar]
55. Leiter JC, Manning HL. The Hering-Breuer reflex, feedback control, and mechanical ventilation: the promise of neurally adjusted ventilatory assist. Crit Care Med. 2010;38:1915–1916. doi: 10.1097/CCM.0b013e3181ee4039. [PubMed] [CrossRef] [Google Scholar]
56. Smith J, Bellemare F. Effect of lung volume on in vivo contraction characteristics of human diaphragm. J Appl Physiol. 1987;62:1893–1900. doi: 10.1152/jappl.1987.62.5.1893. [PubMed] [CrossRef] [Google Scholar]
57. Vaporidi K, Psarologakis C, Proklou A, et al. Driving pressure during proportional assist ventilation: an observational study. Ann Intensive Care. 2019;9:1. doi: 10.1186/s13613-018-0477-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
58. Xirouchaki N, Kondili E, Vaporidi K, et al. Proportional assist ventilation with load-adjustable gain factors in critically ill patients: comparison with pressure support. Intensive Care Med. 2008;34:2026–2034. doi: 10.1007/s00134- 008-1209-2. [PubMed] [CrossRef] [Google Scholar]
59. Bosma KJ, Read BA, Bahrgard Nikoo MJ, et al. A pilot randomized trial comparing weaning from mechanical ventilation on pressure support versus proportional assist ventilation. Crit Care Med. 2016;44:1098–1108. doi: 10.1097/CCM.0000000000001600. [PubMed] [CrossRef] [Google Scholar]
60. Bosma K, Ferreyra G, Ambrogio C, et al. Patient-ventilator interaction and sleep in mechanically ventilated patients: pressure support versus proportional assist ventilation. Crit Care Med. 2007;35:1048–1054. doi: 10.1097/01.CCM.0000260055.64235.7C. [PubMed] [CrossRef] [Google Scholar]
61. Delisle S, Ouellet P, Bellemare P, et al. Sleep quality in mechanically ventilated patients: comparison between NAVA and PSV modes. Ann Intensive Care. 2011;1:42. doi: 10.1186/2110-5820-1-42. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
62. Alexopoulou C, Kondili E, Plataki M, Georgopoulos D. Patient–ventilator synchrony and sleep quality with proportional assist and pressure support ventilation. Intensive Care Med. 2013;39:1040–1047. doi: 10.1007/s00134-013- 2850-y. [PubMed] [CrossRef] [Google Scholar]
63. Fernández-Vivas M, Caturla-Such J, de la Rosa JG, et al. Noninvasive pressure support versus proportional assist ventilation in acute respiratory failure. Intensive Care Med. 2003;29:1126–1133. doi: 10.1007/s00134-003-1768-1. [PubMed] [CrossRef] [Google Scholar]
64. de la Oliva P, Schüffelmann C, Gómez-Zamora A, et al. Asynchrony, neural drive, ventilatory variability and COMFORT: NAVA versus pressure support in pediatric patients. A non-randomized cross-over trial. Intensive Care Med. 2012;38:838–846. doi: 10.1007/s00134-012-2535-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
65. Sinderby C, Beck J. Neurally adjusted ventilatory assist. In: Martin JT, editor. Principles and practice of mechanical ventilation. 3. New York: McGraw-Hill; 2013. pp. 351–375. [Google Scholar]
66. Coisel Y, Chanques G, Jung B, et al. Neurally adjusted ventilatory assist in critically ill postoperative patients: a crossover randomized study. Anesthesiology. 2010;113:925–935. doi: 10.1097/ALN.0b013e3181ee2ef1. [PubMed] [CrossRef] [Google Scholar]
67. Brander L, Leong-Poi H, Beck J, et al. Titration and implementation of neurally adjusted ventilatory assist in critically ill patients. Chest. 2009;135:695–703. doi: 10.1378/chest.08-1747. [PubMed] [CrossRef] [Google Scholar]
68. Barwing J, Linden N, Ambold M, et al. Neurally adjusted ventilatory assist vs. pressure support ventilation in critically ill patients: an observational study. Acta Anaesthesiol Scand. 2011;55:1261–1271. doi: 10.1111/j.1399- 6576.2011.02522.x. [PubMed] [CrossRef] [Google Scholar]
69. Rozé H, Lafrikh A, Perrier V, et al. Daily titration of neurally adjusted ventilatory assist using the diaphragm electrical activity. Intensive Care Med. 2011;37:1087–1094. doi: 10.1007/s00134-011-2209-1. [PubMed] [CrossRef] [Google Scholar]
70. Bertoni M, Telias I, Urner M, et al. A novel non-invasive method to detect excessively high respiratory effort and dynamic transpulmonary driving pressure during mechanical ventilation. Crit Care. 2019;23:346. doi: 10.1186/s13054- 019-2617-0. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
71. Campoccia Jalde F, Jalde F, Wallin MKEB, et al. Standardized unloading of respiratory muscles during neurally adjusted ventilatory assist: a randomized crossover pilot study. Anesthesiology. 2018;129:769–777. doi: 10.1097/ALN.0000000000002335. [PubMed] [CrossRef] [Google Scholar]
72. Cammarota G, Longhini F, Perucca R, et al. New setting of neurally adjusted ventilatory assist during noninvasive ventilation through a helmet. Anesthesiology. 2016;125:1181–1189. doi: 10.1097/ALN.0000000000001354. [PubMed] [CrossRef] [Google Scholar]
73. Liu L, Xia F, Yang Y, et al. Neural versus pneumatic control of pressure support in patients with chronic obstructive pulmonary diseases at different levels of positive end expiratory pressure: a physiological study. Crit Care. 2015;19:244. doi: 10.1186/s13054-015-0971-0. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
74. Beloncle F, Piquilloud L, Rittayamai N, et al. A diaphragmatic electrical activity-based optimization strategy during pressure support ventilation improves synchronization but does not impact work of breathing. Crit Care. 2017;21:21. doi: 10.1186/s13054-017-1599-z. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
75. Grasselli G, Beck J, Mirabella L, et al. Assessment of patient–ventilator breath contribution during neurally adjusted ventilatory assist. Intensive Care Med. 2012;38:1224–1232. doi: 10.1007/s00134-012-2588-y. [PubMed] [CrossRef] [Google Scholar]
76. Jonkman AH, Jansen D, Gadgil S, et al. Monitoring patient-ventilator breath contribution in the critically ill during neurally adjusted ventilatory assist: reliability and improved algorithms for bedside use. J Appl Physiol. 2019;127:264–
271. doi: 10.1152/japplphysiol.00071.2019. [PubMed] [CrossRef] [Google Scholar]
77. Jansen D, Jonkman AH, Roesthuis L, et al. Estimation of the diaphragm neuromuscular efficiency index in mechanically ventilated critically ill patients. Crit Care. 2018;22:238. doi: 10.1186/s13054-018-2172-0. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
78. Coppadoro A, Rona R, Bellani G, Foti G. A brief airway occlusion is sufficient to measure the patient’s inspiratory effort/electrical activity of the diaphragm index (PEI) J Clin Monit Comput. 2020 doi: 10.1007/s10877-020-00459-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
79. Beloncle F, Akoumianaki E, Rittayamai N, et al. Accuracy of delivered airway pressure and work of breathing estimation during proportional assist ventilation: a bench study. Ann Intensive Care. 2016;6:30. doi: 10.1186/s13613-016- 0131-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
80. van der Staay M, Chatburn RL. Advanced modes of mechanical ventilation and optimal targeting schemes. Intensive Care Med Exp. 2018;6:30. doi: 10.1186/s40635-018-0195-0. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
81. Arnal J-M, Wysocki M, Novotni D, et al. Safety and efficacy of a fully closed-loop control ventilation (IntelliVent- ASV®) in sedated ICU patients with acute respiratory failure: a prospective randomized crossover study. Intensive Care Med. 2012;38:781–787. doi: 10.1007/s00134-012-2548-6. [PubMed] [CrossRef] [Google Scholar]
82. Otis AB, Fenn WO, Rahn H. Mechanics of breathing in man. J Appl Physiol. 1950;2:592–607. doi: 10.1152/jappl.1950.2.11.592. [PubMed] [CrossRef] [Google Scholar]
83. Mead J. Control of respiratory frequency. J Appl Physiol. 1960;15:325–336. doi: 10.1152/jappl.1960.15.3.325. [CrossRef] [Google Scholar]
84. Sulemanji D, Marchese A, Garbarini P, et al. Adaptive support ventilation: an appropriate mechanical ventilation strategy for acute respiratory distress syndrome? Anesthesiology. 2009;111:863–870. doi: 10.1097/ALN.0b013e3181b55f8f. [PubMed] [CrossRef] [Google Scholar]
85. Dongelmans DA, Veelo DP, Bindels A, et al. Determinants of tidal volumes with adaptive support ventilation: a multicenter observational study. Anesth Analg. 2008;107:932–937. doi: 10.1213/ane.0b013e31817f1dcf. [PubMed] [CrossRef] [Google Scholar]
86. Dongelmans DA, Paulus F, Veelo DP, et al. Adaptive support ventilation may deliver unwanted respiratory rate–tidal volume combinations in patients with acute lung injury ventilated according to an open lung concept. Anesthesiology. 2011;114:1138–1143. doi: 10.1097/ALN.0b013e31820d8676. [PubMed] [CrossRef] [Google Scholar]
87. Gruber PC, Gomersall CD, Leung P, et al. Randomized controlled trial comparing adaptive-support ventilation with pressure-regulated volume-controlled ventilation with automode in weaning patients after cardiac surgery. Anesthesiology. 2008;109:81–87. doi: 10.1097/ALN.0b013e31817881fc. [PubMed] [CrossRef] [Google Scholar]
88. Chen C-W, Wu C-P, Dai Y-L, et al. Effects of implementing adaptive support ventilation in a medical intensive care unit. Respir Care. 2011;56:976–983. doi: 10.4187/respcare.00966. [PubMed] [CrossRef] [Google Scholar]
89. Arnal J-M, Garnero A, Novonti D, et al. Feasibility study on full closed-loop control ventilation (IntelliVent-ASV™) in ICU patients with acute respiratory failure: a prospective observational comparative study. Crit Care. 2013;17:R196. doi: 10.1186/cc12890. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
90. Lellouche F, Mancebo J, Jolliet P, et al. A multicenter randomized trial of computer-driven protocolized weaning from mechanical ventilation. Am J Respir Crit Care Med. 2006;174:894–900. doi: 10.1164/rccm.200511-1780OC. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
91. Dojat M, Brochard L, Lemaire F, Harf A. A knowledge-based system for assisted ventilation of patients in intensive care units. Int J Clin Monit Comput. 1992;9:239–250. doi: 10.1007/BF01133619. [PubMed] [CrossRef] [Google Scholar]
92. Burns KE, Lellouche F, Nisenbaum R, et al. Automated weaning and SBT systems versus non-automated weaning strategies for weaning time in invasively ventilated critically ill adults. Cochrane Database Syst Rev. 2014 doi: 10.1002/14651858.CD008638.pub2. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
93. Lellouche F, Brochard L. Advanced closed loops during mechanical ventilation (PAV, NAVA, ASV, SmartCare) Best Pract Res Clin Anaesthesiol. 2009;23:81–93. doi: 10.1016/j.bpa.2008.08.001. [PubMed] [CrossRef] [Google Scholar]





