Tác giả: Bác sĩ Đặng Thanh Tuấn
Tóm tắt
Tổn thương não do chấn thương (TBI, Traumatic brain injury) là một vấn đề lớn về y tế và kinh tế – xã hội và là nguyên nhân hàng đầu gây tử vong ở trẻ em và thanh thiếu niên. Việc xử trí chăm sóc tích cực cho TBI nghiêm trọng chủ yếu xuất phát từ “Guidelines for the Management of Severe Traumatic Brain Injury” đã được Brain Trauma Foundation phát hành. Mục tiêu chính là phòng ngừa và điều trị tăng áp lực nội sọ (ICP, intracranial pressure) và tổn thương não thứ phát, duy trì áp suất tưới máu não (CPP, cerebral perfusion pressure) và tối ưu hóa oxy hóa não. Trong bài tổng quan này, việc quản lý chăm sóc đặc biệt các bệnh TBI nặng sẽ được thảo luận với trọng tâm là giám sát, tránh và giảm thiểu những tổn thương não thứ phát, và tối ưu hoá việc oxy hóa não và CPP.
Giới thiệu
Tổn thương não do chấn thương (TBI) nặng, được định nghĩa là chấn thương đầu có điểm GCS (Glasgow Coma Scale) từ 3 đến 8 [1], là một vấn đề lớn và thách thức trong chăm sóc tích cực. Trong 20 năm qua, đã có rất nhiều bài học với một tiến bộ đáng kể trong việc xử trí chăm sóc tích cực TBI nặng. Năm 1996, Tổ chức Chấn thương não (Brain Trauma Foundation – BTF) đã đưa ra những hướng dẫn đầu tiên về việc xử trí TBI nặng, đã được Hiệp hội Bác sĩ thần kinh Hoa Kỳ chấp nhận và được Tổ chức Y tế Thế giới tại Khoa Thần kinh học thông qua. Phiên bản sửa đổi lần thứ hai đã được xuất bản năm 2000 với một bản cập nhật vào năm 2003, và ấn bản thứ ba đã được xuất bản năm 2007 [4]. Một số nghiên cứu đã báo cáo tác động của việc thực hiện các quy trình quản lý dựa trên hướng dẫn cho TBI nặng về điều trị và kết cục của bệnh nhân [5, 6]. Các nghiên cứu này đã chứng minh rõ ràng rằng việc thực hiện các quy trình xử trí TBI nặng, kết hợp các khuyến nghị từ hướng dẫn, kết hợp với các kết cục đáng kể hơn như tỷ lệ tử vong, điểm kết cục chức năng, thời gian nằm viện và chi phí [7, 8] . Tuy nhiên, vẫn có sự khác biệt về thể chế trong việc chăm sóc bệnh nhân bị TBI nặng.
Nói chung, TBI được chia thành hai giai đoạn riêng biệt: tổn thương não nguyên phát và thứ phát. Tổn thương não nguyên phát là tổn thương vật lý đối với nhu mô (mô, mạch) xảy ra trong trường hợp chấn thương, dẫn đến xé rách và đè nén các mô não xung quanh. Tổn thương não thứ phát là kết quả của một quá trình phức tạp, theo sau và làm phức tạp tổn thương não nguyên phát trong những giờ và ngày tiếp theo. Nhiều tổn thương não thứ phát, cả trong sọ, ngoài sọ hay hệ thống, có thể làm phức tạp thêm bộ não bị tổn thương nguyên phát và dẫn đến tổn thương não thứ phát. Tổn thương não thứ phát trong não bao gồm: phù não, máu tụ, não úng thủy, tăng áp lực nội sọ, co thắt mạch máu não, rối loạn chuyển hóa, độc tính, nhiễm độc ion canxi, nhiễm trùng và co giật [9, 10], tổn thương thứ phát hệ thống chủ yếu là thiếu máu cục bộ [9, 11], như:
- Hạ huyết áp (HA tâm thu [SBP] < 90 mm Hg)
- Giảm oxy máu (PaO2 < 60 mm Hg; O2 Saturation < 90%)
- Giảm CO2 máu (PaCO2 < 35 mm Hg)
- Tăng CO2 máu (PaCO2 > 45 mm Hg)
- Tăng HA (SBP > 160 mm Hg, or HA trung bình [MAP] > 110 mm Hg)
- Thiếu máu (Hemoglobin [Hb] < 100 g/L, or hematocrit [Ht] < 0.30)
- Hạ Natri máu (serum sodium < 142 mEq/L)
- Tăng đường huyết (blood sugar > 10 mmol/L)
- Hạ đường huyết (blood sugar < 4.6 mmol/L)
- Giảm áp lực thẩm thấu (plasma osmolality [P Osm] < 290 mOsm/Kg H2O)
- Rối loạn Acid-base (acidemia: pH < 7.35; alkalemia: pH > 7.45)
- Sốt (temperature > 36.5°C)
- Hạ thân nhiệt (temperature < 35.5°C)
Do đó, rõ ràng rằng chỉ tổn thương não nguyên phát rong chấn thương đầu là không thể thay đổi và không thể đảo ngược được. Những tổn thương não thứ phát thường có thể phòng ngừa hoặc đảo ngược.
Việc xử trí chăm sóc tích cực cho bệnh nhân TBI nặng là một quá trình động, bắt đầu từ giai đoạn trước bệnh viện, tại hiện trường vụ tai nạn. Trong giai đoạn đầu của việc chăm sóc tại bệnh viện, bệnh nhân có thể được xử trí ở nhiều nơi khác nhau bao gồm phòng cấp cứu, phòng X quang và phòng mổ trước khi họ được nhận vào ICU (Intensive Care Unit). Sự tiếp tục chăm sóc cấp tính, trong suốt giờ vàng “GOLDEN HOUR”, kể từ khi bị chấn thương cho đến khi bắt đầu chăm sóc dứt khoát, nên được đảm bảo và dựa trên các hướng dẫn và khuyến cáo đã đề cập trước đó. Tổng quan này vạch ra những nguyên tắc cơ bản của việc quản lý chăm sóc đặc biệt của bệnh nhân bị TBI nặng trong thời gian ở lại ICU. Xem hình 1.
Chăm sóc tích cực cho bệnh nhân TBI nặng
Trước khi đến ICU, bệnh nhân TBI nặng thường được điều trị, phục hồi chức năng và ổn định ở khoa cấp cứu hoặc phòng mổ. Một khi bệnh nhân bị chấn thương nặng đã được chuyển tới ICU, việc xử trí bao gồm việc cung cấp dịch vụ chăm sóc tổng quát chất lượng cao và các chiến lược khác nhau nhằm duy trì tình trạng cầm máu bằng:
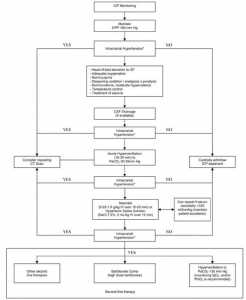
- Ổn định bệnh nhân, nếu vẫn chưa ổn định
- Phòng ngừa tăng ICP
- Duy trì áp suất tưới máu não (CPP) đầy đủ và ổn định
- Tránh những tổn thương não có hệ thống và thứ phát (SBI, secondary brain insults)
- Tối ưu hóa huyết động học và oxy hóa não
Theo dõi
Theo dõi bệnh nhân TBI nặng chủ yếu là hướng dẫn và tối ưu hóa liệu pháp. Mục đích của việc theo dõi là phát hiện sớm và chẩn đoán các tổn thương não thứ phát, cả về hệ thống và nội sọ. Do đó, theo dõi bệnh nhân TBI nặng phải bao gồm theo dõi thần kinh chung và đặc hiệu.
Theo dõi tổng quát
Trong quá trình chăm sóc tích cực thần kinh cho bệnh nhân TBI nặng, thông số tổng quát được theo dõi thường xuyên bao gồm điện tâm đồ (theo dõi ECG), độ bão hòa ôxy động mạch (pulse oxymetry, SpO2), capnography (end-tidal CO2, PetCO2), huyết áp động mạch (catheter động mạch), áp suất tĩnh mạch trung tâm (CVP), nhiệt độ, lượng nước tiểu, khí máu động mạch và điện giải đồ và độ thẩm thấu huyết thanh. Có thể cần theo dõi cung lượng tim xâm lấn hoặc không xâm lấn ở những bệnh nhân không ổn định về huyết động, không đáp ứng với việc hồi sức dịch và các thuốc vận mạch.
Theo dõi thần kinh
Theo dõi áp lực nội sọ
BTF khuyến cáo rằng “áp lực nội sọ (ICP) nên được theo dõi ở tất cả các bệnh nhân có TBI nặng và chụp cắt lớp vi tính (CT) bất thường”. Ngoài ra, “theo dõi ICP được chỉ định ở những bệnh nhân bị TBI nặng với chụp cắt lớp CT bình thường nếu có ghi nhận hai hoặc nhiều đặc điểm sau khi nhập viện: 40 tuổi trở lên, tư thế bất thường một bên hoặc 2 bên, huyết áp tâm thu < 90 mm Hg “[4]. Dựa trên các nguyên tắc sinh lý, lợi ích của theo dõi ICP bao gồm phát hiện sớm tổn thương khối u trong sọ, hướng dẫn điều trị và tránh sử dụng các liệu pháp bừa bãi để kiểm soát ICP, dẫn lưu dịch não tủy với giảm ICP và cải thiện CPP, xác định tiên lượng.
Hiện tại, các phương pháp có thể dùng để theo dõi ICP bao gồm các vị trí: ngoài màng cứng, dưới màng cứng, dưới màng nhện, nhu mô và não thất. Trong lịch sử, catheter ICP vào não thất đã được sử dụng làm chuẩn tham chiếu và kỹ thuật ưu tiên khi có thể. Đây là phương pháp chính xác, chi phí thấp và đáng tin cậy nhất để theo dõi ICP [4]. Nó cũng cho phép đo lường liên tục ICP và thoát dịch CSF trong trường hợp tăng áp lực nội sọ để kiểm soát tăng ICP. Theo dõi dưới màng nhện, dưới màng cứng, và ngoài màng cứng không chính xác. Giám sát ICP thường được đặt qua phía bên phải, vì khoảng 80% dân số bán cầu phải là người không thuận, trừ khi có chống chỉ định [12]. Tuy nhiên, nó có thể được đặt ở phía bên có bệnh lý tối đa hoặc phù nề [13]. Thay đổi catheter não thất thường xuyên hoặc sử dụng kháng sinh dự phòng khi đặt catheter não thất không làm giảm tỉ lệ nhiễm trùng [4]. Tuy nhiên, thiết bị theo dõi ICP thường được tiếp tục trong ≤ 1 tuần; với kiểm tra hàng ngày về CSF cho glucose, protein, số lượng tế bào, nhuộm Gram, và cấy và kháng sinh đồ. Điều trị tăng áp lực nội sọ nên bắt đầu với ngưỡng ICP trên 20 mm Hg. Thêm vào các giá trị ICP, các dấu hiệu lâm sàng và CT não nên được sử dụng để xác định nhu cầu điều trị [4].
Mặc dù không có thử nghiệm đối chứng ngẫu nhiên (RCT) đã được thực hiện chứng minh rằng theo dõi ICP cải thiện kết quả hoặc hỗ trợ việc sử dụng nó như là tiêu chuẩn; Theo dõi ICP đã trở thành một phần không thể tách rời trong việc xử trí bệnh nhân TBI nặng ở hầu hết các trung tâm chấn thương. Tuy nhiên, có mâu thuẫn bằng chứng về việc giám sát ICP cải thiện kết quả. Một số nghiên cứu đã chứng minh rằng theo dõi ICP làm giảm tỷ lệ tử vong chung của bệnh TBI nặng [14, 15, 16, 17, 18, 19, 20, 21]. Các nghiên cứu khác không cho thấy lợi ích từ giám sát ICP [22, 23, 24]. Hơn nữa, một vài nghiên cứu đã chứng minh rằng theo dõi ICP có liên quan đến kết quả tồi tệ hơn [25, 26]. Các biến chứng tiềm ẩn của giám sát ICP bao gồm nhiễm trùng, xuất huyết, trục trặc, tắc nghẽn, hoặc sai vị trí. Gần đây, chúng tôi báo cáo rằng ở những bệnh nhân bị TBI nặng, theo dõi ICP không làm giảm tỷ lệ tử vong ở bệnh viện, tuy nhiên, với sự gia tăng đáng kể thời gian thở máy, nhu cầu về mở khí quản, và thời gian ở ICU [27].
Trong cơ sở dữ liệu của Cochrane, một tổng quan hệ thống gần đây cho thấy không có RCTs nào làm rõ vai trò của giám sát ICP trong tình trạng hôn mê cấp tính dù chấn thương hay không chấn thương [26]. Tuy nhiên, có bằng chứng, và hầu hết các bác sĩ lâm sàng đồng ý, để hỗ trợ việc sử dụng theo dõi ICP ở những bệnh nhân TBI nặng có nguy cơ tăng áp lực nội sọ. Giá trị ICP tuyệt đối là những yếu tố tiên đoán độc lập các kết cục thần kinh; Tuy nhiên, ICP kháng trị và đáp ứng điều trị tăng ICP có thể là dự đoán tốt hơn kết cục thần kinh hơn giá trị ICP tuyệt đối [28]. Treggiari et al. tiến hành tổng quan có hệ thống để ước lượng mối liên quan giữa các giá trị và mô hình ICP và các kết cục về sinh lý và thần kinh ngắn và dài hạn. So với ICP bình thường (< 20mmHg), tăng ICP có liên quan đến tỷ lệ chênh (OR) tử vong: 3,5 [95% CI: 1,7, 7,3] đối với ICP 20-40 và 6,9 [95% CI: 3,9, 12,4] cho ICP > 40 mm Hg. ICP tăng lên nhưng có thể giảm được, gắn liền với sự gia tăng 3-4 lần về ORs của tử vong hoặc kết cục thần kinh kém. Kiểu ICP kháng trị có liên quan đến sự gia tăng đáng kể nguy cơ tử vong tương đối (OR = 114,3 [95% CI: 40,5, 322,3]) [29].
Độ bão hòa oxy máu tĩnh mạch cảnh (Jugular bulb venous oxygen saturation)
Độ bão hòa oxy tĩnh mạch cổ (SjvO2) là chỉ thị cho cả việc oxy hóa não và chuyển hóa trong não, phản ánh tỷ lệ giữa lưu lượng máu trong não (CBF, cerebral blood flow) và tỷ lệ chuyển hóa oxy của não (CMRO2, cerebral metabolic rate of oxygen). Một catheter ngược dòng của tĩnh mạch cảnh trong (IJV) được sử dụng để theo dõi SjvO2. Vì IJV bên phải thường chiếm ưu thế [30] nên nó thường được sử dụng để đặt catheter nhằm phản ánh oxy hóa não toàn phần [31]. Theo dõi SjvO2 có thể liên tục hoặc thông qua một ống thông bằng sợi quang hoặc không liên tục qua thử các mẫu máu lặp đi lặp lại.
Trong một nghiên cứu tiền cứu cho những bệnh nhân bị TBI nặng và tăng ICP, Cruz kết luận rằng việc theo dõi liên tục SjvO2 liên quan đến kết quả cải thiện [32]. Mức trung bình bình thường của SjvO2, trong một đối tượng bình thường thức tỉnh, là 62% với một khoảng 55% đến 71%. SjvO2 kéo dài < 50% là ngưỡng thiếu máu não và điều trị [33]. Theo dõi SjvO2 có thể phát hiện các giai đoạn lâm sàng tiềm ẩn của thiếu tưới máu não, cho phép ngăn ngừa những giai đoạn này bằng cách điều chỉnh điều trị đơn giản. Trong TBI, sự giảm độ bão hòa tĩnh mạch cảnh chủ yếu liên quan đến việc giảm lưu lượng máu não (CBF) thứ phát do giảm CPP (hạ huyết áp, tăng ICP và co thắt mạch máu) hoặc co thắt mạch não liên quan đến giảm CO2 máu (hypocapnia-associated cerebral vasoconstriction). Các nghiên cứu chỉ ra rằng giảm SjvO2 <50% kéo dài liên quan đến kết cục kém, và một yếu tố nguy cơ độc lập cho tiên lượng xấu [34, 35, 36, 37]. Do đó, theo dõi SjvO2 là điều cần thiết cho việc điều chỉnh thông khí trong quá trình điều trị một cơn tăng ICP được thiết lập. Tuy nhiên, lợi ích của việc theo dõi SjvO2 đối với kết cục bệnh TBI nặng đã không được xác nhận trong một RCT.
Áp lực oxygen mô não (Brain tissue oxygen tension)
Cả hai SjvO2 và đo áp lực oxygen mô não (Brain tissue oxygen tension, PbtO2) đều đo oxy hóa ở não, tuy nhiên, SjvO2 đo lường oxy hóa não toàn phần, còn PbtO2 đo oxy hóa não khu trú bằng cách sử dụng que dò xâm lấn (Licox). Rosenthal và cộng sự ghi nhận rằng, các phép đo PbtO2 đại diện cho sản phẩm của CBF và sự khác biệt về sự chênh lệch áp lực oxygen động mạch – tĩnh mạch não, chứ không phải là một phép đo trực tiếp về việc cung cấp oxy toàn phần hoặc oxy trong não [38]. Vì PbtO2 cung cấp một phép đo tại chổ, nó chủ yếu được sử dụng để theo dõi oxy hóa mô não được tưới máu kém. PbtO2 là kỹ thuật đáng tin cậy nhất để theo dõi oxy hóa não khu trú để ngăn ngừa các đợt mất bão hòa. Tuy nhiên, thay đổi oxy hoá não toàn phần có thể không được quan sát. PbtO2 bình thường dao động trong khoảng từ 35mmHg đến 50mmHg [39]. Giá trị của PbtO2 < 15 mmHg được coi là ngưỡng cho thiếu máu cục bộ trong não và điều trị [4].
Một số nghiên cứu chứng minh rằng điều trị dựa trên PbtO2 có thể làm giảm tử vong của bệnh nhân và cải thiện kết cục bệnh nhân sau khi bị TBI nặng [40, 41, 42]. Trong một tổng quan hệ thống gần đây, các tài liệu y khoa hiện có đã được xem xét để kiểm tra liệu PbtO2 có liên quan đến kết quả cải thiện của bệnh nhân TBI nặng [43]. Trong số những bệnh nhân được điều trị dựa trên PbtO2, 38,8% không thuận lợi và 61,2% có kết quả tốt. Trong số những bệnh nhân được điều trị bằng ICP/CPP có 58,1% không thuận lợi và 41,9% có kết quả tốt. Liệu pháp dựa trên PbtO2 nói chung kết hợp với kết quả tốt (OR = 2,1, 95% CI = 1,4-3,1). Các kết quả này gợi ý rằng điều trị kết hợp ICP/CPP- và PbtO2 có liên quan đến kết cục tốt hơn sau khi điều trị TBI nặng, so với điều trị chỉ dựa trên ICP/CPP [43]. Oddo et al. báo cáo rằng thiếu oxy trong não hoặc giảm PbtO2 là một yếu tố tiên đoán kết quả độc lập và kết hợp với kết cục ngắn hạn kém sau TBI nặng không phụ thuộc vào tăng ICP, CPP thấp và mức độ thương tích nghiêm trọng. PbtO2 có thể là một mục tiêu điều trị quan trọng sau khi bị TBI nặng [44]. PbtO2 đã được chứng minh là vượt trội so với SjvO2, quang phổ gần hồng ngoại (near infrared spectroscopy) [45], và độ bão hòa oxy xuyên sọ trong vùng (regional transcranial oxygen saturation) [46] trong việc phát hiện thiếu máu não. Theo dõi PbtO2 là một phương pháp hứa hẹn, an toàn và phù hợp với lâm sàng ở bệnh nhân TBI nặng; tuy nhiên, nó không được sử dụng rộng rãi và cũng không có sẵn. Sự kết hợp giữa giám sát ICP/PbtO2 trong nhu mô não là những phương thức quan trọng và hữu ích trong việc xử trí TBI nặng.
Vi thẩm phân não (Cerebral microdialysis)
Vi thẩm phân não (MD, microdialysis) là một thiết bị phòng thí nghiệm xâm lấn đã được phát triển gần đây, tại giường, theo dõi để phân tích sinh hóa mô não [47]. Thông thường, một ống thông MD được chèn vào mô não “dễ bị tổn thương” để đo sự thay đổi sinh hóa trong vùng não dễ bị tổn thương thứ phát nhiều nhất. Các xét nghiệm khác nhau có sẵn để đo nồng độ dialysat bao gồm glucose, lactate, pyruvate, glycerol, và glutamate.
Đặc trưng, giảm ô xy não hoặc thiếu máu cục bộ làm tăng đáng kể tỷ lệ lactat: pyruvate (LPR) [48]. LPR > 20-25 được coi là một ngưỡng cho thiếu máu não và kết hợp với kết cục kém trong TBI [49]. Mặc dù, MD là một công cụ được thiết lập tốt, cung cấp thêm sự trợ giúp trong việc quản lý bệnh nhân TBI nặng, việc sử dụng nó rất hạn chế.
Siêu âm Doppler xuyên sọ (Transcranial Doppler Ultrasonography)
Doppler xuyên sọ (TCD, Transcranial Doppler) là một phương pháp không xâm lấn để đo vận tốc CBF. Nó ngày càng được sử dụng trong chăm sóc thần kinh như TBI. Đây là một công cụ hữu ích về mặt lâm sàng trong chẩn đoán các biến chứng có thể xảy ra ở những bệnh nhân bị TBI như co thắt mạch não, tăng ICP và giảm CPP nghiêm trọng, cắt lớp động mạch cảnh, và ngưng tuần hoàn não (chết não). TCD có thể dự đoán trường hợp co thắt mạch não sau chấn thương trước khi biểu hiện lâm sàng. Vì theo dõi ICP là một thủ tục xâm lấn với nguy cơ tiềm ẩn các biến chứng liên quan, nên TCD đã được đề xuất là một kỹ thuật thay thế không xâm lấn để đánh giá ICP và CPP [50, 51]. Độ nhạy của TCD xác định chết não là 75% đến 88%, và độ đặc hiệu chung là 98% [52, 53]. Mặc dù, TCD là một phương thức theo dõi được thiết lập trong chăm sóc thần kinh, nhưng vẫn còn thiếu bằng chứng để hỗ trợ việc sử dụng thường xuyên ở những bệnh nhân TBI nặng khi theo dõi ICP/CPP không thực hiện được.
Theo dõi điện sinh lý (Electrophysiological monitoring)
Điện não (Electroencephalogram, EEG) là một công cụ hữu ích về mặt lâm sàng để theo dõi độ sâu của hôn mê, phát hiện cơn động kinh không co giật hoặc co giật lâm sàng ở bệnh nhân đang dùng thuốc liệt cơ và chẩn đoán tử vong do não [54, 55]. EEG liên tục đã được đề xuất để chẩn đoán các cơn co giật sau chấn thương (PTS, post-traumatic seizures) ở bệnh nhân bị TBI, đặc biệt ở những người đang được điều trị bằng thuốc chẹn thần kinh cơ.
Sensory-evoked potentials (SEP) có thể mang lại dữ liệu về chức năng não hiện tại ở những bệnh nhân TBI rất nặng; tuy nhiên, việc sử dụng chúng rất hạn chế trong việc xử trí ban đầu của TBI.
Quang phổ gần hồng ngoại (Near infrared spectroscopy)
Quang phổ gần hồng ngoại (NIRS, near infrared spectroscopy) là một giám sát liên tục, trực tiếp và không xâm lấn của oxy hóa não và thể tích máu não (CBV). Trong mô não, hai chất chính (các chất hấp thụ ánh sáng) là hemoglobin (Hb) và cytochrome oxidase. NIRS dựa trên các tính chất hấp thụ khác nhau của các chromophores trong phạm vi NIR, nghĩa là, giữa 700 và 1000 nm. Tại 760 nm, Hb xảy ra chủ yếu ở trạng thái khử oxy (deoxyHb), trong khi ở 850 nm, nó xảy ra trong trạng thái ôxi hóa (oxyHb). Do đó, bằng cách theo dõi độ chênh lệch trong hai bước sóng này, mức độ khử oxy hóa mô có thể được đánh giá.
So với SjvO2, NIRS ít chính xác hơn trong việc xác định oxy hóa não [56]. Mặc dù, NIRS là một công nghệ đang phát triển và có tiềm năng như một công cụ lâm sàng cho việc đo oxy hóa não và CBF tại giường, việc sử dụng nó trong chăm sóc tích cực thần kinh vẫn còn rất hạn chế.
Theo dõi nhiệt độ não (Brain temperature)
Sau chấn thương đầu, độ chênh nhiệt độ trong não so với nhiệt độ cơ thể lên đến 3o C đã được báo cáo. Nhiệt độ tăng là một tổn thương thứ phát phổ biến đối với não bị chấn thương. Cả hai phương pháp xâm lấn (The new Licox PMO: Integra LifeSciences, Plainsboro, NJ) [57] và không xâm lấn [58], các thiết bị theo dõi nhiệt độ não liên tục đều sẵn có để đánh giá nhiệt độ não. Tuy nhiên, theo dõi nhiệt độ não vẫn không được sử dụng rộng rãi trong chăm sóc thần kinh với bệnh nhân TBI nặng.
Chăm sóc tích cực
Các hướng dẫn để xử trí TBI nặng có sẵn, được áp dụng rộng rãi và nên là nền tảng chính cho việc xây dựng các quy trình xử trí dựa trên các hướng dẫn thực hành lâm sàng. Một số nghiên cứu đã chứng minh tầm quan trọng và tác động của việc thực hiện các quy trình như trên đối với kết cục của bệnh nhân bị TBI nặng [5, 6, 7]. Chúng tôi báo cáo rằng việc sử dụng một hướng dẫn dựa trên các hướng dẫn thực hành lâm sàng cho TBI nặng kết hợp với việc giảm đáng kể cả tử vong trong ICU và tử vong trong bệnh viện [8].
Giảm đau, anh thần và liệt cơ
Ở những bệnh nhân TBI nặng, đặt nội khí quản, thông khí cơ học, chấn thương, can thiệp phẫu thuật (nếu có), chăm sóc điều dưỡng và các thủ thuật ICU là nguyên nhân gây ra đau. Các chất gây nghiện, ví dụ như morphine, fentanyl và remifentanil, nên được xem là phương pháp điều trị đầu tiên vì chúng gây giảm đau, an thần nhẹ và ức chế các phản xạ đường hô hấp (ho) mà tất cả đều cần thiết cho bệnh nhân đặt nội khí quản và thở máy. Dùng thuốc gây nghiện bằng cách truyền truyền liên tục hoặc như bolus không liên tục.
Sự an thần đầy đủ có thể làm giảm đau; cung cấp giảm lo âu; hạn chế ICP tăng cao liên quan đến kích động, khó chịu, ho hoặc đau; tạo điều kiện chăm sóc điều dưỡng và thông khí cơ học; giảm tiêu thụ O2, CMRO2 và sinh CO2; cải thiện sự thoải mái của bệnh nhân; và ngăn ngừa các cử động có hại. Thuốc an thần lý tưởng cho bệnh nhân TBI phải khởi phát nhanh và mất tác dụng nhanh, dễ điều chỉnh liều để đạt hiệu quả, và không sinh các chất chuyển hóa có hoạt tính. Nó cũng là thuốc chống co giật, có khả năng hạ thấp ICP và CMRO2, và để dự phòng cho các đánh giá thăm khám thần kinh. Cuối cùng, nó sẽ không có các hiệu ứng tim mạch nguy hại. Không có thuốc an thần thường dùng nào là lý tưởng. Propofol là thuốc ngủ được lựa chọn ở những bệnh nhân bị tổn thương thần kinh cấp tính, vì nó có thể dễ dàng điều chỉnh và nhanh chóng hồi phục một khi ngưng thuốc. Những tính năng này cho phép an thần có thể dự báo được nhưng vẫn cho phép đánh giá thần kinh định kỳ cho bệnh nhân. Tuy nhiên, propofol nên tránh ở bệnh nhân hạ huyết áp hoặc giảm thể tích máu vì các tác động huyết động có hại. Hơn nữa, hội chứng truyền propofol (hủy cơ, toan chuyển hóa, suy thận và nhịp tim chậm) là một biến chứng tiềm tàng của truyền kéo dài hoặc liều cao propofol. Benzodiazepine như midazolam và lorazepam được khuyến cáo là tiêm truyền liên tục hoặc bolus không liên tục. Ngoài việc gây ngủ, nó còn giúp bệnh nhân quên (amnesia) và tác dụng chống co giật. Tiêm truyền kéo dài, liều cao, sự xuất hiện của suy thận hoặc suy gan, và tuổi già là những yếu tố nguy cơ cho sự tích tụ và an thần quá mức.
Việc sử dụng thường xuyên các thuốc chẹn thần kinh cơ (NMBA, neuromuscular blocking agent) làm liệt các bệnh nhân bị TBI không được khuyến cáo. NMBA làm giảm bớt tình trạng tăng ICP và nên được coi là phương pháp điều trị thứ hai đối với tăng áp lực nội sọ. Tuy nhiên, việc sử dụng NMBA có liên quan đến tăng nguy cơ viêm phổi và thời gian nằm ICU (LOS), và các biến chứng về thần kinh cơ.
Thở máy
Bệnh nhân bị TBI nặng thường được đặt nội khí quản và thở máy. Nên tránh tình trạng thiếu oxy, được định nghĩa là bão hòa O2 < 90%, hoặc PaO2 <60 mm Hg, [4]. Không khuyến cáo tăng thông khí dự phòng cho PaCO2 < 25mmHg [4]. Trong vòng 24 giờ đầu sau khi bị TBI nặng, nên tránh tăng thông khí quá mức như vậy vì nó có thể làm giảm khả năng tưới máu não đã giảm đáng kể. Coles và cộng sự báo cáo rằng, ở những bệnh nhân bị TBI nặng, tăng thông khí làm gia tăng khối lượng mô bị tổn thương kém tưới máu trong não bị thương mặc dù có cải thiện CPP và ICP. Sự giảm lưu lượng máu trong vùng có thể biểu hiện những vùng mô não bị thiếu máu cục bộ [59]. Tăng thông khí quá nhiều và kéo dài sẽ gây ra co thắt mạch máu não và thiếu máu cục bộ. Do đó, tăng thông khí chỉ nên là biện pháp tạm thời để giảm ICP đang tăng cao. Tăng thông khí trong một khoảng thời gian ngắn (15-30 phút), với PaCO2 30-35 mm Hg được khuyến cáo để điều trị tình trạng suy giảm thần kinh cấp tính phản ánh tăng ICP. Tăng thông khí trong thời gian dài hơn có thể được yêu cầu đối với tăng áp lực nội sọ kháng trị với tất cả các phương pháp điều trị bao gồm an thần, liệt cơ, dẫn lưu dịch não tủy, dung dịch muối ưu trương (HSS, hypertonic saline solution) và thuốc lợi tiểu thẩm thấu. Tuy nhiên, khi sử dụng phương pháp tăng thông khí, nên theo dõi SjvO2 hoặc PbtO2 được khuyến cáo để theo dõi ôxy hóa ở não và tránh thiếu tưới máu não.
Các cài đặt thông khí phải được điều chỉnh để duy trì độ SpO2 từ 95% trở lên và/hoặc PaO2 từ 80 mmHg trở lên và để đạt được thông khí bình thường (eucapnia) với PaCO2 từ 35 đến 40mmHg. Mascia et al. báo cáo rằng thể tích khí lưu thông cao là một dự báo độc lập và liên quan đến tổn thương phổi cấp tính (ALI) ở bệnh nhân bị TBI nặng [60]. Do đó, thông khí bảo vệ có thể tích khí lưu thông thấp và PEEP mức vừa phải đã được khuyến cáo để ngăn ngừa tổn thương phổi do thở máy và tăng ICP [61].
Trước khi hút đàm qua ống nội khí quản (ETT), cần phải tăng oxy trước khi hút với FiO2 = 1.0, và sử dụng các thuốc an thần khác để tránh làm tụt độ bão hòa và tăng đột ngột ICP. Việc hút ETT phải ngắn gọn và không gây chấn thương.
Người ta đã gợi ý rằng PEEP làm tăng áp lực trong lồng ngực dẫn đến giảm dẫn lưu máu tĩnh mạch ở não trở về tim và do đó tăng thể tích máu não (CBV) và ICP. Tuy nhiên, hiệu quả của PEEP trên ICP chỉ có ý nghĩa với mức PEEP cao hơn 15 cm H2O ở bệnh nhân giảm thể tích máu. Tuy nhiên, mức PEEP thấp nhất, thường là từ 5 đến 8 cm H2O duy trì sự oxy hóa đầy đủ và ngăn ngừa xẹp phổi cuối thì thở ra, nên được sử dụng. PEEP cao hơn, lên đến 15 cm H2O, có thể được sử dụng trong trường hợp thiếu oxy máu kháng trị.
Một số lượng đáng kể các bệnh nhân bị TBI nặng phát triển ALI hoặc hội chứng suy hô hấp cấp tính (ARDS), với tỷ lệ ALI/ARDS báo cáo từ 10% đến 30% [62, 63, 64]. Nguyên nhân của ALI/ARDS ở bệnh nhân TBI nặng bao gồm hít sặc, viêm phổi, dập phổi, truyền máu số lượng lớn, tổn thương phổi cấp liên quan truyền máu (TRALI), nhiễm trùng huyết, phù phổi cấp do thần kinh, thông khí với thể tích khí lưu thông cao hoặc tần số thở cao [65, 66] . Sự phát triển của ALI/ARDS ở những bệnh nhân bị TBI nặng kết hợp với thời gian nằm ICU (LOS) lâu hơn và ngày không cần thông khí ít hơn [60]. Xử trí thông khí cho bệnh nhân TBI nặng và ALI/ARDS là một thách thức. Một chiến lược thông khí cân bằng, giữa các hướng dẫn về TBI nghiêm trọng hoặc cách tiếp cận “chấn thương não” lịch sử (oxy hóa đầy đủ, tối ưu hóa việc dẫn lưu tĩnh mạch trong não về tim bằng cách sử dụng PEEP ở mức thấp và tăng thông khí nhẹ bằng cách sử dụng thể tích khí lưu thông cao cao) và chiến lược thông khí bảo vệ phổi (bằng cách sử dụng PEEP cao và thể tích khí lưu thông thấp), tuy nhiên, rất khó có thể đạt được. Tăng thán chấp nhận (permissive hypercapnia), là một chiến lược chấp nhận được ở ALI/ARDS, nhưng cần tránh ở những bệnh nhân bị TBI nặng nếu có thể, do giãn mạch máu não, tăng CBV và ICP.
Hỗ trợ huyết động
Mất ổn định huyết động thường gặp trên bệnh nhân bị TBI nặng. Hạ HA, xác định bởi SBP < 90 mm Hg hoặc MAP < 65 mm Hg, thì thường gặp và do tổn thương não thứ phát hệ thống, và chiếm tỉ lệ đến 73% trong thời gian nằm ICU [67]. Nghiên cứu từ “Traumatic Coma Data Bank” (TCDB) ghi nhận hạ HA là yếu tố dự đoán nổi bật và độc lập cho kết cục xấu của TBI nặng [68]. Hạ HA có ý nghĩa kèm theo tăng tỉ lệ tử vong của TBI [69, 70, 71]. Trong các yếu tố dự đoán của TBI, hạ HA là yếu tố có khả năng phòng ngừa được, cần phải tránh để xảy ra và cần phải điều trị tích cực.
Rất khó có thể một TBI đơn thuần bị hạ huyết áp trừ khi bệnh nhân đã chết não. Sự giảm thể tích nội mạch do xuất huyết, từ các tổn thương liên quan như da đầu, cổ, mạch, ngực, bụng, xương chậu và các chi, hoặc do đa niệu thứ phát do đái tháo nhạt, là những nguyên nhân phổ biến nhất gây hạ huyết áp ở bệnh nhân TBI nặng. Các nguyên nhân khác có thể gây hạ huyết áp ở những bệnh nhân bị TBI nặng là dập cơ tim, dẫn đến suy bơm nguyên phát, và tổn thương tủy sống với sốc tủy sống (tổn thương tủy sống cổ gây ra mất toàn bộ dây thần kinh giao cảm và dẫn đến hạ huyết áp do giao cảm và loạn nhịp tim chậm). Một nguyên nhân thường bị bỏ quên về hạ huyết áp ở bệnh nhân TBI là sử dụng etomidate để đặt nội khí quản. Có báo cáo rằng ngay cả một liều duy nhất của etomidate có thể gây ra suy thượng thận dẫn đến hạ huyết áp [72].
Việc sử dụng dịch truyền tích cực để đạt được thể tích nội mạch đầy đủ là bước đầu tiên trong việc hồi sức bệnh nhân bị hạ huyết áp sau khi bị TBI nghiêm trọng. CVP có thể được sử dụng để hướng dẫn việc xử trí dịch truyền và nên được duy trì ở mức 8-10 mmHg. Ở những bệnh nhân đáp ứng kém về tăng thể tích và thuốc vận mạch, có thể cho thấy bất ổn định về huyết động học, hoặc có bệnh tim mạch, bệnh nhân này cần đặt catheter động mạch phổi hoặc giám sát huyết động không xâm lấn có thể được xem xét. Áp suất bờ mao mạch phổi phải được duy trì ở 12-15 mmHg. Một số chỉ số dự báo đáng tin cậy về đáp ứng hồi sức dịch như pulse pressure variation, systolic pressure variation, stroke volume variation, và độ xẹp của tĩnh mạch chủ dưới đã được đề xuất để hướng dẫn xử trí dịch. Các dung dịch tinh thể đẳng trương, dung dịch muối sinh lý (NS) là dung dịch được lựa chọn để hồi sức dịch và thay thế thể tích. HSS có hiệu quả để phục hồi huyết áp trong sốc do xuất huyết; tuy nhiên, không có lợi ích sống còn [73]. “The National Heart, Lung, and Blood Institute of the National Institutes of Health” đã ngừng đăng ký thử nghiệm lâm sàng của HSS trên bệnh nhân TBI nặng vì HSS không tốt hơn so với điều trị NS [74]. Máu và các sản phẩm máu có thể được sử dụng thích hợp.
Thiếu máu là một tổn thương não thứ phát hệ thống phổ biến và cần tránh, với một hemoglobin mục tiêu ≥ 100 g/L hoặc hematocrit ≥ 0,30. Mô não có thể sinh thromboplastin và tổn thương não có thể gây ra bệnh lý đông máu [75]. Sự bất thường của đông máu nên được điều chỉnh tích cực với các sản phẩm máu nếu phù hợp, đặc biệt khi có xuất huyết nội sọ do chấn thương.
Trước khi đặt catheter theo dõi ICP, nên có MAP ≥ 80 mm Hg. Lý do cơ bản của MAP ≥ 80 mmHg là duy trì CPP ≥ 60 mmHg đối với ngưỡng điều trị ICP > 20 mmHg [4]. Sau khi đặt catheter theo dõi ICP, việc quản lý MAP sẽ được định hướng bởi các giá trị ICP/CPP.
Thỉnh thoảng, CPP mục tiêu hoặc MAP có thể không đạt được mặc dù hồi sức dịch thích hợp và thể tích nội mạch đầy đủ. Việc sử dụng dịch quá mức và không thích hợp để đạt được CPP hoặc MAP dự kiến có liên quan đến tình trạng quá tải dịch và gây ra ARDS, điều này cần tránh. Cần phải sử dụng thuốc vận mạch để đạt được CPP mục tiêu hoặc MAP nếu không có được đáp ứng sau hồi sức dịch. Norepinephrine, được truyền bằng đường tĩnh mạch trung tâm (CVL), được khuyến cáo. Dopamine làm giãn mạch và tăng ICP, tuy nhiên, có thể được sử dụng ban đầu thông qua một catheter tĩnh mạch ngoại vi cho đến khi đặt được CVL [76, 77]. Phenylephrine, một thuốc chủ vận alpha-adrenergic thuần, được khuyến cáo ở những bệnh nhân TBI nhịp tim nhanh. Một nghiên cứu gần đây cho thấy những bệnh nhân nhận phenylephrine có MAP và CPP cao hơn những bệnh nhân dùng dopamine và norepinephrine, [78].
Tăng huyết áp, được định nghĩa là SBP > 160 mmHg hoặc MAP > 110 mmHg, cũng là một tổn thương não thứ phát có thể làm trầm trọng thêm chứng phù não vận mạch và tăng áp lực nội sọ. Tuy nhiên, cao huyết áp có thể là phản ứng sinh lý đối với sự tưới máu não giảm. Do đó, và trước khi theo dõi ICP, không nên điều trị tăng huyết áp trừ khi một nguyên nhân đã được loại trừ hoặc điều trị, và SBP> 180-200 mmHg hoặc MAP> 110-120 mm Hg. Hạ thấp tình trạng cao huyết áp, như là một cơ chế bù đắp để duy trì một CPP thích hợp, sẽ làm thiếu tưới máu não nặng hơn. Sau khi đặt theo dõi ICP, xử trí MAP được hướng dẫn bởi CPP.
Áp lực tưới máu não (Cerebral perfusion pressure)
Thiếu tưới máu não được xem như là một dữ kiện thứ phát, đơn thuần, quan trọng nhất ảnh hưởng đến kết cục của bệnh nhân TBI nặng. CPP, là hiệu số của MAP trừ cho ICP, (CPP = MAP – ICP), dưới 50 mm Hg cần phải tránh [4]. CPP thấp có thể gây nguy hiểm cho vùng não với tình trạng thiếu máu cục bộ, và tăng CPP có thể giúp tránh được chứng thiếu máu não. Giá trị CPP đến mục tiêu cần được duy trì trên ngưỡng thiếu tưới máu tối thiểu 60 mmHg [4]. Việc duy trì CPP lớn hơn 60 mmHg là một lựa chọn điều trị có thể kết hợp với việc giảm đáng kể tử vong và cải thiện chất lượng sống còn, và có khả năng làm tăng tưới các vùng thiếu máu cục bộ của não sau TBI nghiêm trọng. Không có bằng chứng nào cho thấy tỷ lệ mắc tăng áp lực nội sọ, bệnh suất, hoặc tử vong tăng lên do duy trì CPP > 60 mmHg bằng cách duy trì thể tích nội mạch đầy đủ hoặc tăng huyết áp hệ thống. Cả hai mức 60 mm Hg và 70 mm Hg được trích dẫn trong tài liệu như là ngưỡng trên mà CPP nên được duy trì. CPP phải được duy trì ở mức tối thiểu là 60 mm Hg nếu không có thiếu tưới máu não, và tối thiểu là 70 mm Hg với sự thiếu máu cục bộ não [4]. Theo dõi PbtO2 đã được đề xuất để xác định CPP tối ưu cho cá nhân [79]. Trong trường hợp không thiếu máu não, cần tránh những nỗ lực tích cực để duy trì CPP trên 70mmHg với dịch truyền và thuốc vận mạch do nguy cơ ARDS [4].
Điều trị tăng thẩm thấu (Hyperosmolar therapy)
Truyền mannitol là một phương pháp hiệu quả để làm giảm ICP đang tăng sau khi TBI nặng [80]. Mannitol tạo ra một độ chênh lệch áp suất thẩm thấu tạm thời và nó làm tăng áp suất thẩm thấu huyết thanh đến 310 đến 320 mOsm/kg H2O. Việc sử dụng mannitol dự phòng không được khuyến cáo [4]. Trước khi theo dõi ICP, nên sử dụng mannitol hạn chế cho bệnh nhân có thoát vị qua lều não hoặc suy thoái thần kinh tiến triển không do nguyên nhân ngoài hộp sọ. Mannitol không nên được sử dụng nếu áp suất thẩm thấu huyết thanh > 320 mOsm / kg H2O. Tác dụng lợi tiểu thẩm thấu cần được bù đắp bằng cách thay thế dịch truyền đầy đủ bằng dung dịch muối đẳng trương để duy trì đẳng thể tích (euvolmia). Liều có hiệu quả là 0,25-1 g/kg, truyền tĩnh mạch trong thời gian 15 đến 20 phút. Việc dùng mannitol thường xuyên có thể dẫn đến mất nước nội mạch, hạ huyết áp, tăng azote máu trước thận và tăng kali máu [81]. Mannitol có thể đi qua và tích tụ trong não, gây ra sự dịch chuyển osmotic hoặc hiện tượng dội, và làm tăng sự thẩm thấu của não, do đó tăng ICP [82, 83]. Mannitol là chống chỉ định ở bệnh nhân bị TBI và suy thận vì nguy cơ phù phổi và suy tim.
HSS đã được đề xuất như là thay thế cho mannitol. HSS có một số tác dụng có lợi trong các bệnh nhân bị thương đầu, bao gồm tăng thể tích nội mạch, rút nước từ khoang nội bào, giảm ICP, và tăng co bóp tim. HSS sinh ra mất nước thẩm thấu và co mạch máu não liên quan đến tăng độ nhớt. Việc sử dụng kéo dài HSS có liên quan đến giảm ICP, kiểm soát phù não, không có ảnh hưởng bất lợi của tăng áp suất thẩm thấu trên mức sinh lý như suy thận, phù phổi, hoặc hoại tử myeline hóa cầu não trung tâm [84, 85]. Trong một phân tích meta gần đây, Kamel et al. thấy rằng nước muối tăng ưu trương có hiệu quả hơn mannitol trong điều trị tăng ICP [86].
Điều hòa nhiệt độ (Temperature Modulation)
Hạ thân nhiệt ở mức trung bình ở 32°C đến 34°C, làm giảm sự trao đổi chất trong não và CBV, làm giảm ICP, và tăng CPP [87]. Bằng chứng về tác động hạ thân nhiệt trung bình đối với kết cục của bệnh nhân bị TBI đã gây tranh cãi. Ban đầu, các nghiên cứu cho thấy rằng hạ thân nhiệt, được thiết lập khi nhập viện, kết hợp với kết quả cải thiện đáng kể ở 3 và 6 tháng sau khi TBI [88]. Tuy nhiên, trong một nghiên cứu RCT lớn, hạ thân nhiệt không có hiệu quả đã được chứng minh trên kết cục sau khi TBI [89, 90]. Nghiên cứu “The National Acute Brain Injury Study”: Hypothermia II là một thử nghiệm lâm sàng ngẫu nhiên, đa trung tâm của bệnh nhân bị TBI nặng, đã ghi danh trong vòng 2 đến 5 giờ bị thương. Bệnh nhân được phân ngẫu nhiên vào hạ thân nhiệt (làm mát đến 33°C trong 48 giờ) hoặc bình nhiệt. Không có sự khác biệt đáng kể về kết quả giữa hạ thân nhiệt và nhóm bình thường. Cuộc thử nghiệm không khẳng định tính tiện ích của hạ thân nhiệt như là một chiến lược bảo vệ cơ bản ở bệnh nhân TBI nặng [88]. Tuy nhiên, cần kiểm soát nhiệt độ và sốt nên được điều trị tích cực ở bệnh nhân TBI nặng. Giảm thân nhiệt trung bình có thể được sử dụng trong ICP không kiểm soát, kháng trị.
Dự phòng chống co giật
Các cơn co giật sau chấn thương được phân loại là sớm xảy ra trong vòng 7 ngày sau khi bị thương, hoặc xảy ra muộn sau 7 ngày [91]. Không nên dùng liệu pháp dự phòng (phenytoin, carbamazepine, hoặc phenobarbital) để phòng ngừa cơn co giật sau chấn thương [4]. Tuy nhiên, BTF đề nghị điều trị dự phòng để ngăn ngừa co giật sớm sau chấn thương sọ não ở những bệnh nhân TBI có nguy cơ cao động kinh [4]. Các yếu tố nguy cơ bao gồm: điểm số GCS <10, dập võ não, chấn thương lõm xương sọ, tụ máu dưới màng cứng, tụ máu ngoài màng cứng, máu tụ trong não, TBI thâm nhập, và động kinh trong vòng 24 giờ sau chấn thương [4, 92].
Phenytoin là thuốc được đề nghị để dự phòng cơn co giật sau chấn thương giai đoạn sớm. Một liều nạp từ 15 đến 20 mg/kg tiêm tĩnh mạch (I.V.) trong 30 phút, sau đó là 100 mg, I.V, mỗi 8 giờ, được điều chỉnh theo nồng độ trong huyết tương, trong 7 ngày. Những bệnh nhân được điều trị dự phòng chống co giật phải được theo dõi về các phản ứng phụ tiềm ẩn.
Dự phòng thuyên tắc tĩnh mạch sâu
Các bệnh nhân TBI nặng có nguy cơ cao phát triển huyết khối tĩnh mạch (VTE) bao gồm huyết khối tĩnh mạch sâu (DVT) và thuyên tắc phổi. Nguy cơ phát triển DVT khi không dự phòng được ước tính là 20% sau TBI nặng [93].
Khuyến cáo nên sử dụng dự phòng huyết khối cơ học, bao gồm vớ nén và các thiết bị nén tuần hoàn, trừ khi việc sử dụng thiết bị này bị cản trở bởi thương tích ở phần chi dưới. Việc sử dụng các thiết bị như vậy nên được tiếp tục cho đến khi bệnh nhân di động được. Nếu không có chống chỉ định, heparin trọng lượng phân tử thấp (LMWH) hoặc heparin không phân đoạn liều thấp nên được sử dụng kết hợp với dự phòng cơ học. Tuy nhiên, việc sử dụng thuốc dự phòng có liên quan đến nguy cơ gia tăng xuất huyết nội sọ. Mặc dù chưa có bằng chứng hỗ trợ các khuyến cáo về thời gian điều trị dự phòng bằng thuốc, nhưng hầu hết các chuyên gia cho rằng nên bắt đầu điều trị dự phòng bằng thuốc ngay từ 48 đến 72 giờ sau khi bị thương, trong trường hợp không có các chống chỉ định khác [94].
Dự phòng loét do Stress
TBI nặng là một yếu tố nguy cơ nổi tiếng gây loét do stress (Cushing’s ulcer) trong ICU. Điều trị dự phòng bao gồm cho ăn qua đường tiêu hóa sớm và điều trị dự phòng bằng thuốc như H2- blocker, thuốc ức chế bơm proton và sucralfat [95,96].
Hỗ trợ dinh dưỡng
Bệnh nhân TBI nặng thường ở trạng thái tăng chuyển hóa, tăng dị hóa và tăng đường huyết, với chức năng đường tiêu hóa suy giảm. Có bằng chứng cho thấy suy dinh dưỡng làm tăng tỷ lệ tử vong ở bệnh nhân TBI [97]. Các nghiên cứu ghi nhận sự ưu việt của việc cho ăn qua đường tiêu hóa (EN) so với dinh dưỡng tĩnh mạch (PN, parenteral nutrition). Việc sử dụng PN nên hạn chế khi chống chỉ định cho ăn qua đường tiêu hóa vì có liên quan đến biến chứng và tăng tử vong [98]. Do đó, cho ăn qua đường tiêu hóa sớm được khuyến cáo ở những bệnh nhân TBI nặng vì nó an toàn, rẻ, hiệu quả và sinh lý. Lợi ích tiềm ẩn của việc cho ăn qua đường tiêu hóa bao gồm kích thích các chức năng của đường tiêu hóa, bảo vệ chức năng rào cản miễn dịch của ruột và sự toàn vẹn của niêm mạc ruột, giảm các nhiễm trùng và các biến chứng nhiễm trùng. Thông thường, bệnh nhân bị TBI nặng có thể không dung nạp nuôi ăn dạ dày vì nhiều lý do bao gồm làm trống dạ dày bất thường và thay đổi chức năng dạ dày do tăng ICP và sử dụng thuốc phiện. Các thuốc prokinetic như metoclopramide hoặc erythromycin, cải thiện dung nạp. Nuôi ăn qua sonde đặt qua môn vị tránh được không dung nạp dạ dày và cho phép ăn nhiều calo và nitơ.
Mặc dù, BTF đề nghị cho tăng cung cấp lên đến 140% năng lượng nghỉ ngơi ở bệnh nhân không bị liệt và 100% ở những bệnh nhân bị dùng thuốc liệt cơ, có nhiều bằng chứng cho thấy lợi ích của lượng calo thấp hơn [99, 100, 101, 102].
Kiểm soát đường huyết
Ở những bệnh nhân bị TBI nặng, tăng đường huyết do stress là một tổn thương não thứ phát hệ thống. Các nghiên cứu cho thấy rằng tăng đường huyết liên tục có liên quan đến kết cục thần kinh kém sau TBI [103, 104, 105, 106, 107, 108]. Mặc dù tăng đường huyết có hại, duy trì nồng độ glucose trong máu thấp trong giới hạn chặt chẽ là vấn đề gây tranh cãi ở bệnh nhân TBI nặng vì hạ đường huyết, biến chứng thường gặp của kiểm soát glucose chặt chẽ có thể làm nặng thêm tổn thương não cơ bản [109]. Vespa và các cộng sự báo cáo rằng liệu pháp điều trị insulin tích cực (IIT, intensive insulin therapy) làm giảm glucose/microdialysis và tăng glutamate/ microdialysis và tỉ lệ lactate/pyruvate mà không đạt lợi thế về kết quả chức năng [110]. Oddo et al. chứng minh rằng kiểm soát glucose chặt chẽ hệ thống có liên quan đến việc giảm glucose trong máu ở ngoài tế bào và tăng tần suất của khủng hoảng năng lượng não, do đó tương quan với tỷ lệ tử vong tăng lên. IIT có thể làm giảm chuyển hóa glucose trong não sau khi bị tổn thương não nghiêm trọng [111]. Một phân tích meta gần đây về IIT trong chấn thương não cho thấy IIT dường như không làm giảm nguy cơ tử vong ở bệnh viện hoặc tử vong muộn (RR = 1,04, 95% CI = 0,75, 1,43 và RR = 1,07, 95% CI = 0,91, 1,27 tương ứng). Hơn nữa, IIT không có tác dụng bảo vệ kết quả thần kinh lâu dài (RR = 1,10, KTC 95% = 0,96, 1,27). Tuy nhiên, IIT tăng tỷ lệ các giai đoạn hạ đường huyết (RR = 1,72, KTC 95% = 1,20, 2,46) [112]. Do đó, đa số các bằng chứng lâm sàng hiện tại không hỗ trợ việc kiểm soát glucose chặt chẽ (duy trì mức đường trong máu dưới 110-120 mg/dl) trong thời gian chăm sóc cấp tính các bệnh nhân bị TBI nặng [113].
Steroids
Không nên dùng steroid để cải thiện kết cục hoặc giảm ICP ở bệnh nhân TBI nặng. Hơn nữa, steroid có thể có hại sau TBI. Cuộc thử nghiệm CRASH, một hợp tác quốc tế đa trung tâm nhằm xác nhận hoặc bác bỏ hiệu quả đó bằng cách đưa 20000 bệnh nhân vào nghiên cứu. Tháng 5 năm 2004, ủy ban giám sát dữ liệu đã tiết lộ kết quả không rõ ràng cho ban chỉ đạo, và đã ngừng nghiên cứu lúc được 10008 bệnh nhân. So với giả dược, nguy cơ tử vong do tất cả các nguyên nhân trong vòng 2 tuần cao hơn ở nhóm dùng corticoid (1052 [21,1%] so với 893 [17,9%] người chết, nguy cơ tương đối = 1,18 [95% CI = 1,09-1,27]; p = 0.0001). Các tác giả kết luận rằng không có sự giảm tỷ lệ tử vong với methylprednisolone trong 2 tuần sau khi chấn thương đầu. Nguyên nhân của sự gia tăng nguy cơ tử vong trong vòng 2 tuần không rõ ràng [114]. Do đó, ở bệnh nhân TBI nặng, methylprednisolone liều cao được chống chỉ định [4].
Hôn mê Barbiturate
Hôn mê Barbiturate được chứng minh là liệu pháp hiệu quả cho tăng áp nội sọ kháng trị. Barbiturates làm giảm chuyển hóa trong não và CBF, và giảm ICP [115]. Barbiturat liều cao có thể được xem xét trong các bệnh nhân TBI nặng, ổn định về huyết động, kháng trị với điều trị nội khoa và phẫu thuật nhằm giảm ICP. Tác dụng phụ chính của chúng là: hạ huyết áp, đặc biệt ở bệnh nhân suy giảm thể tích; và ức chế miễn dịch với tỷ lệ nhiễm trùng gia tăng [116]. Tuy nhiên, sử dụng dự phòng của barbiturat để gây ức chế các rối loạn EEG không được khuyến cáo [4]. Pentobarbital được khuyến cáo cho việc khởi đầu hôn mê barbiturate như sau:
- Pentobarbital: 10 mg/kg trong 30 phút, sau đó
o 5 mg/kg/h trong 3 giờ, sau đó
o 1 mg/kg/h
- Để thay thế, sodium thiopental được sử dụng như sau:
o 2.5-10 mg/kg IV, bolus chậm, sau đó
o 0.5-2 mg/kg/h
Dịch và điện giải
Mục tiêu của việc xử trí là thiết lập và duy trì đẳng thể tích đến tăng thể tích vừa phải (CVP = 8 – 10 mm Hg, PCWP = 12 – 15 mm Hg). Cân bằng dịch âm đã được chứng minh có liên quan đến tác động xấu đến kết cục, độc lập với mối quan hệ với ICP, MAP hoặc CPP [117]. Các dung dịch tinh thể đẳng trương nên được sử dụng để xử trí dịch, và dung dịch muối sinh lý (NS) là giải pháp được đề nghị. Hồi sức dịch tích cực bằng dung dịch NS có thể dẫn đến tình trạng toan chuyển hoá tăng clo máu, một kết quả thường thấy của hồi sức bằng nước muối sinh lý một lượng dịch lớn, với các tác động lâm sàng khác nhau. Các dung dịch nhược trương, như 1/2 NS, 1⁄4 NS, Dextrose 5% trong nước (D5% W), D5% 1/2 NS, hoặc D5% 1⁄4 NS nên tránh. Dung dịch Lactate Ringer có tính chất nhược trương và không thích hợp để hồi sức dịch ở những bệnh nhân TBI nặng, đặc biệt là hồi sức với thể tích lớn, vì nó có thể làm giảm áp suất thẩm thấu của huyết thanh. Cần tránh các dung dịch có chứa glucose, như trên hoặc D10% W trong 24 đến 48 giờ đầu tiên, trừ khi bệnh nhân có thể bị hạ đường huyết nếu không có sự hỗ trợ dinh dưỡng. Ngoài các tác động bất lợi của tăng đường huyết trong TBI, quá trình trao đổi chất glucose kỵ khí tạo ra toan máu và nước tự do; cả hai sẽ làm trầm trọng thêm phù não. Việc sử dụng chất keo nên rất thận trọng vì báo cáo, trong thử nghiệm SAFE, có liên quan đến tỷ lệ tử vong tăng lên ở bệnh nhân bị TBI [118]. HSS đã được chứng minh là có hiệu quả trong việc giảm phù não, làm giảm ICP tăng, và tăng MAP và CPP [119]. Các lợi ích tiềm tàng khác của HSS bao gồm việc tăng nhanh khối lượng nội mạch máu (với thể tích nhỏ), tăng cung lượng tim và trao đổi khí phổi, đảo ngược điều hòa miễn dịch do hạ huyết áp và giảm sản xuất dịch não tủy. HSS cũng có liên quan đến các phản ứng phụ tiềm ẩn bao gồm tăng huyết áp đột ngột, tăng natri máu, thay đổi ý thức và động kinh. Tuy nhiên, kết quả tổng thể của các nghiên cứu liên quan đến HSS là không nhất quán và cần thêm các thử nghiệm lâm sàng để xác định vai trò của nó.
Ở những bệnh nhân TBI nặng có tăng ICP hoặc phù não, có thể chấp nhận nồng độ natri huyết thanh Na+ lên đến 150 – 155 mEq/L [120]. Tuy nhiên, rối loạn điện giải là những biến chứng phổ biến sau TBI. Tổn thương đến hệ thống dưới đồi-hypothalamic là một yếu tố góp phần quan trọng. Các nguyên nhân phổ biến nhất gây tăng natri máu (Na+ > 150 mmol/L) ở bệnh nhân TBI là đái tháo nhạt trung tâm hoặc thần kinh, lợi tiểu thẩm thấu (mannitol) và sử dụng HSS. Điều chỉnh tăng natri huyết nặng (Na+ > 160 mmol/L) nên được dần dần, sự thay đổi đột ngột áp suất thẩm thấu huyết tương và giảm nhanh nồng độ natri huyết thanh sẽ làm trầm trọng thêm phù não. Hồi sức dịch của bệnh nhân TBI tăng natri máu và giảm thể tích chỉ nên dùng NS giai đoạn đầu. Quản lý các rối loạn điện giải nên thực hiện sau khi khôi phục thể tích tuần hoàn hoàn chỉnh. Hạ natri máu là tổn thương não nghiêm trọng và thứ phát có hệ thống ở bệnh nhân TBI nặng vì nó làm tăng phù não và gia tăng ICP. Nó thường là thứ phát sau hội chứng mất muối do não (cerebral salt wasting syndrome) [121], hoặc hội chứng tiết ra hormone chống bài nôn không thích hợp (SIADH). Giảm phosphate máu và giảm magne máu là những biến chứng phổ biến ở những bệnh nhân bị thương đầu và họ hạ thấp ngưỡng co giật [122, 123].
Lund therapy
“Liệu pháp Lund” của TBI nặng dựa trên các nguyên lý sinh lý đối với mô não và điều hòa thể tích máu. Liệu pháp này nhằm mục đích ngăn ngừa tình trạng thiếu oxy tế bào não đồng thời thực hiện các biện pháp quá trình lọc đối chiều xuyên mao mạch. Khái niệm Lund là có lợi hơn nếu rào cản máu não bị gián đoạn và thích hợp hơn nếu tự động bù áp lực bị mất. Liệu pháp này có hai mục tiêu chính: thứ nhất để giảm hoặc ngăn ngừa sự gia tăng ICP (mục tiêu ICP), và thứ hai để cải thiện sự tưới máu và oxy hóa xung quanh vùng dập não (mục tiêu tưới máu) bằng cách duy trì oxy hóa máu bình thường, thể tích máu bình thường và hematocrit bình thường. Phác đồ điều trị, để giảm ICP đang tăng, bao gồm bảo tồn một áp suất keo thông thường (nồng độ protein huyết tương bình thường), giảm áp lực nội mạch thông qua việc giảm huyết áp hệ thống bằng liệu pháp hạ áp (thuốc chống beta1, metoprolol, kết hợp với chủ vận-alpha 2, clonidine) và đồng thời, co mạch vừa phải của các mạch máu tiền mao mạch với liều thấp thiopental và dihydroergotamine. Một số nghiên cứu đã báo cáo rằng liệu pháp Lund có liên quan đến kết quả lâm sàng được cải thiện [124]
Chăm sóc tích cực tổng quát
Tương tự như các bệnh nhân khác trong ICU, bệnh nhân TBI nên được chăm sóc hàng ngày như sau:
- Nâng đầu giường lên 30°-45°: làm giảm ICP và cải thiện CPP [125]; và giảm nguy cơ viêm phổi liên quan đến thở máy (VAP).
- Giữ đầu và cổ của bệnh nhân ở vị trí trung lập: điều này sẽ cải thiện dẫn lưu máu tĩnh mạch não và giảm ICP.
- Tránh chèn ép các tĩnh mạch cảnh trong và cảnh ngoài bằng cố định cổ cứng hoặc cố định ống nội khí quản quá chặt có thể làm cản trở việc dẫn lưu tĩnh mạch ở não và làm tăng ICP.
- Xoay bệnh nhân đều đặn và thường xuyên, kèm theo dõi kỹ ICP [126].
- Cung cấp chăm sóc mắt, vệ sinh miệng và da.
- Thực hiện tất cả các gói dựa trên bằng chứng để phòng ngừa nhiễm trùng bao gồm VAP [127] và catheter trung ương [128].
- Dùng thuốc tránh táo bón, gây tăng áp lực ổ bụng và ICP.
- Thực hiện vật lý trị liệu
Mở hộp sọ giải áp và cắt bỏ bán cầu não
Phẫu thuật mở xương sọ giải áp đã được đề xuất như một phương pháp điều trị đầy hứa hẹn cho bệnh nhân bị TBI cấp tính nghiêm trọng có nguy cơ mắc chứng phù não nặng. Mở hộp sọ giải áp và cắt bỏ bán cầu não, cả hai đều được chấp nhận để điều trị phẫu thuật tăng áp lực nội sọ kháng trị trong những trường hợp xử trí nội khoa không thành công. Phẫu thuật được thực hiện như là một thủ tục cứu mạng sống khi tử vong sắp xảy ra từ tăng áp lực nội sọ. Mặc dù phẫu thuật này đang ngày càng được sử dụng, bằng chứng về những ảnh hưởng tổng thể của nó đối với kết quả là mâu thuẫn. Albanèse và cs, trong nghiên cứu thuần tập 40 bệnh nhân tăng áp lực nội sọ kháng trị và có nguy cơ cao về tử vong do não, phẫu thuật mở sọ giải áp đã cho phép 25% bệnh nhân đạt được phục hồi chức năng xã hội ở 1 năm sau [129]. Cooper và cộng sự, trong một thử nghiệm đối chứng ngẫu nhiên, ở 155 người trưởng thành bị TBI nặng và tăng áp nội sọ, phẫu thuật mở hộp sọ vùng thái dương-trán có liên quan đến giảm áp lực nội sọ (P <0.001) so với chăm sóc chuẩn, và thời gian ở lại trong ICU (P <0.001), tuy nhiên, với kết quả không thuận lợi hơn (odds ratio = 2.21, 95% CI = 1.14 – 4.26, P = 0.02). Tỷ lệ tử vong ở 6 tháng tương tự nhau ở nhóm mở hộp sọ (19%) và nhóm chăm sóc chuẩn (18%) [130].
Dự báo kết cục sau TBI
Việc dự báo sớm kết cục sau khi TBI là rất quan trọng. Một vài mô hình dự báo cho kết cục bệnh nhân sau khi TBI nặng đã được đề xuất [131, 132]. Một mô hình tiên đoán tương đối đơn giản sử dụng 7 đặc điểm cơ bản tiên đoán bao gồm tuổi tác, điểm vận động, phản ứng đồng tử, thiếu oxy mô, hạ huyết áp, phân loại chụp cắt lớp vi tính và xuất huyết dưới màng nhện do chấn thương đã báo cáo chính xác kết quả 6 tháng ở bệnh nhân TBI nặng hoặc trung bình [131 ]. Một mô hình tiên đoán dựa trên tuổi, mất phản xạ ánh sáng, sự xuất hiện của xuất huyết dưới màng nhện lan rộng, ICP và sự di lệch qua đường giữa được cho là có giá trị tiên đoán cao và hữu ích cho việc ra quyết định, xem xét điều trị và tư vấn gia đình trong trường hợp bệnh TBI [ 132].
Kết luận
Việc xử trí TBI nặng tập trung vào việc chăm sóc tích cực tỉ mỉ và toàn diện bao gồm phương pháp tiếp cận đa phương tiện, bao gồm sự hỗ trợ huyết động, chăm sóc hô hấp, xử trí dịch và các khía cạnh khác của điều trị nhằm mục đích ngăn ngừa biến chứng xấu của tổn thương não thứ cấp, duy trì CPP đầy đủ và tối ưu hoá oxy hóa não. Cách tiếp cận này rõ ràng đòi hỏi những nỗ lực của một nhóm đa ngành bao gồm hồi sức thần kinh, phẫu thuật thần kinh, điều dưỡng tại giường và liệu pháp hô hấp, và các thành viên khác của đội ngũ y tế. Mặc dù việc quản lý như vậy có thể là một thách thức, cũng như tác động kinh tế xã hội của vấn đề.



![[Cảnh báo] Để cải thiện thiếu máu não nên ăn gì? Kiêng ăn gì? Thiếu máu não nên ăn gì?](https://www.healcentral.org/wp-content/uploads/2020/11/thieu_mau_nao_nen_an_gi1-218x150.jpg)

