Bài viết Cá nhân hoá thông khí cơ học theo các thông số sinh lý để ổn định phế nang và giảm thiểu tổn thương phổi do thở máy gây ra (VILI) được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: Personalizing mechanical ventilation according to physiologic parameters to stabilize alveoli and minimize ventilator induced lung injure (VILI)
Tóm tắt
Thông khí cơ học ở bệnh nhân có hoặc có nguy cơ cao bị ARDS có thể là một con dao hai lưỡi. Nếu nhịp thở cơ học được đặt không đúng, nó có thể làm khuếch đại tổn thương phổi liên quan đến ARDS, gây ra chấn thương phổi do thở máy (VILI). Ngược lại, nhịp thở cơ học có thể được điều chỉnh để giảm thiểu VILI, có thể làm giảm tỷ lệ tử vong ARDS. Tiêu chuẩn hiện tại của chiến lược thông khí cho việc chăm sóc để giảm thiểu VILI cố gắng làm giảm sự quá căng phế nang và quá trình huy động/mất huy động (R/D, recruitment-derecruitment) bằng cách giảm thể tích khí lưu thông (Vt) đến 6 cc/kg kết hợp với việc điều chỉnh PEEP trên một thang theo hướng thay đổi oxygen hóa. Do đó, Vt thường không phải là một cách tiếp cận “một kích cỡ phù hợp cho tất cả” và mặc dù PEEP thường được đặt tùy ý ở 5 cmH2O, nó có thể được cá nhân hoá theo những thay đổi trong một tham số sinh lý, thường sử dụng nhất là oxygen hóa. Tuy nhiên, có bằng chứng cho thấy oxygen hóa là phương pháp để tối ưu PEEP không phù hợp với mức PEEP cần thiết để duy trì một phổi mở và ổn định. Do đó, PEEP tối ưu có thể không được cá nhân hoá theo oxygen hóa như là hệ thống phản hồi sinh lý. Nhiều phương pháp cá nhân hóa PEEP đã được kiểm tra và bao gồm khoảng chết, độ giãn nở phổi, stress và strain phổi, mô hình thông khí sử dụng chụp cắt lớp điện toán (CT) hoặc chụp cắt lớp trở kháng điện tử (EIT), điểm uốn trên đường cong áp lực/thể tích (P/V), và độ dốc của đường cong lưu lượng thở ra sử dụng thông khí giải áp đường thở (APRV). Mặc dù nhiều nghiên cứu đã chỉ ra rằng việc cá nhân hoá PEEP là có thể, nhưng không có sự đồng thuận về kỹ thuật tối ưu. Tổng quan này sẽ đánh giá các phương pháp khác nhau được sử dụng để cá nhân hóa PEEP, được hướng dẫn bởi các thông số sinh lý, cần thiết để điều chỉnh thích ứng các thông số thở máy với những thay đổi tiến bộ về sinh lý bệnh phổi.
Tổng quan
Các cải tiến trong các chiến lược thông khí cơ học bảo vệ phổi đã giảm tỷ lệ tử vong do hội chứng nguy kịch hô hấp cấp (ARDS) từ mức tử vong nhất định (~ 70%) đến tỷ lệ tử vong hiện tại khoảng 40% [1] ở dạng trung bình đến nặng [2]. Mặc dù một số nghiên cứu cho thấy giảm tỷ lệ tử vong ARDS [3], một đánh giá gần đây kết luận rằng tỷ lệ tử vong ARDS vẫn không thay đổi và không bị giảm trong gần 15 năm [1, 4]. Do đó, các nghiên cứu đã chuyển từ điều trị sang dự phòng ARDS, bằng cách sử dụng các chiến lược thở máy ưu tiên áp dụng cho phổi bình thường ở những bệnh nhân có nguy cơ cao bị ARDS [5, 6]. Các chiến lược thở máy trước đây đã được chứng minh là làm giảm các biến chứng của bệnh nhân thở máy bằng cơ chế duy trì phổi thông khí đồng nhất, phổi mở, và giảm thiểu sự xẹp và giãn nở phế nang lặp đi lặp lại với mỗi nhịp thở. Tuy nhiên, các chiến lược trước đây vẫn còn sử dụng phương pháp “một kích cỡ phù hợp cho tất cả” để điều trị ARDS [7] và vẫn chưa giảm rõ rệt tần suất ARDS. Nhiều bác sĩ không nghiêm túc tuân theo đề nghị 6 cc/kg cho tất cả bệnh nhân, nhưng điều chỉnh bằng cách sử dụng kiến thức lâm sàng của họ để điều chỉnh Vt nhằm đáp ứng tốt hơn nhu cầu của bệnh nhân. Hơn nữa, PEEP và FiO2 được điều chỉnh theo đáp ứng oxygen hóa, điều này cho thấy không tương quan tốt với những thay đổi bệnh lý trong cơ học phổi, nên có thể vẫn gây ra tổn thương phổi do thở máy (VILI) [8, 9].
Tối ưu hóa nhịp thở cơ học bảo vệ phổi có thể đạt được nếu có hệ thống phản hồi vòng kín, trong đó bác sĩ phân tích sự thay đổi trong sinh lý phổi và sử dụng nó như là phản hồi để điều chỉnh các cài đặt thông khí, với mục đích duy trì một phổi mở và ổn định bất kể mức độ bệnh lý phổi (Hình 1) [10, 11]. Vì các hằng số thời gian mở và xẹp của phế nang thay đổi tùy thuộc vào mức độ nghiêm trọng của tổn thương phổi và tiến triển khi bệnh lý phổi cải thiện hoặc xấu đi, cài đặt máy thở phải được điều chỉnh liên tục để phù hợp với các nhu cầu cụ thể của từng cá nhân [12-19]. Các thành phần bao gồm khuôn mẫu nhịp thở cơ học (MBP, Mechanical Breath Profile) (ví dụ áp lực, lưu lượng, thể tích, tần số và thời gian thở được áp dụng trong mỗi nhịp thở) đã được nhắm mục tiêu cho cá nhân [20-22], nhưng cá nhân hóa mức PEEP đã được nghiên cứu nhiều nhất. Nhiều nghiên cứu đã xem xét hoặc thử nghiệm các phương pháp áp dụng PEEP theo bệnh lý phổi [23-30]. Tuy nhiên, không có sự đồng thuận về chiến lược tối ưu trong cá nhân hóa mức PEEP của thông khí cơ học bảo vệ.
Để xác định chiến lược đó, trước hết phải hiểu cơ chế thông khí áp lực dương làm tổn thương mô phổi như thế nào. Như vậy, tổng quan này sẽ thảo luận về các cơ chế đã gây ra VILI ở cấp phế nang. Sử dụng sự hiểu biết của chúng ta về sinh lý sinh học động xảy ra trong môi trường vi mô (tức là các túi phế nang và phế nang), chúng ta có thể hình thành các giả thuyết về phương pháp tối ưu để cá nhân hoá PEEP, cần thiết để ngăn ngừa tổn thương phổi cấp (ALI). Đặt PEEP lý tưởng để ổn định phổi là một thông số quan trọng trong việc giảm VILI và sẽ là trọng tâm của tổng quan này, cần nhớ rằng toàn bộ MBP phải được điều chỉnh đúng cách để tối đa hóa việc bảo vệ phổi.
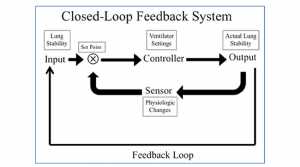
”Input là thông số sinh lý quan trọng sẽ được duy trì bởi hệ thống phản hồi; trong trường hợp này sự ổn định phổi. Set point là thông số trên máy thở sẽ được điều chỉnh để duy trì input theo yêu cầu. Controller là những gì sẽ được điều chỉnh để duy trì các set point; trong trường hợp này cài đặt máy thở như thể tích khí lưu thông và PEEP. Output là hiệu quả sinh lý mong muốn; trong trường hợp này sự ổn định phổi thực tế. Thành phần chính của hệ thống phản hồi chức năng là sự hiện diện của một cảm biến có thể xác định được nếu output nhỏ hơn mong muốn và nó sẽ điều chỉnh lại set point để đưa output trở lại như mong muốn. Những thay đổi về sinh lý trong chức năng phổi, như oxygen hóa, khoảng chết, compliance phổi, các điểm uốn trên đường cong áp lực/thể tích, stress index, hình ảnh, hoặc độ dốc của đường cong lưu lượng thở ra, có thể được sử dụng làm cảm biến để duy trì input mong muốn.”
Cơ chế của VILI trong môi trường vi mô – phế nang và ống phế nang
Mặc dù vẫn còn tranh luận [31], có rất nhiều tài liệu hỗ trợ ba cơ chế mà các phế nang và ống dẫn phế nang bị tổn thương trong quá trình thông khí cơ học:
1. quá căng phế nang (OD, overdistension) [32];
2. huy động/mất huy động động (R/D, dynamic recruitment and derecruitment) gây ra một strain động (dynamic strain) đáng kể với mỗi nhịp thở; và
3. tập trung căng thẳng (S-C, stress-concentration) xảy ra giữa các phế nang mở và xẹp hoặc các phế nang chứa đầy dịch phù (Hình 2) [33, 34].
Tổn thương mô, là hậu quả của thương tích cơ học, do tổn thương viêm thứ phát gọi là biotrauma [35], làm trầm trọng thêm tổn thương cơ học cơ bản. Tuy nhiên, vẫn chưa rõ cơ chế nào trong ba cơ chế này đóng vai trò quan trọng nhất trong VILI. Thông tin quan trọng này là cần thiết để xác định PEEP nên được áp dụng như thế nào khi cố gắng ngăn chặn (các) thành phần VILI gây tổn thương nhất. Sau đây là một đánh giá về tầm quan trọng tương đối của từng cơ chế trên của VILI.
Alveolar over-distension (OD) – Quá căng phế nang
Nên biết rằng ARDS gây ra tổn thương không đồng nhất với phổi bị xẹp hoặc phù phổi, bên cạnh mô phổi bình thường. Kể từ khi công bố báo cáo cho thấy thể tích khí lưu thông thấp làm giảm tỷ lệ tử vong ARDS, cơ chế giả định cho việc bảo vệ này là giảm sự giãn nở quá mức của mô phổi bình thường [7]. Gattinoni và cộng sự tăng cường giả thuyết này bằng cách sử dụng thuật ngữ ‘Baby Lung’ cho mô phổi bình thường còn lại ở bệnh nhân ARDS. Họ giả thuyết rằng phần lớn Vt sẽ được chuyển đến phổi bình thường, do đó gây tổn thương mô bằng cách giãn nở phế nang quá mức [32]. Hầu hết các dữ liệu hỗ trợ OD như là một cơ chế của VILI, không trực tiếp đo lường sự thay đổi kích thước phế nang mà là đo sự thay đổi mật độ phổi, bằng cách sử dụng chụp cắt lớp vi tính (CT) [36]. Sử dụng CT, nhu mô phổi được phân loại theo tỷ lệ khí/mô thành bốn loại: (1) không phồng lên (not- inflated); (2) kém thổi phồng (poorly inflated); (3) thổi phồng (inflated); và (4) bị quá căng (overinflated) [33, 36]. Các vùng phổi ở nhóm ‘Baby Lung’ được giả thuyết là các mô bị hư hỏng trong quá trình thở khí lưu thông, do đó làm giảm Vt sẽ làm giảm sự căng mô phổi và VILI, và được cho là cơ chế giảm tỷ lệ tử vong bằng cách sử dụng thông khí Vt thấp [7].

”Bao gồm: (1) quá căng phế nang của mô gây ra bởi thể tích và áp lực quá mức, (2) sự xẹp phế nang và tái mở lại với mỗi nhịp thở thứ phát do bất hoạt surfactant, và (3) tập trung căng thẳng gây ra bởi sự thông khí không đồng nhất với các phế nang mở liền kề với các phế nang xẹp hoặc phù. Một ống phế nang (màu vàng) được bao quanh bởi các phế nang đại diện bởi hình lục giác. Hình a: Thể tích/áp lực thấp (mũi tên nhỏ) không làm quá căng ống phế nang hoặc bóp méo phế nang xung quanh. Thể tích/áp lực cao (mũi tên lớn) và các ống dẫn khí ở phình to và bóp méo các phế nang xung quanh có thể dẫn đến chứng stress-failure trong các mô này.[40] Hình b: Bất hoạt surfactant là một dấu hiệu của ARDS và sẽ dẫn đến xẹp phế nang khi thở ra và mở cửa lại trong thì hít vào. Sau khi mất chức năng surfactant ở các phế nang trong thì hít vào (hình lục giác) được bơm đầy đủ. Tuy nhiên, trừ khi PEEP tăng lên, phế nang xẹp khi thở ra (hình lục giác giảm đáng kể kích thước). Việc huy động/mất huy động các phế nang này với mỗi nhịp thở gây ra chấn thương mô do stress nghiêm trọng [116, 117]. Hình c: Sự thông khí đồng nhất được thể hiện bằng các phế nang mở một cách đồng nhất (hình lục giác) và sự phụ thuộc lẫn nhau của các phế nang có kết quả chia sẻ trên vách phế nang đồng đều làm cho nó có cấu trúc rất ổn định [118]. Đường lực nội bộ (mũi tên đen) đều đều trên các mô phổi đồng nhất [119]. Thông khí không đồng nhất, nơi các khu vực cô lập của xẹp phế nang xảy ra (mũi tên màu xanh) làm gián đoạn sự ổn định của sự phụ thuộc của phế nang, làm cho stress không còn phân bố đều trên mô nữa. Do đó, bơm phồng mô không đồng nhất gây ra một tập trung đáng kể stress trong các khu vực xung quanh phế nang xẹp. Các đường nội lực cuộn về phía các phế nang sụp đổ và tập trung stress, đại diện bởi các đường stress màu đen đang trở nên gần nhau hơn, xung quanh khu vực xẹp phế nang. Sự tập trung stress này sẽ làm trầm trọng thêm các tổn thương mô ở khu vực xung quanh xẹp phế nang [33]”
Tuy nhiên, rất nhiều tài liệu ủng hộ quan niệm cho rằng quá căng phế nang trong mô phổi bình thường (tức là Baby Lung) sẽ không gây ra mô bệnh học điển hình của VILI, mặc dù nó có thể gây ra xé rách đường dẫn khí dẫn đến tràn khí màng phổi. Đánh giá trực tiếp sự thay đổi kích thước phế nang, sử dụng nhiều kỹ thuật, đã chỉ ra rằng phế nang không mở rộng đáng kể, như một quả bóng cao su, với thể tích hoặc áp lực cao [37, 38]. Những hình ảnh khác đã cho thấy những thay đổi không đồng nhất về kích cỡ và hình dạng phế nang với bơm phồng phổi nhưng cũng không cho thấy sự quá căng của phế nang [39]. Vị trí của sự giãn nở quá mức và tiềm năng bị vỡ có thể là ống phế nang, chứ không phải là các phế nang riêng lẻ (Hình 2a) [40].
Công việc ban đầu của Dreyfuss et al. đã chứng minh rằng thể tích phổi và áp lực đường thở cao có thể gây ra quá căng phế nang, gây ra tổn thương phổi nhưng không gây thương tích, miễn là strain phế nang động phụ thuộc vào việc huy động/mất huy động (R/D) đã được ngăn ngừa với PEEP đầy đủ [41]. Tương tự, Seah và cộng sự cho thấy rằng sự căng phấ nang quá mức do Vt cao không gây ra mô bệnh học phổi trừ khi nó kết hợp với strain động cao khi PEEP được đặt ở mức zero [42, 43]. Sử dụng một phương pháp mới về hít khí phân cực (polarized gas inhalation), có thể xác định được sự thay đổi động trong các cấu trúc nhỏ như phế nang và ống dẫn phế nang, cho thấy thể tích phổi gia tăng với PEEP thực sự giảm kích thước phế nang, trong khi tăng số lượng phế nang [44]. Do đó, mô phổi ‘thổi phồng lên’ trên CT có thể không phải do các phế nang phình ra mà là do sự gia tăng số lượng các phế nang nhỏ hơn, mới được huy động. Nói tóm lại, vai trò của quá trình giãn nở tổng thể phế nang như là cơ chế chính của VILI vẫn còn đang được đặt ra với nhiều nghiên cứu chứng minh rằng strain phế nang động (tức là R/D) và không phải là OD là cơ chế của VILI [45, 46]. Các nghiên cứu này được Amato bổ sung, cho thấy kết quả của ARDS có liên quan đến áp lực đẩy hoặc R/D động theo chu kỳ thở thay vì thể tích khí lưu thông cuối thì hít vào tĩnh/sự căng phổi ở áp lực cao nguyên [22].
Alveolar recruitment/derecruitment (R/D) – Huy động/mất huy động phế nang
Khả năng điều chỉnh các cài đặt máy thở cơ học cần thiết để ổn định phổi trong quá trình thở ra được coi là một phương pháp quan trọng để giảm R/D và do đó làm giảm tổn thương phổi. Hầu hết các nghiên cứu đều chỉ ra rằng áp lực đường thở tĩnh cao – high static airway pressure (OD) với strain động nhỏ nhất (tức là xẹp phế nang và mở lại) sẽ không gây ra VILI [41,42,47,48]. Đo trực tiếp R/D phế nang bằng kính hiển vi trong cơ thể chứng minh rằng việc ổn định phế nang với PEEP đủ mạnh làm giảm đáng kể ALI [49]. Vai trò bệnh học của R/D được chứng minh rõ ràng nhất trong các nghiên cứu trong đó động vật được thông khí ở thể tích phổi tĩnh cao (strain tĩnh cao) liên quan đến sự quá căng phế nang và có hoặc không có strain động cao (R/D). Strain tĩnh cao không gây ra mô bệnh học và phù phổi đặc trưng của ARDS trừ khi kết hợp với strain động cao. Tăng Vt và giảm PEEP được sử dụng để tạo ra strain động cao (Hình 2b), trong khi giảm Vt và PEEP tăng được sử dụng để tạo ra strain động thấp [47, 48]. Kết hợp, các nghiên cứu này cho thấy thêm rằng strain động gây ra là do R/D phế nang, và không phải do căng phế nang quá mức như đã nghĩ ban đầu, là cơ chế chính của VILI, điều này thúc đẩy ALI tiến triển. Do đó, nếu xẹp phế nang trong thì thở ra có thể được ngăn ngừa bằng PEEP điều chỉnh đúng cách, VILI sẽ được giảm đáng kể.
Alveolar stress concentrators (SC) – Tập trung căng thẳng phế nang
Các nghiên cứu gần đây đã xác định được một cơ chế VILI khác, xảy ra trong quá trình thông khí không đồng nhất khi các phế nang mở liền kề với các phế nang bị xẹp hoặc phù nề, gây ra tập trung căng thẳng tạo ra sự căng quá mức trên các vách phế nang (Hình 2c) [33, 34]. Retamal et al. chứng minh, trong một mô hình tổn thương phổi không đồng nhất ở chuột, những căng thẳng gây tổn thương xảy ra ở giao diện giữa xẹp và mở [34]. Họ đưa ra giả thuyết rằng xẹp phế nang khu trú sẽ hoạt động như một SC làm trầm trọng thêm các tổn thương mô ở những khu vực này. Dữ liệu của họ ủng hộ giả thuyết này, chứng tỏ sự gia tăng viêm và tổn thương cấu trúc trong các mô lành mạnh nằm sát với mô xẹp trong quá trình thông khí cơ học [34]. Cressoni và cộng sự giả thuyết rằng cơ chế của VILI trong phổi bị ALI là do sự hiện diện của sự không đồng nhất tại chỗ hoạt động như SC [33]. Sự hiện diện của sự không đồng nhất tại chỗ đã được xác định bằng CT ở bệnh nhân ARDS. Tăng tính đa dạng của phổi có tương quan với mức độ nghiêm trọng của ARDS và là biến số duy nhất liên quan độc lập với tử vong. Tăng PEEP làm giảm sự không đồng nhất của phổi. Borges et al. cho thấy sự gia tăng viêm trong mô phổi liên quan đến sự không đồng nhất của phổi sử dụng chụp cắt lớp positron kết hợp (PET) và CT, tiếp tục hỗ trợ các nghiên cứu này [50]. Wellman et al. tiếp tục hỗ trợ công việc của Borges và chứng minh rằng biến dạng phổi vùng gây ra viêm cục bộ trong quá trình thông khí cơ học trong mô hình ARDS ở cừu [51].
Sinh bệnh học của ARDS có thể bắt đầu khi mất chức năng surfactant, gây ra bởi sự thông khí (thông khí tự nhiên hoặc thông khí cơ học), dẫn đến các phế nang xẹp hoạt động như SC trong mô xung quanh chúng [52, 53]. Do đó, SC có thể là bước đầu tiên trong quá trình hình thành bệnh ALI, nếu không kiểm tra sẽ dẫn đến ARDS. Nó đã được chỉ ra rằng VILI có thể gây ra ngay cả với thông khí Vt thấp [54, 55]. Người ta đã giả thuyết rằng cơ chế gây VILI do Vt thấp làm phổi xẹp do các lượng thông khí nhỏ dẫn đến sự thông khí của phế nang không đồng nhất gây SC và sự căng thẳng tại chỗ quá mức [56, 57, 58]. Giả thuyết này được Wellman và cộng sự ủng hộ, người đã cho thấy trong giai đoạn đầu ALI rằng: (1) strain phổi khu vực cao do SC gây ra có thể xuất hiện ngay cả khi train toàn phần không nằm trong phạm vi bệnh học; (2) viêm địa phương có mối quan hệ tuyến tính dương tính với strain động theo chu kỳ thở; (3) viêm hệ thống (truyền nội độc tố vi trùng) làm trầm trọng thêm chứng viêm này; và (4) đồng nhất các strain khu vực theo chu kỳ thở (giảm tập trung stress) bằng cách tăng PEEP và làm giảm Vt làm giảm viêm cục bộ [51].
Tóm lại, các dữ liệu mới nổi cho thấy sự hiện diện của SC là một cơ chế chính của VILI. Bằng chứng cũng ủng hộ giả thuyết cho thấy strain động do R/D phế nang gây ra có ý nghĩa đáng kể đến sinh lý bệnh VILI, trong khi đó strain tĩnh cao là một cơ chế VILI ít quan trọng hơn. Vì vậy, tổng quan này sẽ tập trung vào cách làm sao PEEP có thể được cá nhân hóa bằng cách sử dụng tín hiệu sinh lý để giảm tập trung căng thẳng (mở phổi) và/hoặc ngăn ngừa strain động (ổn định phổi).
Phương pháp và hiệu quả của phương pháp cá nhân hóa mức PEEP
Giới thiệu
Mặc dù việc sử dụng PEEP là công cụ chính để ổn định phổi, nhưng hàng thập kỷ nghiên cứu vẫn chưa khám phá ra cách tiếp cận tối ưu để cài đặt PEEP [59]. Nhiều nỗ lực đã được thực hiện để cá nhân hóa thông khí bảo vệ bằng cách sử dụng thay đổi trong sinh lý học phổi. Tiêu chuẩn chăm sóc hiện tại là cài đặt Vt dựa trên cân nặng của bệnh nhân, trong khi PEEP được cá nhân hoá bởi một thang trượt dựa trên sự thay đổi oxygen hóa [7]. Các phương pháp hiện tại và hiệu quả của việc cá nhân hóa mức PEEP đối với sinh lý phổi cá nhân được sử dụng lâm sàng sẽ được xem xét.
Đại cương về cá nhân hóa mức PEEP
Việc áp dụng PEEP, trước khi bắt đầu chấn thương phổi, đã ngăn cản sự phát triển ALI trong nhiều nghiên cứu trên động vật [60]. Bảo vệ này có hiệu quả trong các mô hình nhiều tổn thương bao gồm tính thấm qua nội mô cao, áp lực mạch máu cao, lực căng bề mặt cao, và áp lực đường thở cao [60]. Mặc dù nhiều cơ chế bao gồm thay đổi phương trình dòng chảy của chất lỏng Starling (tức là tăng áp lực mô kẽ) [61] và dự trữ chức năng surfactant [52] đóng một vai trò trong việc bảo vệ phổi do PEEP gây ra, ổn định phế nang là rất quan trọng và đã được chứng minh là ngăn chặn tiến triển ALI [49]. Những nghiên cứu này cho thấy PEEP điều chỉnh đúng cách có thể có tác dụng bảo vệ đáng kể ở những bệnh nhân có nguy cơ cao ARDS. Tuy nhiên hiện nay vẫn chưa có sự nhất trí về phương pháp tối ưu để cài đặt PEEP với mục tiêu giảm VILI và ngăn chặn tiến trình ALI [62]. Caramez et al. so sánh việc sử dụng nhiều thông số sinh lý để cài đặt PEEP sau một bước thủ thuật huy động phế nang (RM, recruitment maneuver) trong một mô hình rửa nước muối ở cừu [24]. Họ phát hiện ra compliance hô hấp động theo chu kỳ thở, PaO2 tối đa, PaO2 + PaCO2 tối đa, shunt thấp nhất, điểm uốn dưới (PFLEX), và điểm tăng tối đa compliance (Pmci,i) trên nhánh hít vào của đường cong áp lực – thể tích (P-V), tất cả các cài đặt một mức độ tương tự của PEEP. Tuy nhiên, PEEP thu được bằng cách sử dụng PFLEX trên phần nhánh thở ra của đường cong P-V và sự giảm compliance tối đa đối với phần nhánh thở ra của đường cong P-V cho thấy đặt PEEP cao hơn đáng kể; điểm uốn thật sự trên nhánh hít vào và PaCO2 tối thiểu đặt PEEP thấp hơn đáng kể. Họ đã kết luận rằng PEEP phổi mở (PEEP dẫn đến bơm phồng phế nang đồng nhất) có thể được xác định bằng một thử nghiệm PEEP giảm dần theo sau thực hiện RM bằng cách sử dụng các thông số sinh lý (compliance hô hấp động tối đa, tối đa PaO2, PaO2 tối đa + PaCO2, shunt tối thiểu hoặc PFLEX nhánh hít vào của đường cong P-V và Pmci,i).
Tiêu chuẩn chăm sóc hiện tại sử dụng oxygen hóa làm tiêu chuẩn để đặt PEEP kết hợp với Vt và Pplat thấp < 30 cmH2O, nhưng không có sự khác biệt về kết quả giữa PEEP cao [63] và PEEP thấp [7] sử dụng trong chiến lược này. Nó đã chỉ ra rằng PEEP dựa trên sự thay đổi oxygen hóa, chứ không phải sự thay đổi cơ học phổi, có thể dẫn đến việc điều trị với PEEP không đủ để ổn định phổi [64]. Vì quá trình oxygen hóa PEEP là tiêu chuẩn chăm sóc hiện tại, chúng tôi sẽ bắt đầu bằng cách xem lại bằng chứng về hiệu quả của chiến lược này và các phương pháp khác được sử dụng để cá nhân hóa PEEP có cơ sở dữ liệu đáng kể để phân tích.
Cá nhân hóa mức PEEP bằng oxygen hóa
Vì chức năng chính của phổi là oxygen hóa và thông khí, những nỗ lực đầu tiên để cá nhân hóa PEEP đã sử dụng oxygen hóa để cài đặt mức PEEP. PEEP được tăng lên với sự tập trung vào việc điều chỉnh khí máu động mạch cho đến khi oxygen hóa được bình thường hóa, bất kể tác động lên cơ học phổi, gây ra VILI nghiêm trọng với tỷ lệ tử vong giữa 50-75% [65]. Nó đã được chỉ ra rằng oxygen hóa không xác định sự hiện diện của R/D phế nang (tức là, strain động) [8, 9], và cải thiện oxygen hóa không phải lúc nào cũng xác định được huy động phổi [66]. Hơn nữa, PEEP cài đặt để tối ưu hóa oxygen hóa đã cho thấy làm tăng viêm phổi [67]. Mặc dù, như đã đề cập ở trên, có những mối quan tâm rằng oxygen hóa không phải là tham số sinh lý tối ưu để có thể cài đặt các thông số thở máy, đó vẫn là tiêu chuẩn chăm sóc lâm sàng hiện tại [7, 68].
Chiumello và cộng sự so sánh PEEP sử dụng cơ học phổi (stress index), áp lực thực quản và oxygen hóa và thấy rằng sử dụng oxygen hóa là phương pháp duy nhất cung cấp mức PEEP tương ứng với khả năng huy động phổi và dần dần gia tăng với tổn thương phổi tiến triển [69]. Nghiên cứu này chỉ được thiết kế để xác định PEEP duy trì huy động phổi và do đó chúng tôi không biết chiến lược này có giảm được tử vong hay không. Oxy có thể có ích như là một tham số phản hồi sinh lý học, khi được sử dụng kết hợp với một RM, để xác định mức PEEP cần thiết để giữ cho các phế nang mới vừa được huy động mở. Borges et al. cho thấy sau khi dùng RM, PaO2 + PaCO2 kết hợp > 400 mmHg đã xác định phổi bơm phồng đầy đủ với shunt tối thiểu (Hình 3) [70]. Đã có ba nghiên cứu lâm sàng lớn nghiên cứu vai trò của PEEP trong ARDS: nghiên cứu ALVEOLI [63] nghiên cứu LOV [71] và nghiên cứu ExPress [72]. Trong ba nghiên cứu này, chỉ có nghiên cứu ALVEOLI đã sử dụng oxygen hóa để cài đặt PEEP, các nghiên cứu LOV và ExPress đã sử dụng phương pháp thông khí phổi mở và cơ học phổi. Mặc dù không có sự khác nhau nào trong các nghiên cứu này, LOV và ExPress đã cho thấy lợi ích sống còn ở bệnh nhân ARDS nặng khi điều trị với PEEP cao hơn [73].
Tóm lại, một đánh giá gần đây cho thấy tỷ lệ tử vong không giảm đáng kể trong 15 năm qua (1998-2013) [4] cho thấy việc sử dụng các thông số sinh lý khác để điều chỉnh các cài đặt thông khí cơ học là cần thiết. Mặc dù việc sử dụng oxygen hóa để cài đặt PEEP có thể hữu ích, đặc biệt khi kết hợp với RM, sự thiếu hụt mối tương quan trực tiếp giữa phổi mở và ổn định và PaO2 làm cho chiến lược PEEP được cá nhân hoá này trở nên có vấn đề. Với điều đó, nó đã được trình bày trong một phân tích thứ cấp của các nghiên cứu LOV và ExPress rằng bệnh nhân cải thiện oxygen hóa để đáp ứng với PEEP có nguy cơ tử vong thấp hơn [74].
![Hình 3. Các phương pháp được sử dụng để cài đặt PEEP sử dụng phương pháp huy động kết hợp, và PEEP chuẩn độ để đạt được PO2 + PCO2 ≥ 400. Giao thức này được thực hiện như chụp CT (CT) đã được thực hiện để đo sự thay đổi thể tích phổi. PEEP đã được tăng lên 25 cmH2O với áp lực đẩy (ΔP) 15 cmH2O trên PEEP. Nếu không đạt được PO2 + PCO2 ≥ 400, PEEP tăng 5 cmH2O trong 2 phút, quay trở lại PEEP 25 cmH2O trong 2 phút và lặp lại cho đến khi PO2 + PCO2 ≥ 400 hoặc PEEP là 45 cmH2O. [70]](https://www.healcentral.org/wp-content/uploads/2020/12/ca_nhan_hoa_thong_khi_co_hoc_theo_cac_thong_so_sinh_ly_de_on_dinh_phe_nang_va_giam_thieu_ton_thuong_phoi_do_tho_may_gay_ra_vili_3-300x179.jpg)
Cá nhân hóa mức PEEP bằng khoảng chết
Một tham số sinh lý khác đã được sử dụng để tối ưu hóa PEEP là thông khí của khoảng chết, thường được biểu diễn như tỷ lệ khí lưu thông (Vt) chia cho khoảng chết (VD) (VD/Vt). Tăng VD/Vt là dấu hiệu của ARDS và đã được chứng minh là có liên quan độc lập với tử vong tăng lên [75] và cũng cho thấy hoạt động tốt hơn bất kỳ tham số nào về oxygen hóa trong dự báo tử vong ARDS [76]. Trong một đánh giá của Suarez-Sipmann, nó đã chỉ ra rằng những tiến bộ gần đây trong volumetric capnography (VCap) làm cho nó trở thành một công cụ tại giường mạnh để đánh giá các cài đặt thông khí bảo vệ phổi không đầy đủ và phát hiện thấy phổi quá căng (Hình 4) [77]. Maisch và cộng sự sử dụng kết hợp compliance cao nhất và VD/Vt thấp nhất để cài đặt ‘PEEP’ tối ưu cho các bệnh nhân đã được gây mê với phổi lành tính [78]. Họ chứng minh rằng sự kết hợp này dẫn đến số lượng tuyển mới được huy động tối đa, và dung tích cặn chức năng (FRC) và PaO2 không nhạy cảm khi phát hiện quá căng phế nang. Điều này được hỗ trợ bởi hai nghiên cứu sinh lý học sử dụng mô hình ARDS lợn cho thấy VD/Vt rất hữu ích trong việc xác định xẹp phổi và PEEP tối ưu cần thiết để duy trì thể tích phổi theo RM [79, 80]. Mặc dù sử dụng VCap hoặc VD/Vt để cài đặt PEEP chưa được kiểm tra hiệu quả trong một thử nghiệm lâm sàng, nhưng nó là một công cụ hữu ích để đặt PEEP tại giường.
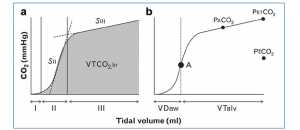
”Hình a Ba giai đoạn của nghiên cứu capnography là: Giai đoạn I chứa khí không CO2 từ nhịp thở khí lưu thông trước đó; pha II (SII) là sườn dốc có chứa CO2 từ khoang phế nang và trộn với CO2 trong đường thở từ nhịp thở trước; và pha III (SIII) là CO2 hoàn toàn từ phế nang và xác định các hằng số thời gian khác nhau của CO2 thoát ra từ mao mạch và di chuyển ra khỏi phế nang. VTCO2,br là thể tích CO2 thải ra trong một nhịp thở (vùng bóng mờ). Hình b Dấu chấm đen (A) xác định điểm giữa của SII xác định giao diện đường thở – phế nang, giữa các vận chuyển khuếch tán và đối lưu. Phía trái của (A) tượng trưng cho khoảng chết của đường thở (VDaw) và bên phải (A) đại diện cho thể tích khí lưu thông phế nang (VTalv). PaCO2 = CO2 phế nang; PETCO2 = CO2 cuối tidal; PECO2 = CO2 hỗn hợp thì thở ra [77]”
Các nhân hóa mức PEEP bằng hình ảnh
Mục tiêu của thông khí phổi bảo vệ là ‘Mở phổi và giữ phổi mở’ [81] và do đó, hình ảnh nên là một phương pháp tuyệt vời để xác định xem mục tiêu này có đạt được hay không. Thật vậy, CT scan phổi đã dạy chúng ta nhiều điều về tác động của nhịp thở cơ học đối với những thay đổi của phổi không đồng nhất trong ALI [82-85]. Vấn đề là CT không phải là một công cụ có thể được sử dụng tại giường và do đó không có điều kiện cho hầu hết các bệnh nhân ARDS. Tuy nhiên, một thiết bị tại giường mới được phát triển, đó là chụp cắt lớp trở kháng điện (EIT), cho phép đo thông khí phổi từng nhịp thở ở tại giường. Blandkman et al. gần đây đã chứng minh rằng EIT và Bohr và Enghoff tính khoảng chết, cả hai đều xác định PEEP tối ưu, được định nghĩa là phân bố thể tích khí hít vào như nhau [86]. Thật thú vị, họ cũng chứng minh rằng VD/Vt và độ dốc bình thường III (SnIII) của đường cong cuối tidal của CO2 (Hình 4) không xác định sự không đồng nhất của phổi. Tuy nhiên, EIT có thể được sử dụng để xác định tác động của PEEP đối với phân phối thông khí (Hình 5) [87]. Mặc dù phần lớn các nghiên cứu cho đến nay chỉ đơn giản là các thí nghiệm xác nhận EIT, một số ít đã điều tra hiệu quả của PEEP được hướng dẫn bởi EIT. Muders và cộng sự, trong một mô hình ARDS gây ra do bơm axit oleic và tăng áp lực ổ bụng, cho thấy EIT có hiệu quả trong việc định lượng số lượng R/D phế nang ở các mức PEEP khác nhau [13]. Họ kết luận rằng EIT có khả năng xác định những thay đổi động trong việc huy động khí lưu thông và do đó có thể là một công cụ hiệu quả để đánh giá PEEP tối ưu. Những phát hiện này được hỗ trợ bởi Liu et al. người đã chứng minh rằng EIT có thể xác định tình trạng lạm phát phổi và R/D ở các mức PEEP khác nhau trong mô hình ARDS gây ra bằng rửa nước muối của lợn [88]. Cuối cùng, Gerhard et al. so sánh PEEP với hướng dẫn của ARDSnet [7] với PEEP được xác định bởi compliance dựa vào EIT để tối đa hóa việc huy động phổi do PEEP gây ra trong mô hình ARDS do rửa nước muối ở lợn [89]. Họ chứng minh rằng thông khí có hướng dẫn EIT dẫn đến PEEP cao hơn, compliance được cải thiện của toàn bộ và khu vực, cải thiện oxygen hóa và giảm mô bệnh học phổi so với quy trình PEEP của ARDSnet. Dữ liệu kết hợp cho thấy rằng EIT có thể trở thành một công cụ quan trọng trong việc cài đặt PEEP tối ưu.
![Hình 5. Thông khí phổi trong một thử nghiệm PEEP giảm dần (15-0 cmH2O) đo bằng chụp cắt lớp trở kháng điện (EIT) ở bệnh nhân sau phẫu thuật tim. Các hình ảnh hàng trên từ hình ảnh phía đầu và hình ảnh hàng dưới là hình ở mứcphổi của lồng ngực. Compliance khu vực tối ưu khác nhau giữa đầu (10 và 5 cmH2O) và ngực (15 và 10 cmH2O) cho thấy không có PEEP tối ưu nào có thể tồn tại ở tất cả các mức phổi [87]](https://www.healcentral.org/wp-content/uploads/2020/12/ca_nhan_hoa_thong_khi_co_hoc_theo_cac_thong_so_sinh_ly_de_on_dinh_phe_nang_va_giam_thieu_ton_thuong_phoi_do_tho_may_gay_ra_vili_5-300x132.jpg)
Cá nhân hóa mức PEEP bằng cơ học phổi: compliance/elastance
Phân tích hồi cứu dữ liệu ARMA [68] cho thấy cơ học phổi, dưới dạng thay đổi compliance, dự báo nhiều hơn về tử vong so với Vt [90]. Mặc dù những dữ liệu này rất thú vị, nhưng cần nhớ rằng thử nghiệm ARMA không được thiết kế để nghiên cứu cơ học phổi và sự đóng góp của bệnh nhân vào hô hấp không được xác định, điều này có thể gây nhiễu cho việc giải thích các kết quả này. Việc sử dụng sự compliance để điều chỉnh PEEP không phải là một khái niệm mới. Thật vậy, Suter et al. lần đầu tiên mô tả việc sử dụng sự compliance điều chỉnh PEEP hơn 40 năm trước (Hình 6) [91]. Công việc đầu tiên này đã được hỗ trợ bởi Chiew et al. người đã điều tra chiến lược tối ưu PEEP dựa trên mô hình bệnh nhân, phân tích mối quan hệ giữa độ đàn hồi (elastance) phổi hằng định (Elung) và độ đàn hồi động theo thời gian (Edrs) ở bệnh nhân ARDS [92]. Họ nhận thấy rằng PEEP sử dụng những thay đổi dựa trên mô hình đàn hồi là cao hơn so với PEEP được xác định lâm sàng để tối đa hoá việc huy động phổi và giảm thiểu công thở. Việc theo dõi liên tục compliance động (Cdyn) như một công cụ để cá nhân hóa PEEP đã được Suarez-Sipmann và các cộng sự trong mô hình ARDS gây ra do rửa nước muối của lợn [93]. Họ so sánh sự thay đổi trong sự suy giảm Cdyn, oxygen hóa và bơm phồng phổi được đo bằng chụp CT sau một thử nghiệm chuẩn độ RM và PEEP.
Ban đầu, có sự gia tăng Cdyn với mỗi mức PEEP giảm. Sự khởi phát xẹp phổi được định nghĩa là mức PEEP tại đó Cdyn bắt đầu giảm. Giá trị PEEP được lựa chọn bằng Cdyn được so sánh với giá trị đo oxygen hóa và CT. Cả oxygen hóa và CT đều khẳng định rằng PEEP do Cdyn duy trì một phổi mở hoàn toàn và kết luận rằng Cdyn có thể là một công cụ tại giường giá trị để đặt PEEP tối ưu. Việc sử dụng sự compliance phổi để xác định nhịp thở cơ học tối ưu đã gần đây đã được đánh giá lại trong một bài báo hồi cứu phân tích các thông số liên quan đến tử vong tăng lên. Trong phân tích thống kê này của Amato và cộng sự, 3562 bệnh nhân tham gia vào 9 nghiên cứu ARDSnet trước đây đã được nghiên cứu và cho thấy áp lực bình nguyên (Pplat) cao hơn không phải lúc nào cũng liên quan đến tỷ lệ tử vong tăng cao và PEEP cao hơn luôn luôn bảo vệ, trong khi áp lực đẩy (ΔP = thể tích khí lưu thông/compliance hệ thống hô hấp) có liên quan mật thiết với sự sống sót [22]. Nghiên cứu này khẳng định lại tầm quan trọng của việc đo compliance phổi trong việc xác định nhịp thở cơ học tối ưu.
![Hình 6. Sử dụng đường cong áp lực/thể tích (P/V) để cá nhân hóa PEEP. Hình dạng của đường cong P/V thay đổi từ bình thường (N) và khác nhiều với tình trạng khí phế thũng (E) hoặc suy hô hấp cấp (APF). Mối quan hệ P/V trong quá trình thông khí khí lưu thông được mô tả trong vùng bóng rào có và không có PEEP. RV khu vực thể tích mà tại đó xẹp phế nang, FRC dung tích cặn chức năng, và TLC dung tích phổi toàn phần. Bản vẽ trung tâm về sự thay đổi kích thước của phế nang dọc theo đường cong P/V [91]](https://www.healcentral.org/wp-content/uploads/2020/12/ca_nhan_hoa_thong_khi_co_hoc_theo_cac_thong_so_sinh_ly_de_on_dinh_phe_nang_va_giam_thieu_ton_thuong_phoi_do_tho_may_gay_ra_vili_6-300x197.jpg)
Pressure/volume curve – đường cong áp lực – thể tích
Các bằng chứng hỗ trợ việc sử dụng lâm sàng đường cong thể tích áp lực phổi (P/V) như một công cụ để xác định PEEP tối ưu đã được chứng minh bởi Amato et al. trong hai thử nghiệm lâm sàng [94, 95]. Sử dụng đường cong P/V để đặt PEEP đòi hỏi một thủ thuật làm chậm bơm phồng phổi, với mục đích là xác định điểm uốn trên và dưới (PFLEX) trên đường cong P/V này (Hình 7). PFLEX dưới được đưa ra để xác định áp lực lúc bắt đầu huy động phế nang và PFLEX trên là ở vị trí phổi quá căng. Họ cho thấy Vt 6 cc/kg với PEEP đặt trên PFLEX dưới cải thiện tỉ lệ sống còn ngày 28 so với chiến lược thông khí sử dụng Vt 12 cc/kg kết hợp với PEEP thấp để duy trì lượng oxygen hóa chấp nhận được [95]. Tuy nhiên, các nghiên cứu tiếp theo cho thấy rằng phế nang huy động liên tục trong toàn bộ đường cong hít vào ở cả hai mô hình động vật [96, 97] và ở người. Thêm vào đó, nó đã chỉ ra rằng có một lượng phổi thông khí nhiều hơn ở phía trên điểm có mức độ cong tối đa trên đường cong thở ra [98] và số lượng cao hơn các phế nang trên PFLEX trên ở đường cong thở ra [97] so với PFLEX thấp hơn trên đường cong hít vào. Những nghiên cứu này gợi ý rằng sử dụng nhánh đường cong thở ra của đường cong P/V để đặt PEEP có thể là cao hơn, về mặt lượng phổi được huy động, so với nhánh hít vào. Mặc dù sử dụng đường cong P/V như là một công cụ sinh lý để cá nhân hoá PEEP có thể hiệu quả, việc tạo ra đường cong P/V là một thủ tục phức tạp và có nguy cơ gây ra sự chèn ép huyết động và gây thương tích phổi trong quá trình bơm căng phổi. Ngoài ra, ALI luôn phát triển và do đó ngay cả khi PEEP được đặt đúng cách sử dụng đường cong P/V, nó phải được cài đặt lại khi phổi cải thiện hoặc xấu đi trong chức năng.
![Hình 7. Đường cong áp lực/thể tích (P/V) từ một bệnh nhân ARDS cho thấy cả hai điểm uốn ở dưới và trên (PFLEX). Giả thiết rằng PFLEX dưới là điểm mở tới hạn của phế nang và PFLEX trên là điểm mà tại đó các phế nang bắt đầu quá căng, tuy nhiên giả thuyết này đã bị thách thức [97, 98]. Trong bệnh nhân này, thông khí có lưu lượng thuỷ triều cao (Vt = 10 ml/kg cộng với PEEPIDEAL = 15 cmH2O) có thể gây quá căng vì thông khí tốt hơn PFLEX trên. Thông khí có Vt thấp và PEEPIDEAL nằm dưới PFLEX trên. Compliance tính toán của phổi tăng từ 31,6 lên 40 với thông khí Vt thấp [94].](https://www.healcentral.org/wp-content/uploads/2020/12/ca_nhan_hoa_thong_khi_co_hoc_theo_cac_thong_so_sinh_ly_de_on_dinh_phe_nang_va_giam_thieu_ton_thuong_phoi_do_tho_may_gay_ra_vili_7-300x265.jpg)
Transpulmonary pressure – áp lực xuyên phổi
Bệnh nhân có nguy cơ phát triển ARDS thường giảm compliance của ngực do sự quá tải dịch và/hoặc tăng áp lực trong ổ bụng. Do đó, có thể PEEP được đặt quá thấp, trừ khi áp lực xuyên phổi (Ptp) được biết đến. Trên lâm sàng, áp lực thực quản (Pes) được sử dụng làm đại diện cho áp lực màng phổi (Ppl) và dùng để tính Ptp. Nó cho thấy rằng PEEP cài đặt để duy trì Ptp trên 0 cmH2O có tác động tích cực trong cả hai động vật [99, 100] và con người [101, 102] nghiên cứu. Việc cá nhân hoá PEEP bằng cách sử dụng Ptp là một khái niệm khoa học lý tưởng vì Ptp là lực đẩy làm căng phổi lên. Tuy nhiên, Pes không phải là đại diện hoàn hảo của Ppl và do đó Ptp tính toán có thể không được chính xác. Trong một nghiên cứu gần đây, Huang và cộng sự so sánh “PEEP phổi mở” được hướng dẫn bởi CT so với PEEP hướng dẫn bởi Ptp (tức là, PEEP đặt để luôn giữ kết thúc Ptp trên 0 cmH2O) trong mô hình tổn thương phổi do rửa nước muối ở lợn [103]. Họ nhận thấy rằng PEEP hướng dẫn bởi Ptp không thể duy trì phổi được huy động mở với một cơ chế giả thuyết cho sự thất bại này là sự gia tăng áp lực chồng lên giữa mặt thực quản và mặt lưng. Tuy nhiên, bằng cách sử dụng Ptp để hướng dẫn PEEP là một kỹ thuật sinh lý và, có một thử nghiệm lâm sàng ngẫu nhiên đa trung tâm sử dụng thông khí có hướng dẫn bằng Ptp để giúp xác định hiệu quả của chiến lược thông khí này [104].
Stress index – Chỉ số căng
Năm 2000, Ranieri et al. đã chứng minh rằng đường cong áp lực thời gian (P-t) tạo ra bằng cách sử dụng lưu lượng hít vào hằng định có thể được sử dụng để xác định thông khí cơ học bảo vệ (Hình 8) [105]. Họ sử dụng hình dạng của đường cong để xác định sự căng thẳng được đưa vào phổi trong quá trình thông khí cơ học. Những nghiên cứu này chứng minh rằng nếu đường cong P-t thẳng đều có sự căng thẳng tối thiểu, trong khi nếu đường cong có độ lõm xuống thấp thì sự compliance càng ngày càng gia tăng, và nếu có độ lồi phía trên thì sẽ giảm. Thuật ngữ b trong phương trình cong (Hình 8) mô tả hình dạng của đường cong P-t, và họ thấy rằng một hệ số b là 1,00 liên quan đến bảo vệ phổi, được xác định bằng cách giảm mô bệnh học và trung gian gây viêm. Sự mở rộng của nghiên cứu này cho thấy một hệ số b < 1 tương quan với việc huy động khí lưu thông, và b > 1 tương quan với quá căng phế nang, với b = 1 tương ứng với thông khí cơ học không gây tổn hại, xác nhận sức mạnh tiên đoán của chỉ số căng thẳng này để xác định các tổn hại thông khí cơ học [26]. Độ chính xác của chỉ số căng thẳng để xác định các cài đặt thông khí cơ học gây tổn hại có thể gây ra VILI gần đây đã được khẳng định ở người [106]. CT đã được sử dụng để xác định các dấu hiệu hình thái của VILI bao gồm căng phổi theo chu kỳ hô hấp (tidal hyperinflation), căng phổi cuối kỳ thở ra, và việc huy động theo chu kỳ hô hấp. Kết quả cho thấy Pplat hiện đang xem là không gây ra VILI (≤ 30 cmH2O) gây ra hiện tượng căng phổi quá mức, trong khi chỉ số căng thẳng cho thấy Pplat < 25 cmH2O (b < 1,05) sẽ không và được xác nhận bởi CT. Chỉ số Stress cũng tốt hơn Pplat khi xác định các cài đặt thông khí bảo vệ tối ưu với sự có mặt của việc giảm compliance thành ngực. Grasso và cộng sự [107] đã chứng minh trong các bệnh nhân ARDS rằng sử dụng chỉ số căng thẳng để đặt PEEP làm giảm căng phế nang quá mức so với PEEP bằng sử dụng tiêu chuẩn chăm sóc [7], mặc dù những phát hiện này đã được thử thách [108]. Mặc dù sử dụng chỉ số căng thẳng để cài đặt PEEP có một số ưu điểm về sinh lý so với việc sử dụng oxygen hóa, đây là tiêu chuẩn chăm sóc và có một máy thở có thể thương mại có thể đo được chỉ số căng thẳng, kỹ thuật này vẫn chưa được thể hiện rõ ràng hơn so với chiến lược điều chỉnh hiện tại PEEP sử dụng oxygen hóa.
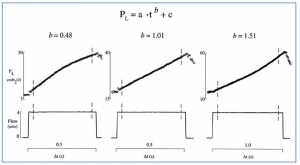
”Sử dụng phương trình công suất PL = a x t^b + c, b mô tả hình dạng của đường cong P-t. Khi b <1, hình dạng của đường cong là một khoảng lồi khi đó compliance gia tăng theo thời gian. Khi b > 1, đường cong có độ lõm xuống khi đó compliance giảm theo thời gian. Khi b = 1, đường cong P-t thẳng và compliance là hằng số. Điều chỉnh thể tích khí lưu thông (Vt) và PEEP sao cho b = 1 tạo ra sự căng thẳng phổi tối thiểu, nếu b < 1 sẽ tạo ra stress thể tích phổi thấp và b > 1 sẽ gây stress thể tích phổi cao [105]”
Time controlled PEEP – Thời gian kiểm soát PEEP
Một công cụ sinh lý học mới để cài đặt PEEP là độ dốc của đường cong lưu lượng thở ra (SlEFC) kết hợp với thông khí giải áp đường thở (APRV) (Hình 9) [109, 110]. Mặc dù phương pháp này không được sử dụng rộng rãi trong cả nước nhưng nó được sử dụng rộng rãi ở một số bệnh viện và có thể được sử dụng làm phương thức thông khí ban đầu [109]. PEEP không kiểm soát được thời gian này trực tiếp nhưng thời gian trong thì thở ra (TLOW) là đủ ngắn để ngăn không cho khí trong phổi thoát ra hoàn toàn. Do đó cả thể tích và áp lực phổi (tức là PEEP) vẫn còn ở giai đoạn đầu của thì hít vào kế tiếp. Khoảng thời gian thở ra càng ngắn, thể tích phổi cuối thì thở ra còn lại cao và áp lực ly giải cuối thì thở ra dương (PERP, positive-end release pressure) vẫn còn trong phổi.
Điều quan trọng là phải hiểu rằng APRV được cá nhân hoá (P-APRV) sử dụng để cài đặt thời gian điều khiển PEEP [109, 110] và thông khí với tỉ lệ hít vào:thở ra (I: E) đảo ngược (IRV) là không giống nhau. Mặc dù có nhiều sự khác nhau giữa P-APRV và IRV, tôi sẽ tập trung vào sự khác biệt lớn trong thời gian thở ra giữa hai chiến lược thông khí. Nó đã được hiển thị bởi Neumann et al. rằng phổi ARDS xẹp lại rất nhanh, dữ liệu của họ cho thấy xẹp lại trong 0,6 s sau khi bắt đầu thở ra [17]. Nghiên cứu của chúng tôi sử dụng quan sát trực tiếp các phế nang trong quá trình thông khí cơ học cũng cho thấy sự xẹp phế nang rất nhanh trong phổi ARDS [40, 111-113]. Không giống như APRV, IRV không cho phép điều chỉnh trực tiếp và độc lập thời gian thở ra và hít vào. Do đó, nếu khoảng thời gian thở ra IRV không nhỏ hơn 0.4-0.6 s, phế nang sẽ có đủ thời gian để sụp đổ với mỗi nhịp thở và ngược lại I:E sẽ không được định nghĩa là thời gian kiểm soát PEEP, vì phổi được cho phép thời gian để bị làm trống.
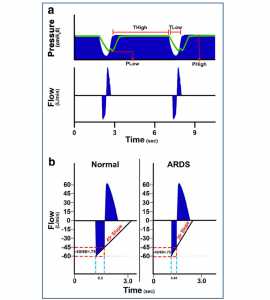
”Hình a: Đường biểu diễn áp lực và lưu lượng của airway pressure release ventilation (APRV). Đặt đúng APRV có thời gian rất ngắn khi thở ra (thời gian ở áp lực thấp, T thấp) và thời gian hít vào dài (thời gian ở áp lực cao, T cao) [109]. T cao là ~ 90% mỗi nhịp thở. Hai cài đặt ARPV khác là áp lực khi hít vào (P High) và khi thở ra (P Low). P High được cài đặt đủ cao để huy động và mở các phế nang, và P Low luôn được đặt ở 0 cmH2O để tạo điều kiện cho lưu thông thở ra. Tuy nhiên, T thấp là đủ ngắn để áp lực thở cuối thì thở ra (P Low) không bao giờ đạt 0 cmH2O được xác định bởi áp lực khí quản (đường màu xanh lá cây) duy trì mức PEEP. Hình b Hình này tóm tắt phương pháp mới của chúng tôi để duy trì sự ổn định của phế nang bằng cách thích nghi điều chỉnh thời gian thở ra theo đường cong lưu lượng thở ra. Tỷ lệ xẹp phổi được thấy ở phổi bình thường (độ dốc 45 °) và phổi bị tổn thương nặng (ARDS, độ dốc 30 °). ARDS gây xẹp phổi nhanh hơn do giảm compliance phổi. Các nghiên cứu sơ bộ của chúng tôi đã chỉ ra rằng nếu tỷ lệ lưu lượng đỉnh thở ra (PEF, -60 L/phút) đến khi kết thúc lưu lượng thở ra (EEF, -45 L/phút) (EEF/PEF) bằng 75% thời gian thở ra (0.5 giây) là đủ để ổn định các phế nang [40, 111]. Phổi với ARDS xẹp nhanh hơn do đó EEF/PEF -75% xác định thời gian thở ra là 0,45 s cần thiết để ổn định phế nang. Mặc dù EEF/PEF là cố định, nhưng thời gian thở ra không phải cố định, mà là thích nghi và sẽ ổn định phế nang bất kể mức độ nghiêm trọng của tổn thương phổi. Do đó, phương pháp cài đặt thời gian thở ra này thích ứng với những thay đổi về sinh lý bệnh phổi và làm cho cá nhân hoá từng cá nhân.”
Một ví dụ về sự thay đổi của SlEFC với ALI tiến triển và cách chúng ta có thể sử dụng SlEFC để cài đặt thời gian thở ra cần thiết để ổn định phổi như sau: một phổi bình thường giả định đã được cho một SlEFC ~ 45° và phổi ARDS SlEFC ~ 30° (Hình 9b). Để xác định thời gian thở ra tối ưu cần thiết để ổn định phổi, nên sử dụng lưu lượng thở ra cuối cùng để đạt được tốc độ cao nhất (EEF/PEF). Người ta đã chỉ ra rằng tỷ lệ ổn định tốt nhất phổi nhưng vẫn có thể thông khí đầy đủ cho bệnh nhân hoặc động vật là 75% [40, 111, 113, 114]. Trong ví dụ, PEF là -60 L/phút, để xác định thời điểm dừng thở ra -60 x 0,75 = 45 L/phút và do đó bác sĩ lâm sàng sẽ chấm dứt thở ra và áp dụng lại áp lực dương liên tục (CPAP) ở -45 L/phút. Trong phổi bình thường, thời gian thở ra sẽ là 0,5 s (Hình 9b). Với sự phát triển của ALI hoặc ARDS, phổi trở nên xẹp phổi và bị xẹp xuống rất nhanh chóng giảm SlEFC xuống ~ 30°. Sử dụng phương trình tương tự được sử dụng trong phổi bình thường, nhưng với độ dốc hơn, chúng ta thấy rằng thời gian thở ra đã giảm từ 0,5 đến 0,45 s để tránh xẹp phế nang trong phổi không tương thích này (Hình 9b). Phương pháp này cho kết quả PEEP được kiểm soát theo thời gian, làm giảm thiểu strain động (Hình 9b) bằng cách ổn định các phế nang sử dụng hai cơ chế: thời gian và áp lực [110].
Nhiều nghiên cứu đã chỉ ra rằng phương pháp kết hợp của PEEP cộng với thời gian ly giải ngắn rất hiệu quả trong việc ổn định các túi phế nang và phế nang, làm giảm strain mô [40, 111], ngăn chặn tiến triển ALI, và giảm tỉ lệ ARDS trong áp dụng lâm sàng, độ trung thực cao, trên mô hình lợn ARDS [113], và trong phân tích thống kê bệnh nhân chấn thương [114]. Cần nhiều nghiên cứu lâm sàng để khẳng định hiệu quả của phương pháp mới này để ổn định phổi.
Kết luận
Rõ ràng là mức độ strain động cao do R/D phế nang là một cơ chế chính gây tổn thương mô phổi liên quan đến VILI. Áp dụng PEEP hiện nay là chiến lược chính để làm giảm thiểu strain động cho ARDS đã cài đặt. Ngoài ra, ứng dụng PEEP sớm đã có hiệu quả trong việc giảm các biến chứng liên quan đến thông khí cơ học trong cả nghiên cứu trên động vật và con người. Rõ ràng là để cho PEEP có hiệu quả, nó phải được cá nhân hóa theo căn bệnh cụ thể của phổi của từng bệnh nhân. Tỉ lệ tử vong cao tiếp tục của ARDS hỗ trợ cho giả thuyết rằng các chiến lược PEEP hiện tại không phải lúc nào cũng hiệu quả.
Nhiều phương pháp để cá nhân hóa PEEP đã được thử nghiệm và chứng tỏ có khả năng ổn định phổi. Nhiều tài liệu hỗ trợ việc sử dụng RM để mở phổi, trước khi áp dụng PEEP, được cài đặt dựa trên phản hồi sinh lý. Các nghiên cứu lâm sàng gần đây đang cố gắng để cá nhân hóa PEEP theo RMs ở người [67, 115]. Vấn đề chính với việc sử dụng RMs là chúng không thể được thực hiện rất thường xuyên, do các tác dụng phụ nghiêm trọng tiềm ẩn, và phổi bị tổn thương nặng là liên tục thay đổi. Do đó, nếu bệnh lý phổi tăng lên sau khi cài đặt PEEP ban đầu, sự mất ổn định của phổi sẽ không nhận ra được, gây thêm tổn thương phổi do VILI gây ra. Một phương pháp mới của việc cá nhân hóa PEEP là sử dụng đường cong lưu lượng thở ra trong APRV. Lợi thế là RM không cần thiết để sự điều chỉnh thời gian thở ra thích ứng với những thay đổi tiến bộ trong tổn thương phổi cấp tính, bất kể những thay đổi này có tốt hay xấu đi hay không. Ngoài ra, phương pháp này không trực tiếp đặt PEEP mà sử dụng thời gian thở ngắn để tạo ra PEEP nội tại, được sử dụng như một công cụ để ổn định phổi. Cả hai nghiên cứu trên động vật và phân tích thống kê của con người cho thấy điều chỉnh thời gian giải phóng theo phương pháp từng nhịp thở là cơ chế tối ưu để thích ứng hoá cá nhân hoá PEEP.