Bài viết Áp lực dương cuối thì thở ra: cách cài đặt ở cấp độ cá nhân được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: Positive end-expiratory pressure: how to set it at the individual level
Tóm tắt
Áp lực dương cuối kỳ thở ra (PEEP), kể từ khi được đưa vào điều trị suy hô hấp cấp tính, đến những năm 1980 là nhằm duy trì sự oxy hóa khả thi. Kể từ khi ứng dụng đầu tiên, một cuộc tranh luận lớn về các tiêu chí lựa chọn mức PEEP phát sinh trong cộng đồng khoa học. Cơ học phổi, vận chuyển oxy, ngưỡng trộn lẫn tĩnh mạch (venous admixture) đều được đề xuất, dẫn đến khuyến nghị của PEEP từ 5 đến 25 cmH2O. Trong suốt giai đoạn này, mối quan tâm chính là huyết động học. Mô hình này đã thay đổi trong những năm 1980 sau khi sự chấp nhận “atelectrauma” rộng rãi là một trong những nguyên nhân hàng đầu gây ra tổn thương phổi do máy thở gây ra (VILI). Theo đó, mục tiêu của PEEP chuyển từ oxy hóa sang bảo vệ phổi. Trong khuôn khổ này, việc ngăn chặn việc mở và đóng phổi theo chu kỳ đã trở thành một giáo điều gần như không bị nghi ngờ. Do đó, khi PEEP tiếp tục mở các đơn vị phổi mở trong giai đoạn hít vào trước đó, các phương pháp mới được thiết kế để xác định PEEP ‘tối ưu’ trong giai đoạn thở ra. Phương pháp tiếp cận phổi mở đòi hỏi mọi đơn vị phổi đang bị xẹp nhưng có khả năng mở sẽ được mở và duy trì mở. Các phương pháp đánh giá việc huy động được dựa trên hình ảnh (chụp cắt lớp vi tính, cắt lớp trở kháng điện, siêu âm) hoặc sửa đổi trao đổi khí thông qua máy thở. Tất cả các giả định mới nhất cho rằng bất kỳ sự thay đổi nào trong độ giãn nở hệ thống hô hấp là do những thay đổi trong độ giãn nở phổi, đó là chức năng duy nhất của việc huy động. Tuy nhiên, các nghiên cứu so sánh chỉ ra rằng cách tiếp cận duy nhất có thể để đo lượng mô bị xẹp lấy lại thông khí là CT scan. Trong thực tế, tất cả các phương pháp khác ước tính như huy động để thông khí trong các đơn vị phổi đã mở tại PEEP thấp hơn, nhưng tăng sự độ giãn nở của nó ở PEEP cao hơn. Vì PEEP cao hơn thường được chỉ định nhiều hơn (cũng cho oxy hóa) khi khả năng huy động cao hơn, như xảy ra với mức độ gia tăng ngày càng cao, một lựa chọn PEEP có ý nghĩa đòi hỏi phải đánh giá huy động. Định nghĩa của Berlin có thể giúp đánh giá này.
Giới thiệu
Barach và cộng sự năm 1938 đã mô tả đầy đủ ảnh hưởng của áp lực dương cuối kỳ thở ra (PEEP) như là một biện pháp liên kết cho thở máy bệnh nhân phù phổi do tim, nhiễm trùng huyết hoặc ngạt, ở động vật thí nghiệm và 7 bệnh nhân suy tim (1). Cournand và các đồng nghiệp vào năm 1946 đã đo được tác động tiêu cực trên huyết động học do áp lực dương trong lồng ngực ngắt quảng (2). Theo kết quả logic, PEEP không được thực hiện trong thực hành lâm sàng cho đến cuối những năm 1960, để tránh tác động thêm về huyết động.
Trong thời gian đó, Gregory và các đồng nghiệp ở San Francisco đã áp dụng PEEP trong những trẻ sơ sinh thở tự phát bị suy hô hấp do thiếu surfactant, mà không báo cáo các vấn đề huyết động lớn (3). Trong cùng thời kỳ được mô tả hội chứng suy hô hấp người lớn, tương tự với hội chứng suy hô hấp của trẻ sơ sinh, được cho là chủ yếu do thiếu surfactant (4). Hội chứng suy hô hấp người lớn, sau này được gọi là hội chứng suy hô hấp cấp tính (ARDS), trở thành bệnh lý nguyên mẫu đi kèm với sự phát triển của chăm sóc đặc biệt nội khoa (5) và PEEP là một trong những phương pháp điều trị được sử dụng rộng rãi nhất. Các nghiên cứu đầu tiên về cơ chế của PEEP trong ARDS được thực hiện bởi Falke và cộng sự tại Bệnh viện Đa khoa Massachusetts (6), trong khi phương pháp lâm sàng phổ biến nhất cho thiết lập PEEP được đề xuất bởi Suter tùy thuộc vào sự vận chuyển oxy và cơ học hô hấp (7). Trong khi đó, Kirby và cộng sự, từ Miami, đề nghị sử dụng “siêu PEEP”, đó là PEEP lên đến 25 cmH2O, bằng cách nào đó chính nó là tiền thân của “phương pháp tiếp cận phổi mở” (8). Tenaillon, từ phía Pháp, đề xuất tăng PEEP lên bất cứ mức độ nào đủ để giảm trộn lẫn tĩnh mạch 10% (9). Dantzker, xem xét lại những lo lắng của Cournand, cho rằng cơ chế chính của PEEP trong việc cải thiện oxy hóa là thông qua việc giảm cung lượng tim (10). Thật vậy, trộn lẫn tĩnh mạch và cung lượng tim có liên quan tuyến tính, như được mô tả trước hết bởi Lemaire et al. trong cùng thời kỳ đó (11,12). Thật thú vị khi lưu ý rằng, trong nhiều phương pháp tiếp cận được đề xuất, kiểm tra và thảo luận, hai điểm không được đề cập: đầu tiên, việc sử dụng PEEP được liên kết duy nhất với quá trình oxy hóa; thứ hai, các hiệu ứng huyết động luôn được tính đến.
Một bước đột phá lớn trong lịch sử của PEEP là phát hiện ra rằng phản ứng viêm, được đo bằng phân tích cytokine, đã được ngăn chặn/làm giảm bởi việc sử dụng PEEP (13). Mô hình lý thuyết của Mead cung cấp nền tảng cho lý thuyết atelectrauma (14), sau đó được minh họa bởi Lachmann (15) và được chứng minh lâm sàng bởi Ranieri (16). Từ những năm 90, sau một loạt các quan sát thực nghiệm cho thấy PEEP có hiệu quả trong việc ngăn ngừa phù phổi, bắt đầu với phát hiện của Webb và Tierney (17), PEEP không được coi là phương tiện đơn thuần để cải thiện oxy, mà là công cụ bảo vệ phổi. Sự nhấn mạnh về bảo vệ phổi dẫn đến một sự lãng quên tiến bộ của các biến chứng huyết động liên quan đến PEEP, và chỉ một vài trung tâm tiếp tục qua nhiều năm để báo cáo và nhấn mạnh vai trò quan trọng của huyết động học trong khuôn khổ của PEEP (18-20).
Trong bài báo này, chúng tôi muốn thảo luận về việc sử dụng PEEP từ hai quan điểm khác nhau (oxy hóa và bảo vệ phổi) và suy đoán về ứng dụng ‘được cá nhân hóa’ của nó.
Cơ chế của PEEP
Để áp dụng đúng PEEP, đầu tiên là bắt buộc phải hiểu nó hoạt động như thế nào, lợi ích của nó và những hạn chế của nó. PEEP thường liên quan đến việc huy động phổi và thông thường được đọc là “huy động liên quan đến PEEP”. Điều này gây hiểu lầm cho ít nhất bốn lý do:
1. PEEP là một thuộc tính tăng cường của hệ thống, trong khi huy động là một thuộc tính về khả năng;
2. Huy động là một hiện tượng của hít vào, trong khi PEEP liên quan đến giai đoạn thở ra;
3. PEEP, thông qua áp lực xuyên phổi không chỉ tác động trên các đơn vị phổi có thể huy động, mà trên mỗi đơn vị phổi mở để thông khí;
4. PEEP hoạt động không trực tiếp, nhưng thông qua áp lực xuyên phổi.
Thuộc tính tăng cường và khả năng
Theo định nghĩa, một thuộc tính tăng cường của một hệ thống là một thuộc tính vật lý có độ lớn độc lập với kích thước của hệ thống, trong khi một thuộc tính khả năng (hoặc mở rộng) phụ thuộc hoàn toàn vào hệ thống kích thước. Nói cách khác, áp lực (chẳng hạn như PEEP) 10 cmH2O là như nhau, hoặc áp dụng cho phổi của một con chuột hoặc phổi của một con voi. Ngược lại, cùng một tỷ lệ phần trăm của mô được huy động có nghĩa là một sự khác biệt rất lớn về giá trị tuyệt đối, khi huy động là một thuộc tính khả năng. Sự khác biệt này không chỉ là học thuật, như chúng ta sẽ thảo luận sau.
Huy động hít vào và thở ra
Huy động hít vào
Trong thì hít vào, nếu áp lực áp dụng là đủ, các đơn vị phổi bị xẹp trước đó sẽ mở ra và phồng lên. Sau đó chúng ta phải hiểu: đầu tiên, tại sao và làm thế nào các đơn vị bị xẹp; thứ hai, họ định vị ở đâu; cuối cùng, làm thế nào áp lực mở thực sự hoạt động.
1. Một đơn vị phổi xẹp có thể được định nghĩa là một đơn vị phổi trong đó hàm lượng khí gần bằng không hoặc bằng không. Loại xẹp đầu tiên [xẹp lỏng lẻo – loose xẹp phổi (21)] là do sự xẹp của đường hô hấp nhỏ, chủ yếu là do tăng trọng lượng phổi; điều này “ép” khí ra khỏi đơn vị phổi và đóng các đường hô hấp nhỏ. Một số khí được còn lại phía sau đường hô hấp bị xẹp (hàm lượng khí gần bằng không). Loại thứ hai của sự xẹp [xẹp dính – sticky xẹp phổi (21)] là do tái hấp thu hoàn toàn của các khí từ các đơn vị phổi. Điều này xảy ra bất cứ khi nào và bất cứ nơi nào một đường hô hấp nhánh vẫn đóng trong suốt toàn bộ chu kỳ hô hấp. Trong ARDS, các đơn vị phổi khác có thể biểu hiện dưới dạng không có chứa khí, nhưng được “bị đông đặc” – “consolidated” – thay vì bị xẹp. Các đơn vị này thường chứa đầy chất lỏng/chất rắn có nguồn gốc từ quá trình bệnh dẫn đến ARDS. Trong thực tế, các đơn vị bị xẹp và đông đặc có thể được phân biệt chỉ sau khi áp dụng áp lực mở “tối đa” đã cho;
2. Số lượng đơn vị trong đó sự xẹp chủ yếu là do lực hấp dẫn tăng lên khi áp lực chồng lên nhau (tức là thể tích phổi chồng lên nhiều lần theo chiều dọc) tăng (22- 24). Tuy nhiên, phải lưu ý rằng các đơn vị phổi cùng ở trên một mặt phẳng trọng lực không nhất thiết phải tất cả đều mở hoặc tất cả đều đóng, vì các hiện tượng tương tác cục bộ giữa các đơn vị tiếp giáp có thể ngăn chặn hoặc thúc đẩy việc đóng của chúng. Lưu ý rằng các đơn vị xẹp lúc thở ra vẫn còn xẹp “lỏng lẻo” nếu nó mở lại và nhận khí trong thì hít vào tiếp theo, nếu không nó sẽ trở thành xẹp “dính” theo thời gian. Trong khi sự xẹp phổi lỏng lẻo thường xuyên định hướng theo không gian xác định rõ ràng (từ vùng phổi không phụ thuộc đến vùng phổi phụ thuộc) (25,26), sự xẹp phổi tái hấp thu phát sinh cả ở những vùng phổi phụ thuộc nhiều nhất (nơi áp lực hô hấp không đủ để mở các đơn vị bị xẹp do trọng lực) và bất cứ nơi nào tắc nghẽn đường thở xảy ra vì các lý do không phải trọng lực;
3. Để mở một đơn vị nhất định, áp lực được áp dụng phải vượt qua ít nhất bốn lực khác nhau (bỏ qua chuyển động của khí):
a. Lực căng bề mặt (27). Đây là những khả năng thấp hơn trong xẹp phổi “lỏng lẻo”, nơi một số khí vẫn còn hiện diện, hơn trong xẹp phổi “dính”, nơi mà tất cả các phân tử nước được tiếp xúc với nhau;
b. Áp lực chồng lên đơn vị đó (22,23);
c. Áp lực có thể do sự tương tác giữa các đơn vị lân cận bị xẹp trong cùng một mặt phẳng trọng lực (28);
d. Áp lực cần thiết để nâng lên thành ngực ở cùng một thể tích mà phổi đã được bơm phồng lên (24).
Tính đến tất cả những hiện tượng này có thể đóng góp vào sự hiểu biết về hành vi của những áp lực mở phổi. Trong Hình 1, chúng tôi trình bày một đường cong áp lực đường thở huy động trong thì hít vào được đo ở 34 bệnh nhân ARDS. Như được hiển thị, hình dạng là hình sigmoidal (29,30), được biểu diễn dưới dạng phân phối áp lực mở, dẫn đến một đường cong Gaussian. Theo đó, hầu hết việc huy động xảy ra ở mức 20 cmH2O, trong khi một số đơn vị yêu cầu áp lực rất thấp hoặc áp lực rất cao (26,31). Trên thực tế, xem xét chiều cao xương ức chuẩn 15 cm, một thành ngực bình thường và áp lực cần thiết để vượt qua lực căng, bỏ qua sự tương tác giữa các đơn vị lân cận, thứ tự độ lớn để mở một đơn vị nén 15 cmH2O (một lý thuyết giới hạn) sẽ là:
Áp lực mở = lực nén (10–15 cmH2O) + sức căng bề mặt (15–20 cmH2O) + thành ngực (5–10 cmH2O) = 30–45 cmH2O
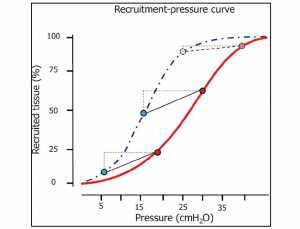
Như được hiển thị, tại 45 cmH2O, hầu hết các huy động có thể nên được thực hiện ở phần lớn các bệnh nhân. Một phần nhỏ (2-3%) của việc huy động có thể xảy ra ở áp lực cao hơn (45–60 cmH2O) (31), có thể do sự tương tác giữa các đơn vị bị xẹp. Vì vậy, để mở hoàn toàn phổi, áp lực cao tới 45 cmH2O (nếu lồng ngực là bình thường) thường được yêu cầu. Lưu ý, ở áp lực cao nguyên khuyến cáo là 30 cmH2O (32), một phần tương ứng của phổi (lên đến 30% trong ARDS nặng) vẫn còn đóng (28).
Huy động thở ra
Người ta cũng biết rằng áp lực cần thiết để giữ cho một đơn vị phổi mở được cho là thấp hơn nhiều so với những áp lực cần thiết để mở nó. Lý do chính là phần áp lực cần thiết để khắc phục lực căng bề mặt trong quá trình thì hít vào không còn cần thiết trong quá trình thở ra. Trên thực tế, chức năng surfactant được xác định bằng cách phân tích sự khác biệt giữa đường cong áp lực phổi thực hiện thổi phồng phổi với khí (có lực căng bề mặt) hoặc với nước muối (không có lực bề mặt) (33,34). Kết quả là, áp lực cần thiết để giữ cho phổi mở thấp hơn nhiều so với mức cần thiết để mở phổi (xem Hình 1). Như đã chỉ ra, phần lớn phổi được giữ ở áp lực khí khoảng 10 cmH2O. Áp lực cao đến 20-25 cmH2O có thể cần thiết để mở một số đơn vị phổi.
Huy động so với bơm phồng (Recruitment versus inflation)
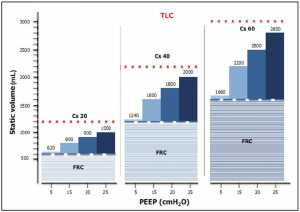
Bất cứ lúc nào áp lực cuối thì thở ra được áp dụng, nó sẽ tiếp tục mở một phần nhất định của phổi được huy động trước đó, trong khi vẫn giữ các đơn vị phổi đã mở ở mức bơm phồng cao hơn. Nếu chúng ta xác định, khi chúng ta tin là đúng, việc huy động khi thể tích các đơn vị phổi lấy lại và duy trì bơm phồng, sẽ thuận tiện để ước lượng lượng khí do sự hiện diện của PEEP được phân phối trong các đơn vị mới được huy động và bao nhiêu phân phối ở các đơn vị đã mở. Như trong Hình 2, phần lớn thể tích PEEP đi vào các đơn vị đã bơm phồng (35). Do đó, hiệu quả của PEEP là kép: ở một bên, nó duy trì lượng khí tối thiểu trong các đơn vị mới mở; ở phía bên kia, nó làm tăng sự thông khí của các đơn vị đã mở, thậm chí gây ra một quá căng. Trong hình 3 chúng tôi trình bày một mô hình phân phối cho một PEEP tăng từ 0 đến 25 cmH2O trong một đại diện giả thuyết ARDS phổi. Cần lưu ý rằng trong hầu hết các trường hợp, áp lực 20 cmH2O tạo ra thể tích phổi cuối thì thở ra (EELV) gần như bằng với tổng dung tích phổi (TLC). Đây là thể tích mà thể tích khí lưu thông (VT) được chồng lên nhau. Việc huy động mô phổi mới và mở rộng thể tích phổi đã bơm phồng trước đó tạo sự khác biệt lớn, đã được báo cáo trong y văn khi đánh giá thủ thuật huy động (35). CT scan cho phép định lượng chính xác số lượng mô phổi lấy lại thể tích bằng bơm phồng. Độ lớn của phần này, liên quan đến tổng trọng lượng phổi, dao động từ 0 đến 40%, với giá trị trung bình khoảng 10-12%, tùy thuộc vào mức độ nghiêm trọng của quần thể ARDS được nghiên cứu. Ngược lại, tất cả các đánh giá huy động dựa trên các phép đo khí, như phương pháp đường cong áp lực kép hoặc phương pháp khí mà chúng tôi đã thực hiện vào năm 1998 (37) và Dellamonica được giới thiệu lại vào năm 2011 (38), không chỉ đo khí vào các khu vực bị mất thông khí trước đây, nhưng cũng đo lượng khí vào các đơn vị đã mở, trong đó, với thể tích cao hơn, làm tăng sự độ giãn nở của chúng (35).

Áp lực xuyên phổi
Cần phải lưu ý rằng tất cả những cân nhắc ở trên nên đề cập đến áp lực đường thở, nhưng thay vì là áp lực xuyên phổi. Ở một bệnh nhân nhất định, những thay đổi trong áp lực xuyên phổi có liên quan đến những thay đổi của áp lực đường thở theo mối quan hệ sau đây (39):
Áp lực xuyên phổi (PL) = Paw × EL/Etot
trong đó Paw là viết tắt của áp lực đường thở, EL độ đàn hồi (elastance) của phổi và Etot độ đàn hồi của hệ thống hô hấp (tức là, độ đàn hồi của phổi cộng với độ đàn hồi của thành ngực).
Nó phải được lưu ý rằng cái gọi là độ dẫn truyền có liên quan đến tỷ lệ độ đàn hồi của phổi trên tổng số. Điều này, trong điều kiện bình thường, là ~ 0,5, trong khi ở ARDS nó có thể nằm trong khoảng từ 0,2 đến 0,8. Điều này nhấn mạnh sự cần thiết phải đo áp lực của xuyên phổi cho một ứng dụng thông khí cơ học an toàn hơn.
Ứng dụng lâm sàng của PEEP
Mục tiêu PEEP
Khi chọn mức PEEP, chúng ta nên xem xét lợi ích oxy hóa và lợi ích giả định về “bảo vệ phổi”.
PEEP và oxy hóa
Trong nhiều thập kỷ, mục đích duy nhất của việc giới thiệu PEEP trong quản lý ARDS là cải thiện oxy hóa. Sự chú ý ít hơn đã được trả cho PCO2, và các hiệu ứng bảo vệ có thể của nó không thực sự được xem xét, mặc dù được đề xuất trong động vật thực nghiệm, cho đến khi phát triển “lý thuyết atelectrauma” vào cuối những năm 1980. PEEP cải thiện quá trình oxy hóa thông qua hai cơ chế có thể: (I) tiếp tục mở các vùng phổi bị xẹp và còn tưới máu trước đó, làm giảm shunt trong phổi từ phải sang trái (trộn lẫn tĩnh mạch); (II) làm giảm cung lượng tim, tạo ra sự giảm shunt trong phổi từ phải sang trái.
- Mặc dù vùng thông khí thấp (VA/Q) được thể hiện trong ARDS, cơ chế chính của thiếu oxy máu là sự hiện diện liên quan của shunt từ phải sang trái (40). Thực tế mô hình của Riley (41), đề cập đến phổi thực sự có ba ngăn (khoảng chết, “VA/Q” bình thường và shunt) cũng được áp dụng cho phổi ARDS. Tỷ lệ shunt thường thấp hơn tỷ lệ mô không có ga do co mạch do thiếu oxy, nhưng vẫn còn hiện diện (42). Nếu PEEP có thể duy trì mở các đơn vị trước đó bị xẹp và còn được tưới máu, tỷ lệ shunt sẽ giảm.
- ARDS được đặc trưng bởi tăng kháng lực mạch máu do co mạch lan tỏa. Tuy nhiên, các mạch máu phục vụ các đơn vị phổi mở thì được giãn ra nhiều hơn so với các mạch phục vụ các đơn vị bị xẹp. Sự gia tăng cung lượng tim, kết hợp với sự gia tăng áp lực động mạch phổi được ưu tiên phân phối trong các đơn vị bị xẹp, làm tăng shunt từ phải sang trái (11,12). Mặc dù các cơ chế này có khả năng hoạt động khi PEEP có mặt, nhưng chúng đã được thử thách trong quá trình thở tự phát không được hỗ trợ (43).
Do cơ chế kép này, PEEP và nói chung là sự gia tăng áp lực, có liên quan đến gần như toàn bộ các trường hợp, với sự gia tăng PaO2. Việc giảm PaO2 khi PEEP tăng lên phải được nghiên cứu cẩn thận vì nó có thể cho thấy các cơ chế bất thường hoạt động trong hệ thống (44-46).
Nếu PEEP được sử dụng để cung cấp oxy hóa khả thi nhưng với một nguy cơ tối thiểu của quá căng và sự bất ổn huyết động học, một mục tiêu PaO2 hợp lý nên được thiết lập. Theo quan điểm của chúng tôi, cách tiếp cận này thiếu nền tảng sinh lý. Chỉ đề cập đến một giá trị PaO2 là không đủ, vì những gì quan trọng là oxy hóa mô bị giảm (được phục vụ bởi huyết động học), trong khi tăng PaO2 khi PEEP được áp dụng. Một sự thăng bằng được theo dõi bởi các bác sĩ, có tính đến tiến trình của bệnh, dự trữ sinh lý của bệnh nhân và sự liên quan của các bệnh kèm theo có thể xảy ra.
PEEP và bảo vệ phổi
Tác dụng bảo vệ của PEEP thường được đề cập đến trong một bài nghiên cứu của Webb và Tierney, trong 2 giờ thí nghiệm trên chuột, phù phổi nặng hơn khi thông khí phổi giữa áp lực cao nguyên 45 cmH2O và PEEP 0 cmH2O so với áp lực cao nguyên 45 cmH2O và PEEP 10 cmH2O (17). Con số này vẫn được báo cáo trong các cuộc họp và các giấy tờ như là một bằng chứng không thể nghi ngờ về tác dụng bảo vệ của PEEP. Trong cùng một bài báo, Webb và Tierney cũng báo cáo dữ liệu (hầu hết bị bỏ quên) cho thấy thông khí ở áp lực cao nguyên 30 cmH2O và PEEP 0 cmH2O không gây ra thiệt hại đáng kể. Mặc dù có sự đồng thuận lớn về tầm quan trọng của atelectrauma, và phòng ngừa bởi PEEP, nền tảng của chiến lược phổi bảo vệ, theo ý kiến của chúng tôi, vai trò của PEEP nên được đánh giá lại. Trên thực tế, câu hỏi cơ bản là liệu việc bảo vệ PEEP chỉ là một tác dụng phụ của việc giảm thể tích khí lưu thông hay không, thường liên quan đến sự gia tăng PEEP từ các thí nghiệm của Webb và Tierney, hoặc ngược lại, nếu PEEP hoạt động trực tiếp trong việc phòng chống chấn thương và VILI, theo đề xuất của chiến lược bảo vệ phổi. Chúng tôi nghĩ rằng việc xem xét bảo vệ PEEP là một niềm tin (47) hơn là một bằng chứng hoặc thậm chí là một thực tế sinh lý được hỗ trợ. Trên thực tế, chúng tôi nghi ngờ tác dụng bảo vệ trực tiếp của PEEP (đặc biệt là PEEP cao hơn) vì ba lý do chính:
1. PEEP là một áp lực và vì vậy nó là một thành phần của năng lượng cơ học (mechanical power), được phân phối đến nhu mô phổi. Để bơm phồng phổi, năng lượng phải được cung cấp, cao hơn mức được sử dụng để giữ cho nó được căng, và các sợi trước đó đã bị căng thẳng có thể đạt đến giới hạn không sinh lý của chúng (48);
2. Một loạt các thí nghiệm đã dẫn đến kết luận rằng những gì thực sự quan trọng là năng lượng cơ học vượt qua giới hạn sinh lý của phổi. Nếu điều này không đạt được, sự hiện diện của PEEP hoặc sự vắng mặt của nó là không liên quan. Nếu PEEP cao đến mức thể tích khí lưu thông liên quan vượt qua giới hạn sinh lý của việc mở rộng phổi, thì PEEP có hại (36);
3. Ba nghiên cứu lớn so sánh, mặc dù phương pháp tiếp cận phương pháp khác nhau, PEEP thấp hơn (trong khoảng 8 cmH2O) đến PEEP cao hơn (trong phạm vi 15 cmH2O) không tìm thấy bất kỳ sự khác biệt đáng kể nào. Điều đó có nghĩa là các atelectrauma kết hợp với PEEP thấp hơn không nguy hiểm hơn so với volutrauma giả định liên quan đến PEEP cao hơn (49).
Điều này không chỉ ra rằng PEEP là vô ích, nhưng đơn giản là lý thuyết phổi mở không nhất thiết là một cách tiếp cận khái niệm đúng đắn.
PEEP ở từng bệnh nhân
Đặc điểm bệnh nhân
Bước sơ bộ quan trọng nhất trong quá trình lựa chọn PEEP, hoặc nếu mục tiêu là cải thiện oxy hoặc để có được một phổi mở hoàn toàn, hoặc để đánh giá khả năng huy động phổi, tất cả phụ thuộc vào bản chất và mức độ của bệnh dẫn đến ARDS (50). Một số phương pháp đã được đề xuất trực tiếp hoặc gián tiếp, đánh giá khả năng huy động phổi, dựa trên hình ảnh (đánh giá trực tiếp) hoặc biến đổi khí/hệ thống khí trong các thử nghiệm thách thức (phương pháp gián tiếp).
Hình ảnh:
a) CT scan. Công cụ tốt nhất để đo lường khả năng huy động là phân tích định lượng hai lần quét CT ở các mức áp lực khác nhau. Sự khác biệt giữa lượng mô chứa không khí ở áp lực thấp hơn và mô chứa không khí ở áp lực cao hơn, được chuẩn hóa theo trọng lượng phổi, cho khả năng phần trăm huy động (51);
b) Chụp cắt lớp trở kháng điện (EIT). Ưu điểm của việc sử dụng kỹ thuật này là sự sẵn có của nó tại giường. Tuy nhiên, nó phản ánh nhiều hơn một sục khí tổng thể tốt hơn của phổi giữa hai cấp độ của PEEP, hơn là so với việc mở mô phổi trước đây không có gas. Theo đó, tương quan CT scan-EIT trong việc đánh giá khả năng huy động là khá kém (52), trong khi nó tốt hơn nếu so sánh với khả năng huy động được đánh giá bằng khí (53). Cần nhấn mạnh lại rằng phương pháp đo khí ưu tiên đo lường thể tích bơm phồng tốt hơn ở mức PEEP cao hơn của các đơn vị được mở trước đây ở PEEP thấp hơn, so với việc đo lường các thể tích có được do mở các đơn vị bị xẹp trước đó (35);
c) Siêu âm. Ngoài ra kỹ thuật này có sẵn ở cạnh giường (54). Bên cạnh sự nhiệt tình của những người ủng hộ ban đầu của họ (55), theo chúng tôi, theo một số hạn chế, nó bị hạn chế do thiếu độ phân giải không gian và sự thâm nhập giới hạn của siêu âm. Cuối cùng, như EIT và các phương pháp dựa trên khí, nó có liên quan với bơm phồng tổng thể tốt hơn thay vì mở mô trước đây không có ga;
Thử thách (Challenge tests). Một đánh giá đầy đủ các test khác nhau đã được công bố gần đây (56) và ở đây chúng tôi sẽ chỉ tóm tắt chúng:
a) Test PEEP trong thì hít vào. Thông thường, 5, 10 và 15 (đôi khi lên đến 20) cmH2O được áp dụng, cách nhau 15 đến 30 phút (thời gian cân bằng có thể giảm xuống còn 10 phút) (57);
b) Test PEEP trong thời gian thở ra. Sau khi bơm phồng đầy đủ lên đến 45 cmH2O (hoặc đôi khi 60 cmH2O), áp lực đường thở với PEEP khoảng 25 cmH2O, PEEP giảm dần cho đến khi sự oxy hóa hoặc độ giãn nở hệ thống hô hấp xấu đi. Giá trị này được coi là khởi đầu của sự xẹp phổi (58,59);
c) Một khả năng khác là sử dụng phân loại của Berlin khi tỷ lệ PaO2/FiO2 được đánh giá ở mức PEEP 5 cmH2O. Trong trường hợp này, chúng ta có thể mong đợi, với một mức độ xác suất nào đó (70-80%), khả năng huy động đó phản ánh mức độ nghiêm trọng của ARDS (60).
Mỗi hệ thống này đều có vấn đề riêng. Việc quét CT đòi hỏi một công việc mãnh liệt, cả cho kiểm tra và phân tích. EIT có triển vọng, nhưng hiện tại nó bán định lượng. Siêu âm chỉ có thể khám phá “vỏ” của phổi. Tất cả các thử nghiệm đề cập đến các biến trao đổi khí không tính đến vai trò của huyết động học, cũng như hành vi của PaCO2. Sự gia tăng của PaCO2 ở thông khí phút không đổi thường cho thấy sự gia tăng của phổi quá căng (tức là, các đơn vị phổi căng nhiều hơn và ít thông khí hơn). Là một đại diện cho huyết động học, nó có thể hữu ích để xem xét độ bão hòa oxy hemoglobin tĩnh mạch trung tâm (ScvO2). Nếu cả oxy động mạch và tăng ScvO2 thì có khả năng huyết động được bảo toàn tốt. Cần chú ý khi tăng oxy máu động mạch và nhưng độ bão hòa thì không tăng, nguy cơ có thể xảy ra đối với huyết động học có thể được hiển thị bằng cách tăng PaO2 kết hợp với sự giảm độ bão hòa tĩnh mạch trung tâm. Do đó, việc đánh giá sự khác biệt về hàm lượng oxy trong động mạch có thể ngăn cản chúng ta phân bổ sai về việc huy động, một sự gia tăng của PaO2 đơn giản là do giảm cung lượng tim (61).
Lựa chọn PEEP
Một khi huy động đã được đánh giá, chúng tôi phải cân bằng các lợi ích và rủi ro có thể có của các cấp PEEP khác nhau. Khi so sánh các phương pháp lựa chọn PEEP khác nhau, dựa trên bảng PEEP-tỷ lệ P/F được dựa trên ý kiến của chuyên gia (62), là phương pháp duy nhất cung cấp PEEP thấp hơn ở những bệnh nhân có khả năng huy động thấp hơn, so với phương pháp đánh giá bằng cơ học phổi (63,64), áp lực xuyên phổi (65), hoặc CT scan (24). Hầu hết các phương pháp dựa trên cơ học phổi, và ngay cả phương pháp dựa trên CT, đã cung cấp PEEP cao hơn ở những bệnh nhân có khả năng huy động cao, trung bình hoặc thấp như được suy ra từ phân loại Berlin sửa đổi (49). Nhân tiện, gần đây chúng tôi đã chỉ ra rằng phổi không thể mở hoàn toàn ở thông khí được đặt giữa PEEP 15 cmH2O và áp lực cao nguyên 30 cmH2O (28). Việc mở đầy đủ có thể yêu cầu PEEP lớn hơn 25 cmH2O, bất kể khả năng huy động là gì. Thật vậy, để giữ 1 hoặc 1.000 gram mô không có ga (thuộc tính mở rộng, extensive property) yêu cầu cùng một PEEP nếu áp lực mở là như nhau. Ngoài ra, trong thực hành thông thường, PEEP được sử dụng trên toàn thế giới trong ARDS nặng nằm khoảng 8,5 cmH2O, cho thấy rằng trong thực hành lâm sàng bình thường, BS hồi sức lấy mục tiêu chủ yếu là oxy hóa khả thi hơn một mở phổi (66). Do đó, rõ ràng là không ai có công thức cho một cài đặt PEEP lý tưởng, có khả năng điều này không tồn tại. Chúng tôi tin rằng trong ARDS sớm, mức độ nghiêm trọng và có khả năng huy động cho thấy giá trị PEEP khoảng 15 cmH2O ở bệnh nhân nặng, mặc dù không ngăn chặn việc đóng mở, nhưng đủ để giữ ít nhất 70% phổi và cung cấp trao đổi khí hữu hiệu. Trong ARDS vừa phải, các giá trị khoảng 10 cmH2O được chỉ định và ARDS nhẹ thậm chí thấp hơn PEEP là quá đủ, vì khả năng huy động cực kỳ thấp (67).