Tháng 8/2019, Cơ quan Quản lí Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt Lefamulin (Xenlata, Nabriva Therapeutics), một kháng sinh mới sử dụng cả đường uống (PO) và đường tĩnh mạch (IV) để điều trị viêm phổi do vi khuẩn mắc phải tại cộng đồng (Community Acquired Bacterial Pneumonia – CABP) cho người trường thành.
Lefamulin – kháng sinh mới?
Lefamulin là kháng sinh đầu tiên thuộc nhóm kháng sinh pleuromutilin được chỉ định cho sử dụng toàn thân trên người. Nó là kháng sinh đầu tay được chỉ định cho CABP do các vi khuẩn nhạy cảm: Streptococcus pneumoniae, Staphylococcus aureus (loại phân lập nhạy cảm với methicillin), Haemophilus influenzae, Legionella pneumophila, Mycoplasma pneumoniae, và Chlamydophila pneumoniae.
Lefamulin có cơ chế hoạt động khác so với tất cả các kháng sinh khác đã được phê duyệt trước đây. Ted Schroeder, Giám đốc điều hành của Nabriva Therapeutics, cho biết trong một bản tin phát hành “nó dẫn đến xu hướng phát triển đề kháng kháng sinh thấp, cũng như giảm khả năng kháng chéo với các kháng sinh nhóm β-lactam, fluoroquinolone, glycopeptide, macrolide và tetracycline”.
Schroeder cũng cho biết “Xenleta có phổ hoạt động in vitro rộng chống lại các mầm bệnh vi khuẩn gram dương, gram âm và vi khuẩn không điển hình, chúng là các nguyên nhân phổ biến nhất gây ra CABP, phù hợp với các nguyên tắc quản lý kháng sinh”.
Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh Hoa Kỳ ước tính rằng có khoảng 1 triệu người phải nhập viện vì CABP và 50.000 người chết vì căn bệnh này mỗi năm tại Hoa Kỳ.
An toàn và hiệu lực của lefamulin được đánh giá trong 2 nghiên cứu bao gồm gần 1300 bệnh nhân mắc CABP. Trong những nghiên cứu này, lefamulin được so sánh với moxifloxacin, có hoặc không có linezolid.
Các nghiên cứu cho thấy đối với những bệnh nhân được điều trị bằng lefamulin, tỉ lệ khỏi bệnh trên lâm sàng tương tự như những bệnh nhân được điều trị bằng moxifloxacin, có hoặc không có linezolid.
Ed Cox, Bác sĩ y khoa, Giám đốc Văn phòng các sản phẩm kháng khuẩn của FDA, cho biết trong một bản tin phát hành “Loại thuốc mới này cung cấp một lựa chọn mới để điều trị bệnh nhân viêm phổi do vi khuẩn mắc phải tại cộng đồng, một căn bệnh nghiêm trọng”.
Cox cho biết “Để quản lý căn bệnh nghiêm trọng này, điều quan trọng là các bác sĩ và bệnh nhân phải có những sự lựa chọn điều trị. Sự chấp thuận này củng cố cam kết liên tục của chúng tôi trong việc điều trị các bệnh truyền nhiễm bằng cách tạo điều kiện cho sự phát triển các kháng sinh mới”.
Các phản ứng bất lợi phổ biến nhất được báo cáo ở bệnh nhân dùng lefamulin bao gồm tiêu chảy, buồn nôn, phản ứng tại chỗ tiêm, tăng nồng độ men gan và nôn. Lefamulin có thể gây ra kéo dài khoảng QT, nên tránh dùng ở những bệnh nhân đã biết có khoảng QT kéo dài và những bệnh nhân bị rối loạn nhịp tim, FDA cho biết.
Lefamulin cũng không nên được sử dụng ở những bệnh nhân đã biết quá mẫn cảm với lefamulin, bất cứ kháng sinh khác của nhóm kháng sinh pleuromutilin hoặc với bất kì thành phần nào của thuốc.
“Dựa trên những phát hiện về tác hại với thai nhi trong các nghiên cứu trên động vật, phụ nữ mang thai hoặc có ý định mang thai nên được thông báo về những rủi ro tiềm ẩn của Xenleta với thai nhi. Phụ nữ có ý định mang thai nên được khuyến cáo sử dụng các biện pháp tránh thai hiệu quả khi đang điều trị bằng Xenleta và 2 ngày sau liều cuối cùng”, FDA đề nghị.
Lefamulin sẽ có sẵn dưới dạng uống (600 mg mỗi 12 giờ) và dùng đường tĩnh mạch (150 mg mỗi 12 giờ) với một liệu trình điều trị ngắn từ 5 đến 7 ngày.
Bệnh nhân có thể được điều trị ban đầu bằng đường tĩnh mạch hoặc đường uống (tránh phải nằm viện), hoặc bệnh nhân có thể chuyển từ đường tĩnh mạch sang đường uống, điều này có thể đẩy nhanh tiến trình xuất viện, công ty cho biết.
Công ty hy vọng lefamulin sẽ có sẵn thông qua các nhà phân phối chuyên khoa lớn của Hoa Kỳ vào giữa tháng 9/2019 và dự đoán giá thành điều trị sẽ là 205 USD/ngày với bệnh nhân điều trị bằng đường tĩnh mạch và 275 USD/ngày với bệnh nhân điều trị bằng đường uống.
Một số đặc điểm cơ bản về Lefamulin
Các thông số dược động học
Hấp thu: Sinh khả dụng (F) đường uống xấp xỉ 25%. Thời gian đạt nồng độ đỉnh trong huyết tương (Tmax) với đường uống là 0.88-2 giờ. Nồng độ đỉnh trong huyết tương (Cmax) trung bình là 3.6 µg/mL với đường tĩnh mạch và 2.24 µg/mL với đường uống (thức ăn làm giảm Cmax 22.9%). Diện tích dưới đường cong (AUC) trung bình là 28.6 µg.h/mL với đường tĩnh mạch và 32.7 µg.h/mL với đường uống (thức ăn làm giảm AUC 18.43%).
Phân bố: Tỉ lệ liên kết protein huyết tương là 94.8-97.1%. Thể tích phân bố (Vd) trung bình là 86.1 L.
Chuyển hóa: Chuyển hóa lần đầu qua gan bởi CYP3A4.
Thải trừ: Thời gian bán thải (t1/2) là 8 giờ. Độ thanh thải toàn cơ thể (ClT) là 11.9 L/h. Bài xuất ở đường tĩnh mạch qua phân là 77.3% (4.2-9.1% dưới dạng không đổi) và qua nước tiểu là 15.5% (9.6-14.1% dưới dạng không đổi), bài xuất ở đường uống là qua phân là 88.5% (7.8-24.8% dưới dạng không đổi) và qua nước tiểu là 5.3%.
Dược lực học
Lefamulin là kháng sinh thuộc nhóm pleuromutilin. Đây là kháng sinh đầu tiên thuộc nhóm này được cấp phép cho sử dụng toàn thân trên người.
Cơ chế tác dụng: Lefamulin ức chế tổng hợp protein của vi khuẩn bằng cách tương tác với các vị trí A và vị trí P (A- and P-sites) (bằng cách liên kết hydro, liên kết kị nước, liên kết Van der Waals) của trung tâm peptidyl transferase (PTC) trên domain V của ribosome rARN 23S trong tiểu đơn vị 50S.
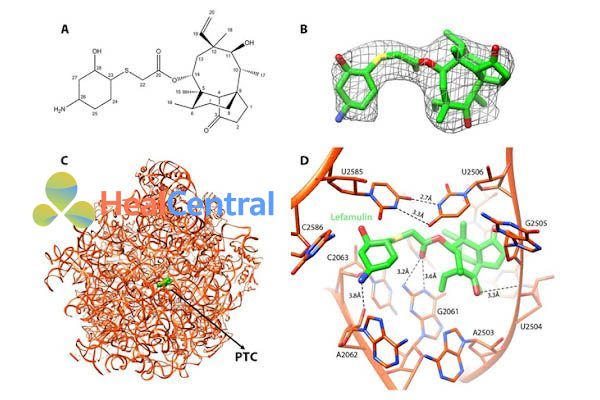
Các chủng vi khuẩn nhạy cảm: Streptococcus pneumoniae, Staphylococcus aureus (loại phân lập nhạy cảm với methicillin), Haemophilus influenzae, Legionella pneumophila, Mycoplasma pneumoniae, và Chlamydophila pneumoniae.
Chỉ định
Viêm phổi do vi khuẩn mắc phải tại cộng đồng (CABP) ở người trưởng thành.
150 mg IV mỗi 12 giờ x 5-7 ngày
Hoặc 600 mg PO mỗi 12 giờ x 5 ngày.
Có thể chuyển sang đường uống để hoàn thành điều trị.
Chỉnh liều
Suy thận: Bệnh nhân không cần chỉnh liều, kể cả chạy thận nhân tạo.
Suy gan:
Đường uống:
- Nhẹ (Child-Pugh A): Không cần chỉnh liều.
- Trung bình đến nặng (Child-Pugh B hoặc C): Không khuyến nghị, không có nghiên cứu.
Đường tĩnh mạch:
- Nhẹ đến trung bình (Child-Pugh A hoặc B): Không cần chỉnh liều.
- Nặng (Child-Pugh C): Giảm liều xuống 150 mg/ngày.
Các tác dụng không mong muốn
> 10%: Tiêu chảy (12%).
2-10%:
- Tăng men gan (2-3%).
- Buồn nôn (3-5%).
- Hạ kali máu (3%).
- Mất ngủ (3%).
- Đau đầu (2%).
< 2%:
- Rối loạn hệ thống máu và bạch huyết: Thiếu máu, giảm tiểu cầu.
- Rối loạn tim: Rung nhĩ, đánh trống ngực.
- Rối loạn tiêu hóa: Đau bụng, táo bón, khó tiêu, khó chịu vùng thượng vị, viêm dạ dày bào mòn.
- Nhiễm trùng: Viêm đại tràng do Clostridium difficile, nhiễm nấm Candida hầu họng, nấm Candida âm hộ.
- Phosphatase kiềm tăng, creatine phosphokinase tăng, điện tâm đồ kéo dài khoảng QT, gamma-glutamyl transferase tăng.
- Rối loạn thần kinh: Ngủ gà.
- Rối loạn tâm thần: Lo lắng.
- Rối loạn thận và tiết niệu: Bí tiểu.
Thận trọng và cảnh báo
Kê đơn kháng sinh trong trường hợp không có nhiễm khuẩn đã được chứng minh hoặc nghi ngờ mạnh mẽ làm tăng nguy cơ phát triển vi khuẩn kháng thuốc.
Tiêu chảy do C.difficile (C.difficile Associated Diarrhea – CDAD) đã được báo cáo khi sử dụng gần như tất cả các kháng sinh, bao gồm cả lefamulin. Nếu nghi ngờ hoặc xác nhận CDAD, cần ngừng lefamulin và sử dụng các kháng sinh tiêu diệt được C.difficile (đầu tay là metronidazole, nếu metronidazole không hiệu quả thì chuyển sang vancomycin đường uống).
Dựa trên các nghiên cứu trên động vật, thuốc có thể gây hại cho thai nhi.
Gây kéo dài khoảng QT:
- Tránh sử dụng lefamulin ở những bệnh nhân bị kéo dài khoảng QT, rối loạn nhịp thất bao gồm xoắn đỉnh hoặc đang sử dụng các thuốc khác được biết gây kéo dài khoảng QT (ví dụ: thuốc chống loạn nhịp nhóm IA hoặc nhóm III, thuốc chống loạn thần, erythromycin, pimozide, moxifloxacin, thuốc chống trầm cảm ba vòng TCAs).
- Ở những bệnh nhân bị suy gan hoặc suy thận cần lọc máu, rối loạn chuyển hóa liên quan đến suy thận có thể dẫn đến kéo dài khoảng QT.
- Nếu không thể tránh sử dụng lefamulin trên bệnh nhân có xu hướng kéo dài khoảng QT hoặc những người được nhận một loại thuốc khác gây kéo dài khoảng QT, nên theo dõi điện tâm đồ (ECG) trong quá trình điều trị.
- Mức độ kéo dài khoảng QT có thể tăng khi tăng nồng độ lefamulin hoặc tăng tốc độ truyền tĩnh mạch. Không vượt quá liều hoặc tốc độ truyền khuyến cáo.
Phụ nữ có thai: Tránh sử dụng do thuốc có thể gây hại cho thai nhi.
Phụ nữ đang cho con bú: Không có dữ liệu về sự xuất hiện của lefamulin trong sữa mẹ, ảnh hưởng đến trẻ bú mẹ hoặc sự sản xuất sữa. Dữ liệu có sẵn ở động vật cho thấy lefamulin bài tiết qua sữa. Nếu một loại thuốc xuất hiện sữa động vật, có khả năng thuốc sẽ có mặt trong sữa mẹ. Do khả năng gây các tác dụng phụ nghiêm trọng, hãy hướng dẫn phụ nữ đang cho con bú loại bỏ sữa trong suốt thời gian điều trị và 2 ngày sau liều cuối cùng.
Chống chỉ định
Quá mẫn cảm với lefamulin hoặc bất cứ thành phần nào của thuốc.
Phối hợp với cơ chất nhạy cảm với CYP3A4 có thể gây kéo dài khoảng QT.
Tương tác thuốc
Lefamulin là cơ chất của CYP3A4 và P-gp, nó cũng là một chất ức chế CYP3A4 vừa phải.
Với các chất gây cảm ứng CYP3A hoặc P-gp mạnh hoặc trung bình: Tránh dùng đồng thời..
Với các chất ức chế CYP3A hoặc P-gp mạnh: Tránh dùng đồng thời.
Với các thuốc ức chế CYP3A hoặc P-gp vừa phải: Theo dõi tác dụng phụ của lefamulin.
Với các cơ chất nhạy cảm CYP3A4 gây kéo dài khoảng QT: Chống chỉ định.
Với các cơ chất nhạy cảm CYP3A4 khác: Theo dõi tác dụng phụ của các thuốc này nếu được sử dụng cùng với viên nén lefamulin (đường tiêm không ảnh hưởng đến phơi nhiễm cơ chất CYP3A4).
Các loại thuốc khác kéo dài khoảng QT: Nếu không thể tránh, nên theo dõi ECG trong quá trình điều trị.
Thử nghiệm lâm sàng
Thử nghiệm phase III LEAP I: Hiệu lực và độ an toàn của lefamulin đường tĩnh mạch đến đường uống trong điều trị viêm phổi do vi khuẩn mắc phải tại cộng đồng (CABP).
Các tác giả: File TM Jr, Goldberg L, Das A, Sweeney C, Saviski J, Gelone SP, Seltzer E, Paukner S, Wicha WW, Talbot GH và Gasink LB.
Thông tin tác giả:
Summa Health, Akron, OH, USA.
Nabriva Therapeutics US, Inc., King of Prussia, PA, USA.
Das Consulting, Guerneville, CA, USA.
Urogen Pharma, New York, NY, USA.
Nabriva Therapeutics GmbH, Vienna, Austria.
Talbot Advisors LLC, Anna Maria, FL, USA.
Mã: NCT02559310.
Phương pháp: Trong nghiên cứu mù đôi này, những người trưởng thành mắc CABP của Pneumonia Outcomes Research Team nhóm nguy cơ ≥ III được chia ngẫu nhiên theo tỉ lệ 1:1 để nhận lefamulin 150 mg IV mỗi 12 giờ hoặc moxifloxacin 400 mg IV mỗi 24 giờ. Sau 6 liều, bệnh nhân có thể được chuyển sang dùng thuốc nghiên cứu bằng đường uống nếu đáp ứng các tiêu chí cải thiện được chỉ định trước. Nếu nghi ngờ nhiễm Staphylococcus aureus kháng methicillin (MRSA), linezolid hoặc giả dược đã được bổ sung vào moxifloxacin hoặc lefamulin tương ứng. Điểm cuối chính US FDA là đáp ứng lâm sàng sớm (ECR) 96 ± 24 giờ sau liều thuốc nghiên cứu đầu tiên trong quần thể có ý định điều trị (ITT) (dung sai không kém hơn 12.5%). Các điểm đồng cuối chính của EMA là đánh giá của điều tra viên về đáp ứng lâm sàng (IACR) 5-10 ngày sau liều thuốc nghiên cứu cuối cùng trong ITT thay đổi (mITT) và quần thể có thể đánh giá lâm sàng (CE) (dung sai không kém hơn 10%).
Kết quả: 551 bệnh nhân được lựa chọn ngẫu nhiên (n = 276 với lefamulin và n = 275 với moxifloxacin). Lefamulin không thua kém moxifloxacin về ECR (87.3% so với 90.2%; chênh lệch: -2.9% [khoảng tin cậy CI 95%: -8.5, 2.8]) và IACR (mITT 81.7% so với 84.2%; chênh lệch: -2.6% [-8.9, 3.9]; CE 86.9% so với 89.4%; chênh lệch -2.5% [-8.4, 3.4]). Tỉ lệ ngừng thuốc nghiên cứu do tác dụng phụ điều trị là 2.9% với lefamulin và 4.4% với moxifloxacin.
Kết luận: Lefamulin không thua kém moxifloxacin về các điểm cuối hiệu lực chính, nhìn chung an toàn và dung nạp tốt.
Nguồn tài liệu: https://www.fda.gov/news-events/press-announcements/fda-approves-new-antibiotic-treat-community-acquired-bacterial-pneumonia





Thank you!