Bài viết Vai trò của điều trị cứu mạng trong điều trị ARDS nặng được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: The Role of Rescue Therapies in the Treatment of Severe ARDS
ARDS được đặc trưng bởi phù phổi không do tim gây ra với hình ảnh thâm nhiễm cản quang trên chụp X quang phổi và thiếu oxy máu kháng với liệu pháp oxy. Đây là một nguyên nhân phổ biến cho nhập viện vào ICU do suy hô hấp giảm oxy máu, đòi hỏi cần thông khí cơ học. Corticosteroid không được khuyên dùng cho bệnh nhân ARDS. Các phương pháp cứu hộ làm giảm tình trạng thiếu oxy máu ở những bệnh nhân không thể duy trì oxy hóa hợp lý: thủ thuật huy động phế nang, tư thế nằm sấp, hít nitric oxit, thở máy rung tần số cao và oxy hoá màng ngoài cơ thể cải thiện oxy hóa, nhưng tác động của chúng đến tử vong vẫn chưa được chứng minh. Quản lý dịch hạn chế dường như là một chiến lược thuận lợi và không giảm đáng kể tỷ lệ tử vong ở 60 d. Các nghiên cứu trong tương lai là cần thiết để làm rõ hiệu quả của các liệu pháp này đối với kết cục ở những bệnh nhân ARDS nặng và việc thiết lập các liệu pháp này có thể được xem xét theo từng trường hợp.
Giới thiệu
ARDS là một tình trạng nguy hiểm đến tính mạng, là biến chứng của nhiều bệnh nghiêm trọng, bao gồm nhiễm khuẩn huyết, viêm phổi, viêm tụy và chấn thương.[1] Nó được đặc trưng bởi viêm phổi nặng, xẹp nhu mô phổi tiến triển, tổn thương phế nang lan tỏa, tăng tính thấm mạch máu phổi, tăng trọng lượng phổi, và mất mô thông khí.[2] ARDS trên lâm sàng liên quan đến tình trạng thiếu oxy máu trầm trọng, sự không đồng bộ của bệnh nhân – máy thở, và tính nhạy cảm cao đối với chấn thương áp lực và tổn thương phổi do thở máy (VILI).[3]
ARDS được Ashbaugh và Petty [4] mô tả lần đầu tiên cách đây 50 năm trong 12 trường hợp bệnh nhân có các đặc điểm chung là thở nhanh và thiếu oxy máu, hình ảnh cản quang trên chụp X quang phổi, và compliance phổi kém, mặc dù do nhiều nguyên nhân khác nhau. Năm 1994, Hội nghị Đồng thuận Mỹ và Châu Âu đã đưa ra một định nghĩa mới về ARDS được toàn cầu chấp nhận.[5] Năm 2012, định nghĩa này đã được sửa đổi bởi một nhóm các chuyên gia quốc tế và bây giờ được gọi là định nghĩa Berlin của ARDS (Bảng 1).[6] Một nghiên cứu quan sát lớn gần đây [7] báo cáo tỷ lệ hiện nhiễm ARDS là 10,4% trong tổng số người nhập viện và khoảng 23,4% đối tượng được thở máy. ARDS dường như dưới mức nhận diện (underrecognized), dưới mức điều trị (undertreated) và liên quan đến tỷ lệ tử vong cao, đặc biệt là 46,1% đối với bệnh nhân ARDS nặng.
Mục tiêu chính để điều trị ARDS là đảm bảo trao đổi khí đầy đủ đồng thời giảm thiểu nguy cơ VILI. Đến nay, điều trị phần lớn là hỗ trợ, và thông khí cơ học vẫn là nền tảng. Một số bệnh nhân không thể duy trì oxy hóa đầy đủ mặc dù được hỗ trợ thông khí cơ học thông thường và có thể xảy ra tình trạng thiếu oxy máu kháng trị đe dọa tính mạng có thể xảy ra. Mặc dù định nghĩa tiêu chuẩn cho giảm oxy máu kháng trị là một vấn đề tranh luận đang diễn ra, trong hầu hết các báo cáo nó đã được định nghĩa là có một PaO2 < 60 mm Hg, với một FIO2 0,8-1,0 và một PEEP > 10-20 cm H2O trong > 12-24 giờ. Trong những trường hợp này, bác sĩ có thể cân nhắc một số phương pháp trị liệu hỗ trợ, đây là một nỗ lực cứu nguy cuối cùng để ngăn ngừa các biến chứng nghiêm trọng hoặc tử vong vì thiếu oxy máu (Hình 1). Liệu pháp cứu hộ chỉ là phương pháp tạm thời có thể hỗ trợ hoặc thay thế chức năng hô hấp ở bệnh nhân suy hô hấp nghiêm trọng bằng phương pháp hỗ trợ hô hấp thông thường. Mặc dù các chiến lược này cải thiện việc oxy hóa, nhưng tác động của chúng đến tử vong vẫn chưa được chứng minh, và chúng đòi hỏi chi phí cao hơn so với chăm sóc chuẩn. Tổ chức các liệu pháp này có thể được xem xét trên cơ sở cá nhân, và sự lựa chọn thường được quyết định bởi sự sẵn có và chuyên môn của địa phương.[8,9]

Thông khí và PEEP
Trong một nghiên cứu lớn do ARDS Network tiến hành,[10] tử vong giảm và số ngày không thở máy cao hơn trong nhóm được điều trị với thể tích khí lưu thông thấp (VT 6 mL/kg trọng lượng cơ thể dự đoán) so với nhóm điều trị VT truyền thống. Giảm nồng độ interleukin-6 (IL-6) trong huyết tương, cho thấy nhóm điều trị với VT thấp hơn có ít viêm phổi hơn. Giảm phản ứng viêm hệ thống với tổn thương phổi có thể góp phần làm tăng số ngày không có suy cơ quan hoặc hệ thống và tỷ lệ tử vong thấp hơn trong nhóm điều trị bằng thông khí bảo vệ phổi.[10] So với thông khí thông thường, chiến lược bảo vệ phổi có tỷ lệ cai máy cao hơn và tỷ lệ barotrauma thấp hơn ở bệnh nhân ARDS mặc dù sử dụng mức PEEP cao hơn và áp lực đường thở trung bình cao hơn.[11] Mức cao IL-8, IL-6, TNF-α, IL-1β trong dịch rửa phế quản – phế nang của bệnh nhân ARDS xác nhận sự liên quan của cytokine trong sự khuếch đại hiện tượng viêm dẫn đến suy đa tạng và tăng tỷ lệ tử vong. Ranieri và cs[12] so sánh thông khí bảo vệ phổi với phương pháp thông khí thông thường để đánh giá ảnh hưởng của thông khí cơ học đối với mức cytokine phổi và hệ thống. Nồng độ các trung gian gây viêm thấp hơn 36 giờ sau khi bóc thăm ngẫu nhiên trong nhóm thông khí bảo vệ phổi hơn so với nhóm chiến lược thông thường. Chiến lược thông khí bảo vệ phổi này nhằm mục đích giảm thiểu VILI, có thể là do sự quá căng của phế nang hoặc việc mở và đóng các đơn vị phổi lặp đi lặp lại.
Trong khi trong quá khứ sự lựa chọn một phương thức thông khí cơ học (kiểm soát áp lực so với kiểm soát thể tích), được xem là phù hợp với kết cục của bệnh nhân,[2] phân tích gộp gần đây không thể cho thấy bất kỳ sự khác biệt đáng kể về tỷ lệ tử vong, nguy cơ bị barotrauma, hoặc các phản ứng sinh lý khác.[13,14] Dù sử dụng chiến lược thông khí giới hạn thể tích hoặc áp lực, chấn thương phổi vẫn có thể kéo dài hoặc tiến triển ở một số bệnh nhân, dẫn đến tình trạng thiếu oxy máu tồi tệ hơn.[15] Các mô phổi còn khí có giới hạn được nhận thông khí theo chu kỳ thở do đó dẫn đến tăng căng chướng trong khu vực và stress quá mức; PEEP không đủ dẫn đến tổn thương xé quá mức.
Các vùng phổi phụ thuộc của bệnh nhân ARDS đóng góp đáng kể vào sự phát triển của tình trạng thiếu oxy máu do các shunts trong các phế nang tưới máu tốt và không có thông khí. Các chiến lược để mở mô phổi sụp đổ này có thể cải thiện oxy hóa và giảm tỷ lệ tử vong. Điều này đặc biệt có thể là vấn đề ở những bệnh nhân dù nhận được thông khí VT thấp, trong đó một phần đáng kể của phổi có thể vẫn xẹp do giới hạn áp lực và thể tích. Terragni và cộng sự [16] đã chụp cắt lớp vi tính phổi khi cuối kỳ thở ra và cuối thì hít vào cho 30 đối tượng được điều trị bằng thông khí bảo vệ phổi. Một phần ba số người bị căng phế nang theo chu kỳ hô hấp với VT chỉ 6 mL/kg trọng lượng cơ thể dự đoán và áp lực cao nguyên (Pplat) < 30 cm H2O. Trong các đối tượng này, nồng độ các trung gian gây viêm cao hơn và số ngày không thở máy thấp hơn so với hai phần ba đối tượng ít căng phế nang hơn. Pplat < 28 cm H2O có liên quan đến sự căng phế nang ít hơn so với giá trị Pplat từ 28-30 cm H2O. Pplat < 28 cm H2O dường như có liên quan với các cài đặt thông khí bảo vệ phổi. Cài đặt theo ARDS Network có thể không đủ để giảm thiểu VILI ở bệnh nhân ARDS mà quá trình bệnh được đặc trưng bởi sự phân bố các tổn thương phổi với một phần nhỏ phổi còn chứa khí, không phụ thuộc, bình thường và phần lớn phổi bị xẹp, phụ thuộc, không thông khí. Tỷ lệ phổi không thông khí có thể được huy động bằng cách áp dụng mức PEEP cao hơn so với truyền thống được sử dụng (5- 12 cm H2O) trong việc quản lý bệnh nhân có ARDS.[17,18] Amato và cộng sự đã đưa ra giả thuyết rằng strain có chu kỳ dự đoán tổn thương phổi tốt hơn so với VT. Kích thước phổi chức năng trong suốt thời gian bệnh được định lượng tốt hơn do compliance của hệ thống hô hấp hơn là so với VT theo trọng lượng cơ thể dự đoán. Trong những điều kiện như vậy, đặc biệt khi compliance của hệ thống hô hấp khác nhau đáng kể giữa các bệnh nhân, strain có chu kỳ, VILI, và tỷ lệ sống còn nên tương quan với áp lực đẩy hơn là với VT.
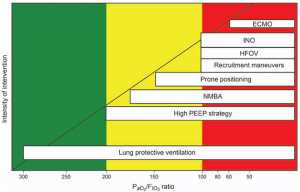
Mặc dù một số nghiên cứu thực nghiệm và nghiên cứu quan sát thấy hiệu quả có lợi đối với việc sử dụng PEEP cao hơn trong ARDS,[3] thử nghiệm ngẫu nhiên được công bố trong khoảng năm 2004 và 2008 không cho thấy sự khác biệt về kết quả giữa chiến lược thở máy PEEP thấp và cao. [20-22] Tuy nhiên, khi kết hợp các dữ liệu này và chỉ xem xét nhóm phụ nặng nhất (PaO2/FIO2 ~ 200 mm Hg), việc sử dụng PEEP cao làm giảm đáng kể tử vong.[23] Điều này cho thấy mức độ nghiêm trọng (và số lượng phù phổi càng lớn) thì tác động tích cực của PEEP trong việc giảm VILI càng lớn. Điều này cũng đã được khẳng định trong một nghiên cứu quan sát, trong đó mức PEEP cao làm giảm đáng kể hiệu ứng mở và đóng chỉ ở các đối tượng có khả năng huy động cao hơn. Tuy nhiên, mối quan hệ giữa phù phổi và khả năng huy động đã được Cressoni và cộng sự,[25] người nhận thấy rằng mức PEEP cần thiết để giữ cho phổi mở được độc lập với khả năng huy động phổi toàn phần. Những kết quả này cho thấy khả năng huy động phụ thuộc vào tính chất của phù, thời gian khởi phát, phân bố bệnh lý trong nhu mô phổi.
Mặc dù một số phương pháp đã được đề xuất để điều chỉnh PEEP cho bệnh nhân theo từng cá nhân, nhưng phổ biến nhất là để đánh giá PEEP theo mục tiêu oxy hóa/độ bão hòa dựa trên một bảng PEEP/ FIO2. [21] Năm 1975, Suter và cộng sự [16] đã đặt ra thuật ngữ PEEP tốt nhất như là điểm mà mức độ huy động phổi được cân bằng với nguy cơ quá căng phế nang. Cơ sở cho việc xác định PEEP tốt nhất là lượng định lượng huy động: tăng PEEP bằng cách duy trì một VT không đổi, không vượt quá giới hạn an toàn của Pplat 26-28 cm H2O, hoặc, sau khi một thủ thuật huy động, giảm PEEP cho đến khi giảm compliance xuất hiện.[27] Trong một mẫu gồm 3.562 đối tượng với ARDS thông khí với các kết hợp khác nhau của VT và PEEP, tác động bảo vệ của PEEP cao hơn chỉ được nhìn thấy khi điều này liên quan đến giảm áp lực đẩy (driving pressure), với điểm cắt (cut-off) tử vong tăng lên với áp lực đẩy là 15 cmH2O.[19] Điều quan trọng nhất đối với cuộc thảo luận này là mối quan hệ giữa tỷ lệ tử vong và Pplat cao chỉ được quan sát thấy khi áp lực đẩy cũng cao hơn 15 cm H2O. Áp lực đẩy đường thở là yếu tố liên quan nhiều nhất đến kết quả: tỷ lệ tử vong cao hơn chỉ được tìm thấy khi thấy các giá trị Pplat cao hơn ở những người có áp lực đẩy cao hơn.
Nhiều kỹ thuật đã được đề xuất để theo dõi việc huy động phổi, chẳng hạn như siêu âm, chụp cắt lớp trở kháng điện, đo cơ học hô hấp, kỹ thuật rửa nitơ (nitrogen washout) và chụp cắt lớp vi tính định lượng, nhưng chưa có ai đạt được sự đồng thuận chung hoặc trở nên thường xuyên được sử dụng trong các thiết lập lâm sàng.[28-32]
Mặc dù có thể có những điều không chắc chắn về áp lực thực quản tuyệt đối cuối thì thở ra (end-expiratory absolute esophageal pressure) như là một ước tính đáng tin cậy về áp lực màng phổi, thì việc oxy hóa và compliance tốt hơn đã đạt được khi PEEP được cài đặt theo áp lực xuyên phổi cuối kỳ thở ra là 0-10 cmH2O.[33] Một cách khác để sử dụng giá trị tuyệt đối của áp lực thực quản là để theo dõi nó thay đổi như thế nào do điều chỉnh trong PEEP và VT. Điều này đã được sử dụng để tính toán áp lực xuyên phổi cuối thì hít vào (end-inspiratory transpulmonary pressure), và nó là một dấu hiệu tốt hơn để đánh giá stress phổi so với Pplat khi có sự thay đổi trong sự đàn hồi của thành ngực. Cần cài đặt mức PEEP cao (> 15-18 mm Hg) kèm theo đánh giá huyết động toàn diện và có thể bổ sung thêm bằng các phép đo áp lực xuyên phổi và đánh giá khoảng chết sinh lý bằng cách volumetric capnography.[34,35]
Huy động phế nang
Các thủ thuật huy động được sử dụng như là một chiến lược để cải thiện oxy hóa và giảm nguy cơ atelectrauma ở bệnh nhân ARDS bằng cách mở lại và ổn định các vùng phổi xẹp.[18] Một số thủ thuật huy động đã được đề xuất, bao gồm: các đợt bơm căng giữ (sustained inflations) với các giá trị CPAP từ 35-50 cm H2O trong 20-40 giây, áp lực đỉnh tăng áp, giảm VT (thở dài), thở dài ngắt quãng, tăng PEEP và tăng dần áp lực hít vào đến 40 cm H2O.[36] Việc huy động phế nang cố gắng làm tăng lượng mô phổi có thông khí để cải thiện việc trao đổi khí. Tuy nhiên, chúng có thể làm cho các vùng phổi lành tính bị tăng áp lực và nguy cơ bị quá căng phế nang.
Một số nghiên cứu đã cho thấy cải thiện trao đổi khí với các thủ thuật huy động, nhưng điều này không làm cải thiện tỷ lệ tử vong. Lợi ích từ các cuộc vận động huy động có xu hướng ngắn ngủi, và sự gia tăng áp lực đường thở dẫn đến những phản ứng bất lợi tạm thời (ví dụ, hạ huyết áp, thiếu oxy máu) ở một số ít bệnh nhân. Ví dụ, trong một tổng quan hệ thống gần đây, hạ huyết áp và giảm độ bão hòa xảy ra lần lượt là 12% và 8% đối tượng, trong hoặc sau các động tác đó.[18,36] Tuy nhiên, các tác dụng bất lợi liên tục và nghiêm trọng liên quan đến việc vận động huy động, như sự phát triển của tràn khí màng phổi, vẫn còn hiếm.[37] Hơn nữa, các nghiên cứu cho đến nay vẫn chưa đưa ra được kỹ thuật tối ưu, thời gian và tần suất các động tác huy động. Trên cơ sở dữ liệu sẵn có hiện nay, mặc dù các thủ thuật huy động thông thường không được khuyến cáo để điều trị ARDS, các động tác này có thể cải thiện đáng kể việc oxy hóa ở một số bệnh nhân và nên được xem như là liệu pháp cứu hộ ở những bệnh nhân bị giảm oxy máu kháng trị có nguy cơ tử vong.[38]
Steroid
Steroids có tác dụng điều hòa miễn dịch hiệu quả đối với chứng mất cân bằng viêm, giảm phù nề, tạo thành màng hyalin, suy giảm chất hoạt động bề mặt, và tổn thương màng phế nang mao mạch.[39] Điều trị liều cao và ngắn hạn (methylprednisolone 30 mg/kg/ngày) không chứng minh được sự cải thiện về tử vong và tăng nguy cơ nhiễm trùng.[40] Một phân tích gộp gần đây điều tra liều thấp hơn, được thực hiện sớm hơn và kéo dài hơn, dường như chứng tỏ sự cải thiện chức năng phổi và giảm tử vong.[41] Tuy nhiên, chưa có bằng chứng kết luận về việc sử dụng steroid. Corticosteroid không được khuyến cáo như là liệu pháp cứu hộ ở bệnh nhân ARDS, vì những cải thiện đã được quan sát thấy là chậm trễ và không nhất quán.[42]
Quản lý dịch
ARDS là một chứng phù phổi do viêm, tiết dịch phù giàu protein trong khoảng kẽ phổi, thường liên quan đến thành phần thủy tĩnh. Sự gia tăng trọng lượng phổi sẽ tạo ra sự chèn ép phế nang và làm giảm cơ học phổi và sự trao đổi khí. Tăng áp phổi có thể dễ dàng kết hợp với tăng áp lực mao mạch phổi và suy tim. Trong khi các cơ chế thông thường gây ra phù nề là phẫu thuật và tràn dịch màng phổi, lưu lượng bạch huyết và dẫn lưu mao mạch vào phía tĩnh mạch của mạng lưới mao mạch phổi bị suy giảm do áp lực trong lồng ngực dương liên quan đến thông khí cơ học. Việc sử dụng dịch truyền quá mức dẫn đến tăng lượng nước ngoài mạch máu phổi, là một dấu hiệu tiên đoán xấu trong ARDS. Quản lý dịch truyền tối ưu cung cấp phổi khô trong khi vẫn duy trì sự tưới máu cơ quan.
Một thử nghiệm ARDS Network [44] đã được thiết kế để điều tra những rủi ro và lợi ích của một protocol quản lý dịch truyền. Các đối tượng có ARDS được phân ngẫu nhiên thành nhóm bảo thủ (hạn chế dịch) hoặc nhóm tự do (không hạn chế dịch). Nhóm bảo thủ cho thấy chức năng phổi được cải thiện so với nhóm tự do, với số ngày thở máy và ngày ICU ít hơn không gia tăng suy cơ quan không phải phổi. Không có sự giảm đáng kể tỷ lệ tử vong 60 ngày. Trong 7 ngày đầu tiên, nhóm tự do có sự cân bằng dịch truyền dương khoảng 1 L/ngày, trong khi nhóm bảo thủ cân bằng dịch vẫn giữ mức zero.
Trong nhóm phụ của những bệnh nhân giảm protein máu, có thể có vai trò tăng thải dịch phù khi tính thấm mao mạch phổi và sự ổn định huyết động được khôi phục, bởi vì các bệnh nhân hạ protein máu có thể được điều trị an toàn với sự kết hợp của albumin và furosemide. Sự lợi niệu, giảm cân và bình thường hóa nồng độ protein huyết thanh có thể đạt được, và sau 24-48 giờ đầu tiên, PaO2/FIO2 tăng lên > 60 mm Hg.[45] Một nghiên cứu tiếp theo của cùng một nhóm cũng báo cáo rằng PaO2/FIO2 tăng lên > 40 mm Hg trong 24-72 h so với mức giảm 13-24 mm Hg ở nhóm dùng giả dược.[46] Đây là những cải tiến đáng kể trong việc oxy hóa.
Các thuốc chẹn thần kinh cơ
Nhịp thở tự nhiên có vẻ nguy hiểm ở những bệnh nhân ARDS nặng, trong khi nó có vẻ có lợi ở những bệnh nhân ARDS nhẹ đến trung bình. Các tác nhân chẹn thần kinh cơ (NMBA) nên được dành riêng cho những trường hợp nghiêm trọng nhất để đảm bảo sự đồng bộ của bệnh nhân – máy thở và tránh gây ra áp lực xuyên phổi cao nguy hiểm và VILI.[47]
Điều trị với truyền cisatracurium liên tục trong 48 giờ đầu trong giai đoạn ARDS nặng làm giảm tỷ lệ tử vong 90-ngày và barotrauma. Nó cũng làm tăng số ngày không sử dụng máy thở và số ngày không nằm ICU. Trong bối cảnh này, nguy cơ bị suy yếu do ICU tăng không tăng lên.[48] Sử dụng NMBA sớm làm giảm đáp ứng viêm kết hợp với ARDS và thông khí cơ học. Cơ chế chính xác dẫn đến kết quả cải thiện không rõ ràng. Đồng bộ hóa tốt hơn có thể dẫn đến việc huy động phổi nhiều hơn và cải thiện compliance, trao đổi khí và oxy hóa hệ thống. Đối với viêm phổi, có thể hợp lý là việc kiểm soát được tốt hơn thể tích và áp lực hít vào sẽ làm giảm volutrauma, trong khi việc kiểm soát tốt hơn thể tích và áp lực thở ra làm giảm atelectrauma; kết quả là phản ứng viêm tại phổi và hệ thống ít hơn.[49] Những lợi ích tiềm tàng này phải được cân nhắc trước những mối quan tâm hiện tại về liệu pháp NMBA, bao gồm xẹp phổi tiến triển do mất trương lực cơ hoành (với kết quả gây thiếu oxy máu), và quan trọng nhất là sự yếu cơ liên quan ICU.[50]
Thông khí dao động tần số cao
Thông khí dao động tần số cao (HFOV) là một chế độ thở không thông thường đã được đề xuất để đạt được mục tiêu của chiến lược thông khí bảo vệ với VT rất thấp (bằng hay ít hơn khoảng chết giải phẫu) ở tốc độ rất cao (3-6 Hz); các dao động lưu lượng hình sin được áp dụng quanh một áp lực trung bình đường thở hằng định ( Paw). Chiến lược này tránh được sự quá căng của phế nang bằng cách cung cấp VT thấp (1-3 mL/kg), ngăn ngừa xẹp của phế nang cuối thì thở ra, và duy trì huy động phế nang bằng cách áp dụng một Paw hằng định để tạo điều kiện huy động phổi. [51]
HFOV về mặt lý thuyết đạt được tất cả các mục tiêu của chiến lược thông khí bảo vệ phổi; tuy nhiên, 2 thử nghiệm lâm sàng ngẫu nhiên lớn đã thất bại trong việc chứng minh bất kỳ lợi ích lâm sàng nào khi HFOV được áp dụng trong điều trị ARDS ở người lớn so với chiến lược có VT thấp, PEEP cao và giới hạn Pplat. Young et al [52] không cho thấy bất kỳ sự khác biệt trong tỷ lệ tử vong của HFOV so với thông khí thông thường, trong khi Ferguson et al53 báo cáo sự gia tăng tỷ lệ tử vong với HFOV. Paw cao cho thấy sự căng quá mức của một số vùng phổi mà không tăng sự thông khí của các phế nang đã bị xẹp hoặc ngập nước, đặc biệt là trong các bệnh nhân có phổi không đồng nhất và không thể huy động được. Tử vong tăng cũng có thể là do sự rối loạn huyết động huyết động do tăng nhu cầu thuốc vận mạch và do suy thất phải thứ phát sau khi tăng đáng kể hậu tải thất phải. HFOV không nên được sử dụng thường xuyên thay cho thông khí bảo vệ phổi thông thường, và cần được giữ như là một liệu pháp cứu hộ cho những bệnh nhân bị giảm oxy máu kháng trị và trong một số trường hợp được lựa chọn của ARDS nặng.[54]
Việc đánh giá áp lực xuyên phổi bằng cách đo áp lực thực quản có thể là một chiến lược hợp lý để áp dụng Paw sinh lý hơn, làm giảm nguy cơ tổn thương tích hơn và dẫn đến huy động phổi tối đa và mức độ căng phế nang tối thiểu. Nghiên cứu EPOCH (Clinical Trials.gov NCT02342756) đang sử dụng cách tiếp cận này để điều chỉnh PEEP trong quá trình thông khí cơ học thông thường và Paw trong HFOV.[56]
Giãn mạch phổi chọn lọc
Các thuốc giãn mạch phổi chọn lọc thường được sử dụng để cải thiện oxy hóa ở bệnh nhân giảm oxy máu kháng trị do ARDS. Các tác nhân này tác dụng tại nhu mô phổi có khả năng thông khí, cải thiện sự không phù hợp thông khí/tưới máu. Thuốc giãn mạch phổi chọn lọc thường được sử dụng bao gồm oxit nitơ hít (iNO) và epoprostenol dạng hít, một dạng của prostacyclin.
INO là chất làm giãn mạch cục bộ của các mao mạch trong các phế nang có thông khí tốt, và nó cải thiện tương xứng thông khí/tưới máu ở bệnh nhân ARDS và làm giảm sức cản mạch máu phổi, giúp cải thiện cung lượng tim thất phải.[58] Việc sử dụng iNO thông thường trong ARDS không được khuyến cáo dựa trên bằng chứng hiện tại, nhưng nó đã được sử dụng ở nhiều cơ sở. Việc sử dụng iNO ở những bệnh nhân ARDS không làm giảm đáng kể tỷ lệ tử vong.[59] Sử dụng iNO có thể được xem xét khi bệnh nhân có nguy cơ cao về tử vong sắp xảy ra do thiếu oxy máu kháng trị bất chấp các biện pháp điều trị khác. INO không có hiệu quả đáng kể về thời gian thở máy và ở lại ICU so với nhóm đối chứng. Mặc dù iNO cải thiện oxy hóa trong 24 giờ đầu tiên bằng cách giảm sự không phù hợp thông khí/tưới máu, theo thời gian nó sẽ làm giãn mạch tiếp tục ở những khu vực thông khí kém, làm tăng sự không phù hợp thông khí/tưới máu.[60]
Việc oxy hóa cải thiện không liên quan đến tỷ lệ sống sót tăng lên vì việc cải thiện oxy hóa tạm thời không cho thấy chức năng phổi được cải thiện, giảm tổn thương phổi, hoặc giải quyết các nguyên nhân cơ bản của ARDS, bao gồm cả sang chấn đa cơ quan kết hợp.[61] Với việc sử dụng iNO, sự khác biệt của áp lực động mạch phổi ban đầu có ý nghĩa vào ngày đầu tiên nhưng không còn tồn tại vào ngày 2-4.[61] Nitric Oxide là một chất điều tiết quan trọng của trương lực mạch máu thận và một bộ điều chỉnh chức năng cầu thận. Khi INO được giới thiệu đầu tiên, sự hình thành methaemogloblin, sản sinh ra các dãn xuất nitơ hoạt động, hạ huyết áp, và sự ức chế tiểu cầu là những tác dụng phụ chính, trong khi độc tính ở thận không phải là mối quan tâm chính.[62,63] Các nghiên cứu khác nhau chứng minh rằng iNO làm tăng nguy cơ thương tổn thận ở những người lớn có ARDS và có khả năng tăng gấp đôi nguy cơ điều trị thay thế bằng thận. Vì vậy, sự thay đổi trong sản xuất oxit nitric có thể gây tổn thương thận cấp tính bằng cách thay đổi chức năng của ty thể, các enzym khác nhau và acid deoxyribonucleic. Mặc dù các thử nghiệm đối chứng ngẫu nhiên hoặc các phân tích gộp không đủ, liệu pháp kết hợp với tư thế nằm sấp hoặc HFOV có thể hỗ trợ trong một số nhóm bệnh nhân hoặc như một liệu pháp cứu hộ vì họ có thể nâng cao hiệu quả của INO tốt hơn so với đơn liệu pháp đơn trị.[65]
Epoprostenol dùng đường hít đã được đề nghị thay thế cho INO do hiệu quả tương tự, có tiềm năng thấp hơn đối với các tác dụng phụ toàn thân, dễ điều trị và chi phí thấp hơn đáng kể. Epoprostenol hít đã được chứng minh làm giảm đáng kể áp lực động mạch phổi và tăng oxy hóa. Tuy nhiên, quản lý prostacyclin là thách thức về mặt kỹ thuật vì thời gian bán hủy ngắn và tính nhạy cảm với ánh sáng.[66] Kể từ khi nó được công bố lần đầu tiên để điều trị ARDS vào năm 1993, thiếu dữ liệu chứng minh nó hiệu quả.[57,67] Y văn đánh giá việc sử dụng nó là còn thiếu, và không có nghiên cứu đánh giá tỷ lệ tử vong như là một kết cục chính. Mặc dù thường được sử dụng như một phương pháp điều trị cuối cùng, một khoảng trống trong y văn đã dẫn tới những tranh cãi xung quanh epoprostenol hít về liều lượng và sự an toàn tối ưu, cũng như dân số bệnh nhân mục tiêu.[68,69] Iloprost, một thuốc giãn mạch phổi lựa chọn khác dùng để điều trị tăng áp phổi, có lợi ích lý thuyết ở bệnh nhân ARDS, nhưng có ít bằng chứng để hỗ trợ việc sử dụng nó cho chỉ định này.[70]
Nằm sấp
Tư thế nằm sấp lần đầu tiên được mô tả cách đây 40 năm như một chiến lược thay thế để cải thiện oxy hóa ở bệnh nhân ARDS.[71] Một số cơ chế đã được đề xuất để giải thích hiệu ứng này, bao gồm tái phân bố mật độ phổi với việc huy động phổi vùng lưng, tăng đàn hồi ở ngực, giảm shunt phế nang và tỷ lệ thông khí/tưới máu tốt hơn. Phân bố stress và strain thuận lợi hơn trên vùng phổi rộng hơn và đồng nhất hơn (do hình dạng ngực/phổi phù hợp với thông khí) làm giảm VILI và suy tim phải. Do kết quả của việc huy động phổi, việc đảo ngược tình trạng thiếu oxy máu và giảm áp lực đẩy là những lời giải thích hợp lý nhất cho việc giảm sức cản của mạch phổi và kích thước tim phải ở tư thế nằm sấp.[72] Sự chuyển đổi lực hấp dẫn làm giảm sự xẹp phổi và giảm tối thiểu sự chèn ép nhu mô phổi do cấu trúc tim và trung thất, kết quả là sự phù hợp thông khí/tười máu được cải thiện.[73]
Các thử nghiệm ngẫu nhiên trước đây cho thấy lợi ích về tử vong không nhất quán khi sử dụng tư thế nằm sấp; tuy nhiên, các nghiên cứu này bao gồm tất cả các đối tượng ARDS (từ nhẹ đến nặng), tư thế nằm sấp được duy trì trong 6 giờ/ngày, và không áp dụng thông khí cơ khí bảo vệ.[74,75] Mặc dù những hạn chế này, tỷ lệ sống sót tăng ở những người có ARDS nặng nhất được điều trị ở tư thế nằm sấp.[74] Sau đó, 2 thử nghiệm đã ghi nhận các đối tượng giảm oxy máu nặng hơn với thời gian nằm sấp lâu hơn (20 giờ/ngày), không có hiệu quả.[76,77] Tuy nhiên, phân tích gộp các nghiên cứu trước đây cho thấy có lợi ích sống còn của bệnh nhân có PaO2/FIO2 < 140 mm Hg khi nhập viện.[78]
Thử nghiệm PROSEVA [79] là một thử nghiệm đối chứng ngẫu nhiên đa trung tâm về việc áp dụng sớm tư thế nằm sấp kéo dài (16 giờ/ngày) ở những bệnh nhân ARDS nặng. Trong thử nghiệm này, mức độ nghiêm trọng ARDS được định nghĩa là PaO2/FIO2 ≤ 150 với PEEP ≥ 5cmH2O, FIO2 ≥ 0,6, với VT trung bình là 6.1 mL/kg trọng lượng cơ thể dự đoán. Thử nghiệm PROSEVA cho thấy tỷ lệ tử vong giảm đáng kể ở 28 ngày và 90 ngày ở những bệnh nhân điều trị với tư thế nằm sấp. Khởi đầu điều trị có xu hướng là một yếu tố quan trọng để thành công. Quá trình chuyển bệnh nhân đến tư thế nằm sấp có thể tốn nhiều công lao động và làm tăng nguy cơ tụt ống nội khí quản, ống dẫn lưu, catheter, và sự phát triển của các vết loét chèn ép. Mặc dù tư thế nằm sấp dẫn đến một số thách thức kỹ thuật, khi nó được thực hiện bởi một đội ngũ có kỹ năng, các tác động bất lợi là tương đối thấp và chúng được khắc phục đáng kể bởi các hiệu ứng có lợi.
Chống chỉ định tư thế nằm sấp phải được xem xét, chẳng hạn như tăng áp lực nội sọ hoặc giảm lưu lượng tưới máu não, nhu cầu tức thời cho thủ thuật phẫu thuật hoặc can thiệp, phẫu thuật lồng ngực gần đây, chấn thương hoặc phẫu thuật trên mặt gần đây, mất ổn định huyết động, thai nghén hoặc hội chứng tăng áp lực ổ bụng, và gãy xương không ổn định: xương sống, xương chậu, hoặc xương đùi.[80]
Oxy hóa màng ngoài cơ thể
Trong tình trạng thiếu oxy máu trầm trọng không đáp ứng với điều trị thông thường, như thông khí thể tích khí lưu thông thấp, áp lực thấp, tư thế nằm sấp, iNO, và HFOV, oxy hóa màng ngoài cơ thể (ECMO) có thể được sử dụng như một liệu pháp cứu hộ bằng cách bảo đảm oxy hóa cũng như loại bỏ carbon dioxide trong khi phổi đang nghỉ ngơi với áp lực thở máy thấp và nồng độ ôxy thấp.[9]
Hỗ trợ ECMO thông thường được thực hiện thông qua tiếp cận tĩnh mạch, trong đó máu được thoát thông qua các tĩnh mạch chủ trên hoặc chủ dưới và trả về tâm nhĩ phải. ECMO được chỉ định khi PaO2/FIO2 < 80, khi FIO2 > 90%, và khi điểm số tổn thương phổi là 3-4; trong trường hợp này nguy cơ tử vong vượt quá 80%.[81] Trong định nghĩa Berlin của ARDS, ECMO được đề xuất như là một liệu pháp cứu hộ cho giảm oxy máu trầm trọng khi PaO2/FIO2 < 50. ECMO được xem xét khi Pplat vượt quá 32 cm H2O, FIO2 = 100%, SpO2 < 90%, hay pH < 7.2.[82]
Thật vậy, một khi các bệnh nhân ở ECMO, máu có thể được oxy hóa tốt với PaCO2 bình thường và pH trung tính; mục tiêu của thông khí bảo vệ phổi đã đạt được và VILI được giảm thiểu.[83] Ở những bệnh nhân ARDS nặng đặc biệt khi sử dụng ECMO, VT giảm đáng kể gần một nửa, dẫn đến giảm đáng kể Pplat và tái xẹp phổi mặc dù PEEP vẫn ổn định. Có thể mất một khoảng thời gian dài để một số bệnh nhân mở lại phổi, và có thể có sự cân bằng giữa nguy cơ quá căng phế nang và nguy cơ tái xẹp phổi.84
Trong vài thập kỷ gần đây, hầu hết các thử nghiệm đánh giá ECMO đều không cho thấy có lợi ích về tỉ lệ tử vong do nhiều yếu tố, bao gồm khoảng thời gian kéo dài giữa khởi phát ARDS và trợ giúp ECMO, khả năng ôxy hóa và loại bỏ CO2 của các thiết bị đã sử dụng và tỷ lệ biến chứng kỹ thuật cao, như chảy máu do kháng đông mạnh để vượt qua sự tương hợp sinh học kém của hệ thống ECMO (màng ECMO). Tuy nhiên, gần đây, đã có những tiến bộ đáng kể trong việc sản xuất các hệ thống ECMO có tính tương thích sinh học cao hơn, thực hiện ở mức cao hơn, và bền hơn.
Thử nghiệm CESAR (United Kingdom-based Conventional Ventilation or ECMO for Severe Adult Respiratory Failure)86 và những kết quả tốt của những người nhận được ECMO thế hệ mới nhất như là liệu pháp cứu hộ trong đại dịch cúm A (H1N1) đã làm quan tâm đến ECMO trở lại cho bệnh nhân ARDS nặng. Thử nghiệm CESAR ở người lớn có ARDS cho thấy sự gia tăng tỷ lệ sống 6 tháng từ 50% đến 63% ở nhóm ECMO, nhưng sự khác biệt so với nhóm chứng không có ý nghĩa.[86] Khi kết hợp tử vong và điểm kết thúc khuyết tật 6 tháng, sự khác biệt trở nên có ý nghĩa đối với nhóm ECMO. Tuy nhiên, không thể kết luận ECMO là tốt hơn thông khí cơ học, bởi vì tất cả các đối tượng cần ECMO chỉ được phân bổ ở một trung tâm có tay nghề cao và nhóm kiểm soát không được thông khí với một chiến lược bảo vệ phổi.[87,88]
Tuy nhiên, điều trị ECMO ở nơi có kỹ năng thực hành lâm sàng tốt, như được báo cáo bởi Extracorporeal Life Support Organization International Registry Report, trong đó số lượng điều trị ECMO dành cho người lớn ngày càng nhiều.[89] ECMO hiện đang được tiến hành thử nghiệm “Rescue Lung Injury in Severe ARDS” là một thử nghiệm đối chứng ngẫu nhiên đa trung tâm, so sánh thông khí cơ học thông thường với tư thế nằm sấp + ECMO trong các đối tượng ARDS rất nặng (PaO2/FIO2 < 80mmHg).[90] Khởi đầu sớm của một chiến lược ECMO có thể làm giảm tỷ lệ tử vong từ 45-50% xuống < 20%, có suy giảm khả năng nhận thức và tâm thần thấp hơn và cải thiện chất lượng cuộc sống ở những người sống sót trong thời gian dài.[91] Các lợi ích có thể có của sự hỗ trợ sự sống ngoài cơ thể phải được cân đối với các biến chứng nguy hiểm như chảy máu, huyết khối, nhiễm trùng, thiếu máu cục bộ ở phần xa của chi.[83] Không có chống chỉ định tuyệt đối đối với ECMO; tất cả các trường hợp phải được thảo luận, và các chỉ dẫn và giới hạn có thể sẽ thay đổi khi các nghiên cứu trong tương lai được thực hiện.
Tóm lược
ARDS là một hội chứng gây ra bởi các bệnh khác nhau và dẫn đến tình trạng thiếu oxy máu kháng trị đe dọa mạng sống. Việc leo thang liên tục các liệu pháp có thể được xem xét trên cơ sở cá nhân. Mặc dù đã có nhiều thập kỷ điều tra các chiến lược điều trị tiềm năng, việc sử dụng thông khí phổi bảo vệ với VT là 6 mL/kg trọng lượng cơ thể dự đoán và Pplat < 30 cm H2O vẫn là phương pháp duy nhất được chứng minh để làm giảm tỷ lệ tử vong ở ARDS. Mục tiêu oxy hóa/độ bão hòa dựa trên bảng PEEP/FIO2 là một cách tiếp cận phổ biến để cài đặt PEEP, nhưng mối quan hệ giữa tỷ lệ tử vong và Pplat cao chỉ quan sát thấy khi áp lực đẩy cũng trên 15 cm H2O. Ở bệnh nhân ARDS, các thủ thuật huy động cải thiện việc oxy hóa, nhưng đây là cách tiếp cận tạm thời không làm cải thiện tỷ lệ tử vong. Có bằng chứng về việc sử dụng chất steroid không có lợi ích, và sự cân bằng dịch truyền bảo thủ không tốt hơn so với cân bằng dịch truyền tự do. NMBA đảm bảo huy động phổi thống nhất, ngăn ngừa áp lực xuyên phổi cao gây nguy hiểm, giảm phản ứng viêm khớp kết hợp với ARDS, nhưng cách tiếp cận này phải được cung cấp trong vòng 48 giờ đầu tiên để ngăn ngừa sự teo cơ hoành và sự yếu cơ liên quan ICU. HFOV về mặt lý thuyết đạt được tất cả các mục tiêu của chiến lược thông khí bảo vệ phổi, tuy nhiên, các thử nghiệm lâm sàng ngẫu nhiên không chứng minh bất kỳ lợi ích lâm sàng nào. INO tạm thời cải thiện oxy hóa, nhưng nó không liên quan với tỷ lệ sống sót tăng lên và không có bất kỳ lợi ích nào đối với chức năng của phổi. Việc đặt tư thế nằm sấp ở bệnh nhân ARDS nặng thúc đẩy sự thay đổi lực trọng lực, giảm thiểu sự nén nhu mô phổi do tim và cấu trúc trung thất, và cải thiện sự kết hợp thông khí và tưới máu. ECMO ngày càng được sử dụng để hỗ trợ những người lớn bị bệnh nặng, những người đã thất bại trong việc xử trí thông thường, và có thể là một phương pháp điều trị cứu hộ hiệu quả cho bệnh nhân ARDS có suy hô hấp; tuy nhiên, thử nghiệm có đối chứng là cần thiết để xác định tốt hơn các chỉ dẫn và thực hành tốt nhất cho liệu pháp này.





