Trên thị trường hiện nay có rất nhiều thuốc gerneric có hoạt chất là Telmisartan tuy nhiên lại rất ít thông tin liên quan đến hoạt chất này. Ở bài này HealCentral.org xin được chia sẻ các thông tin như: Cơ chế tác dụng của Telmisartan là gì? Telmisartan có tác dụng gì? Tác dụng phụ của Telmisartan là gì?… Dưới đây là thông tin chi tiết.
Lịch sử nghiên cứu và phát triển
Telmisartan là 1 thuốc chẹn thụ thể angiotensin (Angiotensin Receptor Blockers – ARBs) được sử dụng trong điều trị tăng huyết áp.
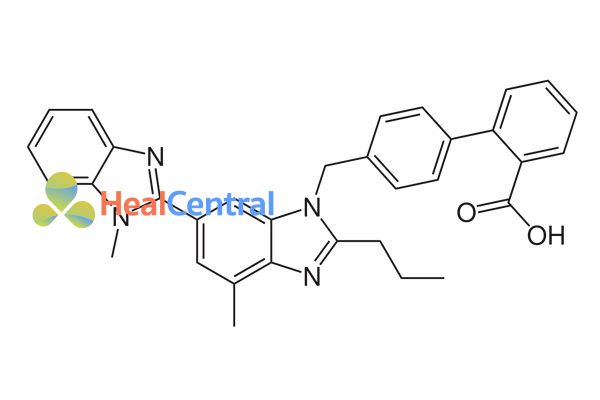
Thuốc được phát triển và sản xuất bởi Boehringer Ingelheim với biệt dược gốc là Micardis. Telmisartan được cấp bằng sáng chế năm 1991 và được chấp thuận cho sử dụng trong y tế từ năm 1999.
Dược lực học
Bình thường, trong cơ thể, khi có một lí do gì đó làm giảm dòng máu đến thận, cơ thể sẽ có cơ chế để bù trừ bằng hoạt hóa hệ RAA (renin – angiotensin – aldosterone). Sản phẩm cuối cùng của con đường hoạt hóa là angiotensin II, chất này liên kết với thụ thể AT1 gây ra các tác dụng:
- Tăng sinh và phì đại thất (đặc biệt là thất trái).
- Co mạch nên gây tăng huyết áp.
- Kích thích vỏ thượng thận tiết aldosterone nên giữ natri và nước, làm tăng thể tích tuần hoàn và tăng huyết áp.
Như vậy khi telmisartan liên kết với thụ thể này, nó làm mất tác dụng của angiotensin II, như vậy 3 tác dụng trên sẽ bị đảo ngược lại. Huyết áp sẽ hạ và sự phì đại cũng như xơ hóa thất cũng giảm.
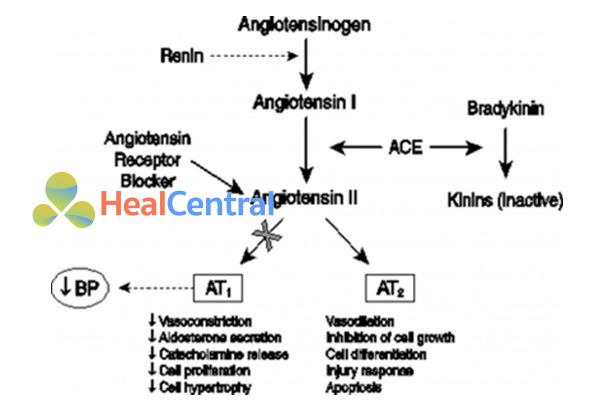
Do giảm tác dụng của aldosterone nên thuốc gây giữ kali, làm tăng kali huyết thanh.
Một số thử nghiệm lâm sàng
Một phân tích tổng hợp các thử nghiệm ngẫu nhiên của liệu pháp telmisartan so với valsartan về tác dụng hạ huyết áp.
Các tác giả: Takagi H, Niwa M, Mizuno Y, Goto SN và Umemoto T, nhóm ALICE (All-Literature Investigation of Cardiovascular Evidence) thuộc Phòng Phẫu thuật Tim mạch, Trung tâm Y tế Shizuoka, Shizuoka, Nhật Bản. kfgth973@ybb.ne.jp.
Một phân tích tổng hợp trước đây về 6 thử nghiệm ngẫu nhiên nối tiếp nhau cho thấy rằng khả năng hạ huyết áp của telmisartan có thể so sánh được với các thử nghiệm của valsartan.
Các tác giả đã thực hiện 1 phân tích tổng hợp cập nhật về liệu pháp telmisartan so với valsartan về làm giảm huyết áp ở bệnh nhân tăng huyết áp. Dữ liệu từ MEDLINE, EMBASE và Trung tâm Đăng kí Thử nghiệm đối chứng Cochrane đã được tìm kiếm đến hết tháng 8/2012 bằng các công cụ tìm kiếm web (PubMed, OVID). Các nghiên cứu đủ điều kiện là các thử nghiệm tiền cứu đối chứng ngẫu nhiên kiểm tra liệu pháp telmisartan so với valsartan và báo cáo kết quả huyết áp lâm sàng. Với mỗi nghiên cứu, dữ liệu liên quan đến những thay đổi từ đường cơ sở đến huyết áp tâm thu (SBP) và huyết áp tâm trương (DBP) lâm sàng cuối cùng ở cả 2 nhóm telmisartan và valsartan đã được sử dụng để tạo ra chênh lệch trung bình (MD) và khoảng tin cậy 95% (CI). Trong số 62 bài báo có khả năng liên quan được sàng lọc ban đầu, 17 báo cáo về các thử nghiệm lâm sàng tiền cứu đối chứng ngẫu nhiên của liệu pháp telmisartan so với valsartan, bao gồm tổng cộng 5422 bệnh nhân bị tăng huyết áp, đã được xác định và đưa vào.
Phân tích gộp cho thấy sự khác biệt đáng kể trong giảm huyết áp ở những bệnh nhân được điều trị ngẫu nhiên bằng telmisartan so với valsartan (MD cho SBP -2.04 mmHg, 95% CI -2.80 đến -1.28 mmHg, P < 0.00001, MD cho DBP -1.08 mmHg, 95% CI -1.55 đến -0.62 mmHg, P < 0.00001). Khi dữ liệu từ các thử nghiệm đơn trị liệu và kết hợp (với hydrochlorothiazide) được gộp chung, liệu pháp telmisartan có liên quan đến sự khác biệt có ý nghĩa thống kê trong giảm huyết áp so với điều trị bằng valsartan ở cả 2 nhóm đơn trị liệu và phối hợp.
Tóm lại, telmisartan dường như làm giảm huyết áp nhiều hơn so với valsartan trên bệnh nhân tăng huyết áp.
Dược động học
Hấp thu: Thời gian khởi phát tác dụng là 1-2 giờ. Thời gian tác dụng là dưới 24 giờ. Thời gian đạt nồng độ đỉnh trong huyết tương (Tmax) là 0.5-1 giờ.
Phân bố: Tỉ lệ liên kết protein huyết tương là trên 99.5%. Thể tích phân bố (Vd) là 500 L.
Chuyển hóa: Thuốc được chuyển hóa tại gan thành chất chuyển hóa không hoạt tính.
Thải trừ: Thời gian bản thải (t1/2) là 24 giờ. Bài xuất qua phân (> 97%) là chủ yếu và nước tiểu một lượng nhỏ.
Chỉ định và liều dùng
Tăng huyết áp:

40 mg/ngày PO khởi đầu, chuẩn độ lên 20-80 mg/ngày PO tùy theo đáp ứng. Bệnh nhân bị giảm thể tích tuần hoàn nên nhận liều khởi đầu thấp hơn, dưới sự giám sát chặt chẽ.
Nhìn chung nên chỉnh liều hàng tháng. Chỉnh liều tích cực hơn ở những bệnh nhân có nguy cơ cao. Thuốc cũng có thể được kết hợp với hydrochlorothiazide (Micardis HCT) hoặc amlodipine (Twynsta).
Giảm nguy cơ tim mạch:
80 mg/ngày PO. Không rõ liều lượng dưới 80 mg/ngày có làm giảm nguy cơ mắc bệnh tim mạch hoặc tử vong hay không.
Chú thích: PO: đường uống.
Chỉnh liều:
Suy thận: Không cần chỉnh liều. Bệnh nhân chạy thận nhân tạo có nguy cơ hạ huyết áp thế đứng.
Suy gan: Bắt đầu từ liều thấp và chuẩn độ từ từ. Theo dõi chặt chẽ.
Tác dụng phụ
Thường gặp (1-10%):
- Nhiễm trùng đường hô hấp trên (7%), viêm xoang (3%), viêm họng (1%).
- Đau lưng (3%), đau ngực (3%), đau cơ (3%).
- Tiêu chảy (3%).
- Tăng huyết áp (1%).
- Đau đầu (1%), mệt mỏi (1%).
Tác dụng phụ < 1%:
- Điện tâm đồ (ECG) bất thường, đau thắt ngực, nhịp tim chậm.
- Thiếu máu.
- Phù mạch, eczema.
- Chảy máu cam.
- Gout.
- Tăng cholestorol máu, tăng kali máu, hạ đường huyết.
- Viêm tai giữa.
Lưu ý và thận trọng
Cảnh báo hộp đen:
Ngừng thuốc ngay lập tức nếu phát hiện có thai. Thuốc có thể gây ra chứng ít dịch ối, có thể gây tổn thương cho thai nhi hoặc tử vong.

Thận trọng:
Điều trị bất kì sự giảm thể tích tuần hoàn hoặc giảm muối trước khi bắt đầu điều trị. Theo dõi các dấu hiệu và triệu chứng hạ huyết áp.
Đáp ứng về huyết áp ở bệnh nhân da đen ít hơn so với bệnh nhân da trắng.
Nguy cơ gặp các phản ứng nhạy cảm, bao gồm phản ứng phản vệ hoặc phù mạch.
Thận trọng với bệnh nhân suy tim sung huyết, có nguy cơ rối loạn chức năng thận.
Thận trọng với bệnh nhân bị suy thận, bệnh đường mật tắc nghẽn hoặc suy gan.
Phối hợp với thuốc ức chế hệ RAA khác làm tăng nguy cơ hạ huyết áp, tăng kali máu và thay đổi chức năng thận (bao gồm suy thận cấp).
Phụ nữ mang thai: Không nên sử dụng cho phụ nữ mang thai (xem phần Cảnh báo hộp đen). Phân loại thai kì: Tam cá nguyệt thứ nhất: C, tám cá nguyệt thứ hai và thứ ba: D.
Phụ nữ đang cho con bú: Không khuyến khích do không biết thuốc có vào được sữa mẹ hay không.
Tương tác thuốc
Dùng cùng thuốc ức chế hệ RAA khác (ACEIs hoặc aliskiren): Không thu được bất kỳ lợi ích bổ sung nào so với đơn trị liệu. Tránh phối hợp này.
Dùng cùng các thuốc hạ huyết áp khác (chẹn kênh calci, lợi tiểu…): Hiệp đồng tác dụng hạ huyết áp. Chỉnh liều mỗi thuốc khi phối hợp.
Dùng cùng các thuốc gây tăng kali huyết thanh (spironolactone, triamterene, muối kali…): Có thể gây tăng kali máu quá mức, nguy cơ xoắn đỉnh, rung thất.

Dùng cùng lợi tiểu thiazide (hydrochlorothiazde, indapamide…): Phối hợp ưu tiên trên lâm sàng do giảm được tác dụng không mong muốn của mỗi thuốc.
Dùng cùng các thuốc là cơ chất của OATP1B1 (elagolix, eluxadoline, revefenacin…): Tăng nồng độ các thuốc này trong huyết tương. Tăng nguy cơ gặp các tác dụng phụ cũng như độc tính của nó.
Dùng cùng các thuốc là cơ chất của OAT3 (baricitinib…): Tăng nồng độ các thuốc này trong huyết tương. Tăng nguy cơ gặp các tác dụng phụ cũng như độc tính của nó.
Phối hợp với thuốc cảm ứng OATP1B1 (apalutamide…): Làm giảm nồng độ huyết tương của telmisartan do tăng thải trừ. Nguy cơ kiểm soát huyết áp cũng như các bệnh lý tim mạch đi kèm không tốt.
Phối hợp với thuốc ức chế OATP1B1 (atorvastatin…): Làm tăng nồng độ trong huyết tương và tăng tác dụng của telmisartan. Nguy cơ huyết áp giảm mạnh và gặp các tác dụng phụ khác của telmisartan.

Dùng cùng lithium: Tăng độc tính của lithium do giảm thải trừ ở thận.
Chống chỉ định
Quá mẫn cảm với telmisartan (sốc phản vệ, phù mạch) hoặc bất cứ thành phần nào của thuốc.
Phụ nữ đang mang thai, đặc biệt là tam cá nguyệt thứ hai và thứ ba.
Hẹp động mạch thận hai bên.
Phối hợp với aliskiren trên bệnh nhân đái tháo đường.
Tài liệu tham khảo:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2672448/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5642122/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3154038/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2937316/
https://clinicaltrials.gov/ct2/show/NCT00890084